血清嗜铬粒蛋白A测定在神经内分泌肿瘤诊断中的价值*
2022-07-29王舒敏
王舒敏,俞 飞,王 峰,瞿 卫
南京医科大学附属南京医院/南京市第一医院核医学科,江苏南京 210006
神经内分泌肿瘤(NEN)是一组起源于肽能神经元和神经内分泌细胞的异质性肿瘤,按照肿瘤分化程度不同,可将其分为分化良好的神经内分泌瘤(NET)和分化差的神经内分泌癌(NEC)。NEN所涉及的部位广泛,可在人体许多器官和组织的神经内分泌细胞中产生,其中以胃肠胰神经内分泌肿瘤(GEP-NEN)最为常见,约占所有NEN的55%~70%[1-2]。NEN发病率近年来在全球范围已呈逐年增加的态势,而GEP-NEN在消化道恶性肿瘤中的患病率仅次于结直肠癌[3]。因而,寻找一个可用于筛查、诊断、动态监测且具有高特异性的NEN检测指标就变得极为重要。嗜铬粒蛋白A (CgA)是一个相对分子质量为48×103的酸性、亲水性分泌蛋白,属嗜铬蛋白家族,位于弥散性神经内分泌系统的许多正常和肿瘤性神经内分泌细胞及内分泌腺的内分泌细胞,其在神经内分泌细胞的细胞内和细胞外功能中均起着重要作用[4-5]。CgA检测已经成为NEN诊断中不可或缺的一部分,临床普遍采用病理组织免疫组化染色观察CgA水平。病理学检测虽然对NEN有较好的诊断价值,但并不能起到很好的筛查与疗效评估作用,相较于血清指标有明显的局限性。国内的一些研究中,未能将血清CgA与NEN患者的影像特征相联合,不能更好地反映NEN患者的疾病状态,使得研究不够深入。因此,本文主要联合影像结果来探索血清CgA在NEN中的诊断价值。
1 资料与方法
1.1一般资料 收集2019年9月至2021年5月在本院就诊的NEN患者70例作为研究对象。纳入标准:病理确诊为NEN患者,具有病理分级及治疗史信息。排除标准:排除原发病灶不明的患者,存在2个及以上不同部位原发病灶的患者,以及合并其他肿瘤的患者。研究对象中男性36例,女性34例,年龄23~82岁,平均(54.61±12.73)岁。将NEN患者根据正电子发射及计算机断层扫描(PET-CT)的影像学结果分为有活动性病灶NEN患者48例(有活动性病灶组)和无活动性病灶NEN患者22例(无活动性病灶组)。有活动性病灶NEN患者按照肿瘤原发部位分为14例直肠患者和34例非直肠(包括胰腺20例,胃、小肠等其他部位14例)患者。研究对象根据肿瘤类型分为NET64例、NEC6例;根据病理分级分为G1期22例、G2期37例、G3期11例;根据治疗史分为未治疗23例、手术44例、生长抑素类似物治疗17例、化疗12例、介入及射频消融12例、放疗2例、核素治疗4例。另外同期在本院体检人群中招募44例健康志愿者作为健康对照组,其中男性22例,女性22例,年龄21~80岁,平均(50.59±12.34)岁。本次实验所有研究对象均已签署知情同意书,并通过医院医学伦理委员会批准。
1.2方法
1.2.168Ga-DOTA-NOC PET/CT显像 于净化实验室采用自动化模块(德国ITM公司)合成68Ga-DOTA-NOC,根据NEN患者体重情况静脉注射3~5mci68Ga-DOTA-NOC,50~80 min后行PET/CT(上海联影医疗科技有限公司uM780)显像,扫描范围自颅骨至股骨中段,扫描3~4床位,每床位采集时间为3 min。CT扫描参数:电压130 kV,电流80 mA,层厚3 mm;PET图像经CT数据衰减校正后行迭代重建,获得融合图像,计算最大标准摄取值(SUVmax)。
1.2.2血清CgA检测 采集所有研究对象静脉血3 mL,以3 000 r/min离心10 min,取上层血清于-70 ℃保存备用。采用双抗体夹心ELISA检测血清CgA水平,CgA检测试剂盒来自法国Clsbio Biosays公司产品,以试剂盒内校准品吸光度绘制标准曲线,计算血清样本吸光度对应的结果值,吸光度测量仪器为安图PHOMO酶标仪(型号:PHOMO;制造商:郑州安图),实验操作均严格按照试剂盒及仪器说明书进行。
2 结 果
2.1不同组别之间CgA水平比较 有活动性病灶组、无活动性病灶组及健康对照组的血清CgA水平分别为114.23(55.67,232.82)ng/mL、56.00(32.90,104.83)ng/mL及40.39(31.40,57.87)ng/mL,差异有统计学意义(P<0.05)。进一步两两比较并校正后发现,有活动性病灶组CgA水平显著高于健康对照组,差异有统计学意义(P<0.05);有活动性病灶组CgA水平高于无活动性病灶组,但差异无统计学意义(P>0.05);无活动性病灶组CgA水平与健康对照组比较差异无统计学意义(P>0.05)。
因无活动性病灶组CgA水平与健康对照组比较差异无统计学意义(P>0.05),所以将两组合并为总对照组(共计66例)。重新统计总对照组CgA水平为[42.62(31.91,69.68)ng/mL],再将其与有活动性病灶组比较,有活动性病灶组CgA水平显著高于总对照组,差异有统计学意义(P<0.05)。有活动性病灶组肿瘤原发部位在胰腺的患者CgA水平[196.26(54.51,862.55)ng/mL]明显高于总对照组,差异有统计学意义(P<0.05),而有活动性病灶组肿瘤原发部位在直肠患者CgA水平[63.90(42.32,116.69)ng/mL]与总对照组比较差异无统计学意义(P>0.05),有活动性病灶组肿瘤原发部位在非直肠患者CgA水平[173.37(61.88,596.87)ng/mL]与总对照组比较,差异有统计学意义(P<0.05)。
2.2不同临床特征的有活动性病灶组患者血清CgA水平比较 有活动性病灶组年龄、性别、是否进行治疗、肿瘤分化程度、病理分级、肿瘤是否转移及转移部位对CgA水平均无明显影响(P>0.05),但肿瘤原发部位不同时CgA水平存在差异,有活动性病灶组肿瘤原发部位在非直肠患者CgA水平显著高于肿瘤原发部位在直肠患者,差异有统计学意义(P<0.05)。见表1。
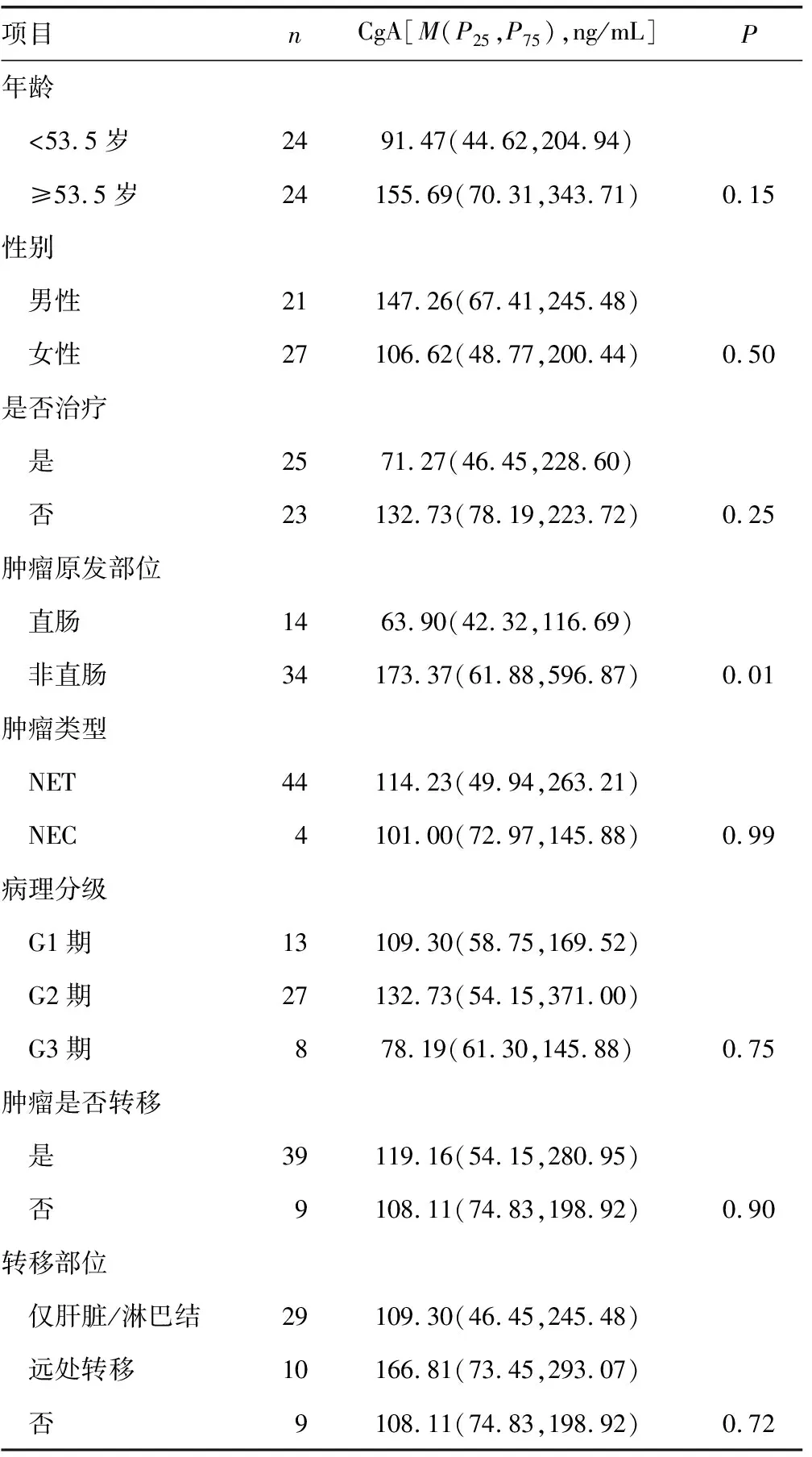
表1 不同临床特征的有活动性病灶组患者血清CgA水平比较
2.3有活动性病灶NEN患者CgA水平与肿瘤负荷程度的相关性分析 以有活动性病灶NEN患者PET/CT影像结果中的SUVmax作为有活动性病灶NEN患者肿瘤负荷程度的评价指标,分析有活动性病灶NEN患者CgA水平与肿瘤负荷程度的相关性。结果显示,有活动性病灶NEN患者的SUVmax与CgA水平呈显著正相关(r=0.30,P<0.05) 。其中,肿瘤原发部位在胰腺的有活动性病灶NEN的SUVmax与CgA水平无明显相关性(r=0.38,P=0.10);肿瘤原发部位在直肠的有活动性病灶NEN的SUVmax与CgA水平也无明显相关性(r=-0.45,P=0.11),而肿瘤原发部位在非直肠的有活动性病灶NEN的SUVmax与CgA水平呈显著正相关(r=0.36,P<0.05)。
2.4ROC曲线分析血清CgA对有活动性病灶NEN的诊断价值 血清CgA诊断有活动性病灶NEN的曲线下面积(AUC)为0.771,血清CgA为102.14 ng/mL为ROC曲线的最佳临界值,灵敏度为56.2%,特异度为90.9%。血清CgA诊断肿瘤原发部位在胰腺的有活动性病灶NEN的AUC为0.780,血清CgA为123.01 ng/mL为ROC曲线的最佳临界值,灵敏度为60%、特异度为93.9%;血清CgA诊断肿瘤原发部位在直肠的有活动性病灶NEN的AUC为0.650,血清CgA为103.48 ng/mL为ROC曲线的最佳临界值,灵敏度为35.7%,特异度为90.9%;血清CgA诊断肿瘤原发部位在非直肠的有活动性病灶NEN的AUC为0.821,血清CgA为102.14 ng/mL为ROC曲线的最佳临界值,灵敏度为64.7%,特异度为90.9%。见图1。
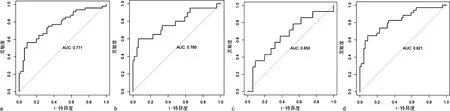
注:a~d分别代表血清CgA诊断有活动性病灶NEN的ROC曲线、血清CgA诊断肿瘤原发部位在胰腺的有活动性病灶NEN ROC曲线、血清CgA诊断肿瘤原发部位在直肠的有活动性病灶NEN的ROC曲线、血清CgA诊断肿瘤原发部位在非直肠的有活动性病灶NEN的ROC曲线。
3 讨 论
NEN作为一个罕见疾病,其发病率逐年增加,当该病被发现时,往往已经为症状晚期,而组织病理学涉及侵入性活组织检查,对异质性肿瘤只有随机的一次性评估价值。因此,组织活检存在一定的局限性,而血清CgA检测作为一个血清指标能够展现出更多的临床优势,在监测疾病进展、评估治疗反应和预测预后等方面都有较好的应用价值[6-8]。
本研究ROC曲线分析可看出,血清CgA对有活动性病灶的NEN患者有较好的诊断特异度,但其诊断灵敏度并不高,在CgA最佳临界值为102.14 ng/mL时,灵敏度为56.2%,这与WANG等[9]报道的结果相近,同时也符合MALCZEWSKA等[10]的报道结果。可以看出,血清CgA检测存在一定的假阴性结果。而这种结果的出现大多是因为人体CgA的表达水平受到多种因素影响,从而使其灵敏度与特异度降低[11]。它与血清尿素氮、肌酐、α2-球蛋白、红细胞分布宽度、红细胞沉降率、血糖呈正相关,与血红蛋白、血小板、血清清蛋白呈负相关,还与慢性肾衰竭、动脉高血压、糖尿病及抑制胃酸类药物的使用有关。因此,有学者通过联合常规生化参数建立了一套评分体系,以此来提高血清CgA在NEN患者中的诊断准确性[12-13]。
本研究中有活动性病灶组患者的SUVmax与CgA水平呈显著正相关(r=0.30,P<0.05),所以血清CgA在肿瘤的负荷程度评估方面也存在一定的价值[14]。同时也有研究表明CgA可以作为NEN的预后标志物,并对NEN患者预后存活率的评估有重要意义,研究表明转移性疾病患者的CgA水平也明显高于非转移性疾病患者,治疗后早期CgA水平下降与NEN患者生存率呈正相关,并且在根治性手术后,CgA水平增加预示着9~12个月后NEN患者疾病复发的风险增加[15-17]。本研究对是否进行过治疗及是否出现转移的NEN患者的CgA水平进行比较时,并未发现类似的结果,这可能是纳入本次研究的样本量相对较少而导致的结果差异,未来需要扩大样本量进一步深入研究。
血清CgA水平在不同部位的表达有显著差异,这主要体现在直肠与非直肠部位,但在不同的病理分级中却没有明显差异,而这方面病理诊断指标突触素有较好的表达差异[18]。本研究结果可以看出虽然血清CgA对NEN的总体诊断价值较高,但在肿瘤原发部位在直肠的有活动性病灶NEN的诊断表现极为不理想,血清CgA的诊断灵敏度在临界值为103.48 ng/mL时仅有35.7%,这也符合其他研究中所报道的CgA对后肠类癌(起源左横结肠至远端结肠、直肠、肛门)仅在20%~50%的病例中免疫组化染色呈阳性[19]。本研究结果显示,有活动性病灶组肿瘤原发部位在直肠患者血清CgA水平与总对照组比较差异无统计学意义(P>0.05)。国外有研究发现,肿瘤原发部位在直肠的NEN患者很少出现血清CgA水平升高,因此与其他部位NEN相比,血清CgA并不适合诊断或随访大多数肿瘤原发部位在结直肠的NEN患者[20]。于是,为了解决这一问题,研究者们发现一种新的神经内分泌细胞生物标志物——促泌素,并通过研究得出其在肿瘤原发部位在结直肠的NEN患者中的表达更为显著,具有更高的诊断灵敏度与特异度,因此,将其与CgA联合检测在未来是对NEN更有价值的诊断方法[21-22]。
由于血清CgA检测存在一定的局限性,所以其在NEN中的应用价值一直被人们所争论[23-24],但作为一个血清检测指标,它确实拥有其他检测手段所不具备的便捷、随时检测、可贯穿患者整个病程等优势,并且在NEN的诊断、预后及生存率评估等方面均有重要的临床作用。
