血清miR-124-3p、TLR4水平在慢性阻塞性肺疾病患者中表达变化及临床意义*
2022-07-29李欣欣蒋彩花
李欣欣,蒋彩花
山东省公共卫生临床中心:1.检验科;2.汉光微生物实验室,山东济南 250101
慢性阻塞性肺疾病(COPD)的特征是持续性气流阻塞,COPD是全世界发病率和病死率最高的疾病之一,在全球疾病经济负担中排名第5[1-2]。诱发COPD的因素较多,如呼吸道感染、吸烟、空气污染等,但其发病机制尚不清晰。慢性阻塞性肺疾病急性加重期(AECOPD)患者出现病情恶化,如呼吸困难、痰量增加和痰脓胀等症状,AECOPD患者症状发作频率增加,肺功能加速下降,生活质量严重受损,同时病死率也明显增加[3]。临床上目前尚无治愈COPD的方法,但可通过多种疗法缓解患者症状、减轻并发症发生风险,提高患者生活质量[4]。研究发现,持续性异常炎性反应可促进COPD的疾病进展[5]。微小RNA(miRNA)是非编码内源性小RNA,可通调节靶基因的表达调控生物体中多种基本生命过程。miRNA-124-3p(miR-124-3p)是一种炎症相关miRNA,在多种炎症疾病中发挥重要作用,但其是否参与COPD的炎症过程尚不清楚[6]。Toll样受体4(TLR4)是天然免疫受体,可通过TLR4/核因子活化B细胞κ轻链增强子(NF-κB)信号通路影响多种炎症因子的表达,参与COPD患者的固有免疫反应[7]。本研究观察COPD患者血清miR-124-3p、TLR4水平变化,并分析其与患者肺功能、预后的关系,现报道如下。
1 资料与方法
1.1一般资料 选取本院2018年3月至2019年12月收治的77例COPD患者作为研究对象,纳入标准:(1)均符合《慢性阻塞性肺疾病诊治指南(2013年修订版)》[8];(2)年龄40~75岁;(3)临床资料完整。排除标准:(1)妊娠期、哺乳期女性;(2)合并其他肺部疾病;(3)合并恶性肿瘤;(4)合并免疫系统疾病。根据文献[8]将COPD患者分为稳定期32例(稳定期组)和AECOPD患者45例(AECOPD组)。选取本院收治的单纯呼吸道感染者38例作为感染组。另选取同期在本院体检的健康者42例作为对照组,4组年龄、体重指数及性别比例比较,差异无统计学意义(P>0.05),稳定期组病程与AECOPD组比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究已通过医院伦理委员会批准。
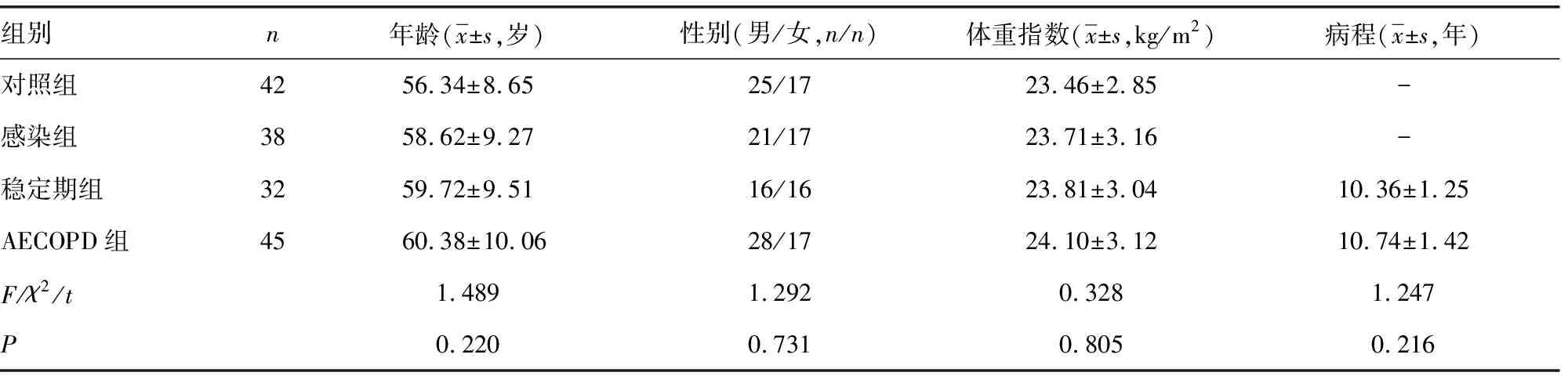
表1 4组一般资料比较
1.2方法
1.2.1样本采集及保存 采集COPD患者入院后第2日清晨空腹肘静脉血5 mL,对照组于体检当天、感染组于就诊当日采集空腹肘静脉血5 mL,3 500 r/min离心10 min,收集上层血清保存于-20 ℃冰箱中待测。
1.2.2qRT-PCR法检测血清miR-124-3p相对表达水平 取出血清样本,采用RNA提取试剂盒[货号:DP419,天根生化科技(北京)有限公司]提取样本中的总RNA,检测其纯度、完整度,将满足要求的RNA逆转录为cDNA,根据逆转录试剂盒(货号:205313,德国QIAGEN公司)说明操作,以所得cDNA为模板进行qRT-PCR法,采用2-ΔΔCt法计算miR-124-3p相对表达水平。miR-124-3p及内参U6的引物序列见表2。

表2 miR-124-3p及内参U6的引物序列
1.2.3血清TLR4水平检测 取出血清样本,采用酶联免疫吸附试验法检测血清TLR4水平,严格按照试剂盒说明书操作。
1.2.4一般指标检测 记录各组受试对象的年龄、性别、体重指数等资料。采用肺功能仪检测用力肺活量(FVC)、第1秒用力呼气容积(FEV1),并计算FEV1/FVC。
1.3随访 AECOPD组患者出院后进行为期1年的随访,统计其预后情况。预后不良:AECOPD组患者病情进展,再入院或死亡;预后良好:AECOPD组患者病情得到有效控制。
2 结 果
2.14组血清miR-124-3p、TLR4水平比较 感染组、稳定期组、AECOPD组血清miR-124-3p相对表达水平低于对照组,差异有统计学意义(P<0.05)。稳定期组、AECOPD组血清miR-124-3p相对表达水平低于感染组,血清TLR4水平高于对照组,差异均有统计学意义(P<0.05);AECOPD组血清miR-124-3p相对表达水平低于稳定期组,AECOPD组血清TLR4水平高于稳定期组及感染组,差异均有统计学意义(P<0.05)。见表3。

表3 4组血清miR-124-3p、TLR4水平比较
2.24组肺功能指标水平比较 感染组FEV1/FVC低于对照组,差异有统计学意义(P<0.05);感染组FEV1、FVC与对照组比较差异无统计学意义(P>0.05);稳定期组、AECOPD组FEV1、FVC及FEV1/FVC均低于对照组、感染组,差异有统计学意义(P<0.05);AECOPD组FEV1、FVC及FEV1/FVC均低于稳定期组,差异有统计学意义(P<0.05)。见表4。

表4 4组肺功能指标水平比较
2.3AECOPD组血清miR-124-3p、TLR4水平与肺功能指标的相关性分析 AECOPD组血清miR-124-3p相对表达水平与FEV1、FVC及FEV1/FVC呈正相关(P<0.05),血清TLR4水平与FEV1、FVC及FEV1/FVC呈负相关(P<0.05),血清miR-124-3p与TLR4呈负相关(P<0.05)。见表5。

表5 AECOPD组血清miR-124-3p、TLR4水平与肺功能指标的相关性分析
2.4AECOPD组不同预后患者血清miR-124-3p、TLR4水平比较 AECOPD组随访1年后,预后不良者共20例,预后良好者25例。预后不良者血清miR-124-3p相对表达水平低于预后良好者,血清TLR4水平高于预后良好者,差异有统计学意义(P<0.05)。见表6。

表6 AECOPD组不同预后患者血清miR-124-3p、TLR4水平比较
2.5血清miR-124-3p、TLR4水平对AECOPD组预后不良的预测价值 血清miR-124-3p、TLR4水平预测AECOPD组预后不良的曲线下面积分别为0.822、0.707,截断值分别为0.55、3.36 ng/mL,灵敏度分别为85.0%、90.0%,特异度分别为80.0%、52.0%;二者联合检测预测AECOPD组预后不良的曲线下面积为0.854,灵敏度为85.0%,特异度为76.0%。见图1。
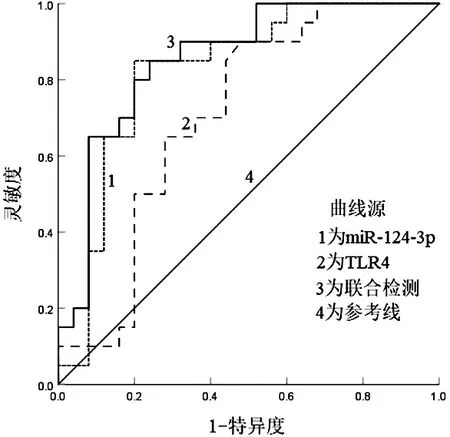
图1 血清miR-124-3p、TLR4水平预测AECOPD组预后不良的ROC曲线
3 讨 论
COPD现已被公认为是一种异质性疾病,这种临床异质性由生物学异质性体现,研究生物标志物可能有助于开发针对COPD的新疗法,并有助于提出更为有效的治疗决策[9]。COPD患者存在持续性的慢性炎症及进行性气流受限,这是造成气道和肺部结构永久改变的原因[10]。其中气道炎性反应是COPD发病过程的关键因素之一,因此本研究通过探讨炎症相关因子miR-124-3p、TLR4在COPD患者血清中的表达及意义,期望寻找到特异性生物标志物,为提高COPD患者临床疗效提供帮助。
越来越多的研究表明,miR-124-3p在多种人类癌症中起抑癌作用,包括乳腺癌、胰腺导管腺癌、肝细胞癌和膀胱癌等,miR-124-3p可抑制癌细胞增殖和转移并促进细胞凋亡[11]。此外,越来越多的证据表明miR-124-3p在炎症中起着重要的调节作用。研究发现,通过脂多糖(LPS)诱导RAW264.7巨噬细胞模拟肝缺血/再灌注损伤的炎症状态,此时上调miR-124-3p相对表达水平可抑制炎性反应,改善肝损伤[12]。另有研究显示,miR-124-3p模拟物能有效抑制LPS诱导的白细胞介素-1β和肿瘤坏死因子分泌及巨噬细胞mRNA表达,miR-124-3p高表达能够减弱严重社区获得性肺炎患者的炎性反应,可能是通过抑制p38丝裂原活化蛋白激酶和NF-κB信号通路而发挥作用[13]。本研究结果显示,血清miR-124-3p相对表达水平由高到低分别为对照组、感染组、稳定期组、AECOPD组,差异有统计学意义(P<0.05),且AECOPD组血清miR-124-3p相对表达水平与肺功能指标呈正相关,提示miR-124-3p可能参与COPD患者的疾病进展。
TLR4是参与脂质识别的膜相关受体,其主要配体是LPS/内毒素,革兰阴性细菌细胞壁的主要成分。TLR4可诱导促炎性细胞因子释放,TLR4信号传导途径涉及多种调节炎性反应的关键转录因子,包括NF-κB,信号转导子和转录激活因子转录因子家族(STAT1)、激活蛋白1(AP1)等[14]。TLR4在COPD炎症过程的免疫调节中起重要作用,参与局部和全身炎症、病情发展及对T辅助免疫反应的调节,TLR4信号通路的过度激活可能促进COPD的进展[15]。赵静等[16]研究发现,COPD患者外周血及肺组织中TLR4呈高表达,且随着病情加重而增加,与肺功能指标呈负相关。本研究中,感染组血清TLR4水平高于对照组,FEV1及FVC低于对照组,但差异均无统计学意义(P>0.05),FEV1/FVC显著低于对照组,感染组肺功能有所下降,TLR4水平无特异性变化;稳定期组、AECOPD组患者血清TLR4水平高于对照组,AECOPD组血清TLR4水平高于稳定期组及感染组,且AECOPD患者血清TLR4水平与FEV1、FVC、FEV1/FVC呈负相关,与文献[16]报道结果一致,提示TLR4在AECOPD患者中特异性表达,其可能通过调节COPD患者的炎症过程参与COPD的疾病进展。
SU等[17]通过双荧光素酶实验发现miR-124-3p对TLR4有靶向调控作用。在病毒性肺炎小鼠中过表达miR-124-3p可降低TLR4及NF κB p65的表达,miR-124-3p可能通过靶向TLR4阻断NF κB通路抑制炎性反应[6]。本研究中,AECOPD患者血清miR-124-3p与TLR4呈负相关,二者共同作用参与COPD的发生发展。本研究还发现,AECOPD组预后不良者血清miR-124-3p水平低于预后良好者,血清TLR4水平高于预后良好者,血清miR-124-3p、TLR4水平预测AECOPD组预后不良的曲线下面积分别为0.822、0.707,二者均对AECOPD患者预后有一定的预测价值,但二者联合检测预测价值更高,提示检测miR-124-3p、TLR4水平可预估患者预后,对于所预测的预后不良患者尽早采取治疗,或可改善患者预后,提高患者生活质量。
综上所述,COPD患者血清miR-124-3p呈低表达,TLR4水平呈高表达,二者水平与COPD患者疾病严重程度及肺功能有关,并可预测AECOPD患者预后情况。但本研究中样本量较少,miR-124-3p、TLR4对AECOPD患者预后的预测能否广泛应用于临床中仍需大样本数据支持。
