非酒精性脂肪性肝病合并高尿酸血症的危险因素分析
2022-07-29牛作虎段绍杰陈佳良彭红叶姚树坤
牛作虎,段绍杰,陈佳良,陈 刚,彭红叶,郑 雯,姚树坤
(1.北京中医药大学 研究生院,北京 100029;2.首都医科大学附属北京地坛医院 中西医结合中心,北京 100015;3.中日友好医院 体检中心,北京 100029;4.中日友好医院 消化内科,北京 100029)
非酒精性脂肪性肝病(nonalcoholic fatty liver diasease,NAFLD)是以肝细胞脂肪变性为主要特征,可进展为脂肪性肝炎、肝纤维化甚至肝硬化的疾病[1]。随着近几十年生活方式的改变,NAFLD已经取代慢性乙型肝炎成为我国最常见的慢性肝病[1],近些年我国大部分地区患病率已超过25%,经济发达地区的患病率更是超过30%[2]。多项研究发现高尿酸血症(hyperuricemia,HUA)可以通过氧化应激等多个途径加重NAFLD 的病情进展[3],而且血尿酸水平与NAFLD 脂肪变性的严重程度呈正相关关系[4]。临床上早期识别NAFLD 患者是否合并HUA 对后续的治疗至关重要,本研究旨在探究NAFLD患者合并HUA的相关危险因素,为早期预防和干预提供依据。
1 资料与方法
1.1 研究对象
连续纳入2018年9月~2019年5月在中日友好医院体检中心确诊NAFLD 的受试者,根据是否合并HUA 将其分为合并HUA 组和单纯组。本研究通过中日友好医院伦理委员会批准(2018-110-K79-1),研究对象均签署知情同意书。
纳入标准:(1)年龄18~65 岁;(2)基线资料、人体测量学指标及实验室、影像学资料完整;(3)本次体检腹部超声确诊NAFLD。排除标准:(1)存在其他肝病史:病毒性肝炎、自身免疫性肝病、原发性胆汁性胆管炎、原发性硬化性胆管炎和药物性肝病等;(2)合并严重的心、脑、肺等系统疾病或恶性肿瘤;(3)近3个月内使用过降尿酸药物。
1.2 研究方法
由经过专业培训的研究人员使用标准化问卷采集受试者的基本信息(性别、年龄、既往病史等)。实测腰围、臀围,腰围为平肚脐水平的周长;臀围为环绕臀部的最大周长。腰臀比=腰围/臀围;腰高比=腰围/身高。通过体检中心电子数据库获取相关体征及实验室检查数据。
参考2018年中华医学会肝病学分会、中国医师协会肝病专家委员会修订的《非酒精性脂肪性肝病防治指南(2018年更新版)》[5],NAFLD 的诊断标准如下:(1)不饮酒或无过量饮酒史;(2)排除其他导致脂肪肝的特定疾病;(3)腹部超声检查符合弥漫性肝细胞脂肪变。参考2019年中华医学会内分泌分会修订的《中国高尿酸血症与痛风诊疗指南(2019)》[6],HUA 的诊断标准如下:空腹血尿酸>420umol/L。肥胖定义为体质指数(BMI)≥28kg/m2,超重为24≤BMI<28kg/m2;低高密度脂蛋白胆固醇(HDL-C)血症的定义为HDL-C≤1.04mmol/L;丙氨酸氨基转移酶(ALT)升高的定义为ALT≥40U/L;腹型肥胖的定义为腰围≥90cm(男性)或≥80cm(女性)。
1.3 统计学方法
应用SPSS20.0 统计学软件进行数据分析。对计量资料进行正态分布性检验,符合正态分布者以均值±标准差表示,组间比较采用独立样本t检验;不符合正态分布者以中位数和四分位数间距表示,组间比较采用秩和检验;计数资料以例数(n)或率(%)表示,组间比较采用卡方检验。采用多因素Logistic 回归分析,OR>1 为危险因素,OR<1为保护因素。
2 结果
2.1 入组患者基线资料分析
本研究共纳入426 例受试者,其中合并HUA组141 例,单纯组285 例。合并HUA 组男性、腰围、腰高比、BMI、TG、LDL-C、ALT、AST 水平均高于单纯组,年龄、HDL-C 水平均低于单纯组,差异均有统计学意义(均P<0.05);其中合并HUA 组肥胖比例高于单纯组,超重及BMI 正常的比例均低于单纯组(均P<0.05)。2 组间吸烟史、饮酒史、腰臀比、收缩压(SBP)、舒张压(DBP)、总胆固醇(TC)、空腹血糖(FBG)水平的差异无统计学意义,见表1。

表1 合并HUA组与单纯组基线资料比较
2.2 NAFLD患者合并HUA的危险因素分析
纳入男性、年龄、腹型肥胖、BMI 分组、TG 升高、LDL-C 升高、低HDL-C 血症、ALT 升高、AST升高构建多因素Logistic 回归分析,结果发现肥胖、低HDL-C 血症及ALT 升高对NAFLD 患者合并HUA 的影响有统计学意义(P<0.05)。相较于BMI<24kg/m2的NAFLD 患者,肥胖的NAFLD 患者合并HUA 的风险增加2.875 倍;同理,低HDLC 血症及ALT 升高的NAFLD 患者合并HUA 的风险分别增加2.148和2.301倍。见表2。
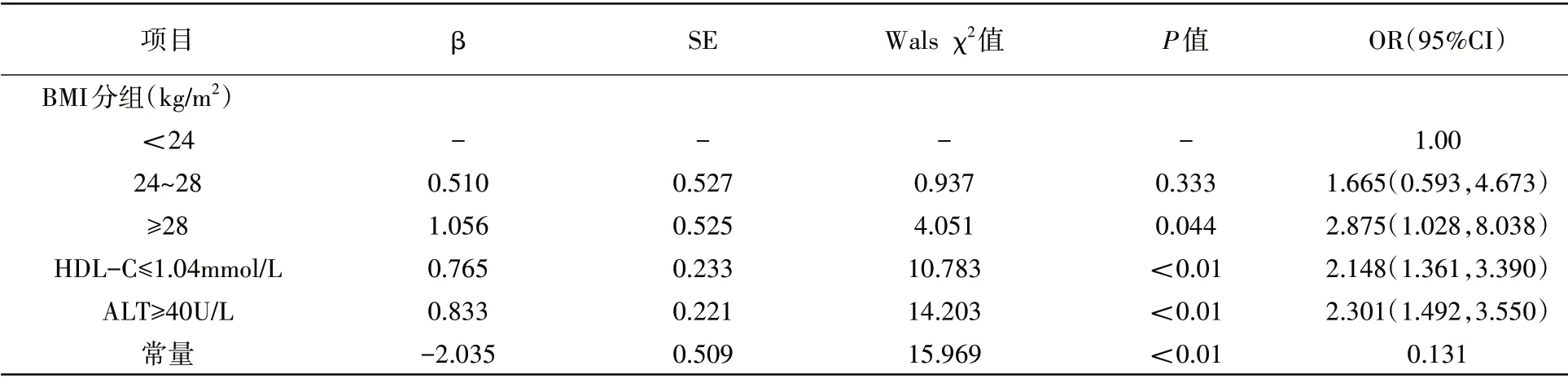
表2 NAFLD患者合并HUA的多因素Logistic回归分析
3 讨论
HUA 是嘌呤代谢紊乱和尿酸排泄障碍所致的慢性代谢性疾病[3],与NAFLD 的发生发展密切相关。本研究发现性别、年龄、腰围、腰高比、BMI、TG、HDL-C、LDL-C、ALT、AST 水平与NAFLD 患者合并HUA 有显著的相关性,在校正后结果显示肥胖、低HDL-C 血症及ALT升高依然是NAFLD合并HUA的独立危险因素。
血脂异常是NAFLD 患者的危险因素,对NAFLD 的发展和消退起着重要作用[7]。脂肪的合成、分解和运输都需要通过肝脏来完成,当血脂代谢出现紊乱,血脂升高时,脂肪就会在肝细胞内淤积,引起肝脏脂质浸润,最终导致NAFLD 的形成[7]。血脂异常同时也可增加HUA 发生的危险性。血脂异常会引起机体产生和利用更多的游离脂肪酸,从而加速ATP 的分解,引起血尿酸生成的增加[8]。本研究多因素Logistic 回归分析结果,低HDL-C 血症与NAFLD 患者合并HUA 依然有很强的相关性。
ALT是一组催化氨基转移反应的细胞内功能酶,是反映肝脏受损最为敏感的指标之一[9]。ALT与NAFLD 的发病与进展密切相关,其水平与肝细胞坏死及膜通透性的增加保持的较高的一致性[9]。亦有研究发现相较于正常人群,HUA 的患者ALT 显著升高,且与血尿酸呈线性正相关关系[10]。ALT 可能是通过诱发炎性因子和脂肪因子的产生从而加重HUA 的病情进展,但具体机制至今尚未研究明确[10]。本研究发现ALT 升高是NALFD 患者合并HUA 的独立风险因素,进一步证实了ALT与HUA的密切相关性。
“二次打击学说”是目前所公认的NAFLD 的发病机制,胰岛素抵抗(IR)是其中的重要环节[11]。有研究认为IR 与NAFLD 患者的肝内脂肪异位堆积密切相关,IR 可引起糖、脂代谢异常,使机体抑制血清游离脂肪酸生成的功能受损,过量的游离脂肪酸流向肝脏导致肝细胞脂肪变性,最终形成脂肪肝[11]。亦有研究发现IR 引起的代偿性高胰岛素会刺激肾小管钠离子和氢离子交换,同时使尿酸阴离子的重吸收增加,竞争性抑制尿酸排泄,继而导致HUA 的形成[12]。IR 的发生与肥胖、血脂代谢紊乱等危险因素密切相关[11,12],说明肥胖和低HDL-C 血症可能是通过IR 导致NAFLD 与HUA的产生,这与本研究结果相一致。
本研究是横断面研究,而且样本量偏少,未来还需要更大规模的前瞻性队列研究进一步证实。
