基于SSR标记的藜麦种质资源遗传多样性分析与指纹图谱构建
2022-07-29陈翠萍
陈翠萍, 刘 洋
[1.青海大学农林科学院,青海西宁 810016; 2.农业农村部植物新品种测试(西宁)分中心,青海西宁 810016]
藜麦(Willd),苋科藜属植物,异源四倍体(2n=4x=36),原产于南美洲安第斯山区,具有耐寒、耐盐、耐干旱的生长特性。因含有丰富而全面的营养价值,被印加人称为“粮食之母”。我国于20世纪90年代从国外引入藜麦并进行适应性栽培,先后在我国西藏、甘肃、青海等地进行引种、新品种选育及适应性评价等工作。对藜麦分子标记和遗传多样性方面已有部分研究。陆敏佳等利用16对SSR标记对41个藜麦种质的多态性及其亲缘关系进行分析,16对引物的平均多态信息含量为0.366。宋娇利用46对简单重复序列(SSR)标记对114份藜麦材料共扩增出165条多态性条带,聚类分析表明不同来源地的种质具有一定的遗传相似性,相同来源地的材料也分到了不同组群。孙梦涵等利用66对SSR标记对163份藜麦种质和3份中国台湾红种质进行种质群体的多态性和亲缘关系分析,结果表明玻利维亚和秘鲁种质与美国和智利种质的遗传信息存在明显区分,青海和云南的藜麦种质在亲缘关系上接近安第斯高原型,河北、山西的藜麦种质更接近智利低海拔型,台湾红藜为台湾本土种质。吴文强等利用18对SSR标记在96份藜麦上共检测出192个等位基因条带,遗传相似系数平均值为0.789 5,可为筛选适合贵州地区有效推广、种植、应用的藜麦材料提供参考。大量研究表明,SSR分子标记对评价藜麦种质资源遗传多样性的可行性具有重要意义,但对所选择的藜麦SSR分子标记的染色体位置是否分布均匀等信息均不明确,不利于所选SSR标记的广泛推广和利用。Jarvis等公布了高质量的藜麦全基因组序列。藜麦全基因组序列的测序完成为分子标记的开发、基因定位和基因功能等提供了极有利的条件。本研究基于前人研究的基础对藜麦SSR的多态性信息及分布位置进行进一步研究。
作物品种鉴定是农业生产环节必不可少的关键步骤,是保证品种优良遗传性状能够充分发挥的重要举措,也是名优品种保护、防止种子混杂退化的有效手段。DNA指纹图谱技术具有丰富的多态性和显著的个体特异性,能够在分子水平上识别品种间的差异,不易受外界环境影响,可快速、准确地完成品种鉴定。随藜麦种植面积的逐年扩大,对品种鉴定的需求也在增加,因此开展藜麦品种的鉴定是必需的。随分子生物学的发展,分子鉴定逐渐用于已知品种库维护和近似品种筛选工作中。SSR标记在单个位点上多态性高,技术成熟且利于推广应用,因此作为构建DNA指纹数据库的首选标记。目前,SSR标记已成功应用在亚麻、棉花、小麦、玉米、水稻、藕莲等作物指纹图谱构建上,但目前在藜麦品种鉴定中尚未见研究。
本研究利用SSR分子标记的方法对48份藜麦种质资源进行遗传多样性分析并构建DNA指纹图谱,确定藜麦种质资源的遗传基础和遗传多样性,为藜麦遗传育种提供参考。
1 材料与方法
1.1 试验材料
本试验收集国内外藜麦种质资源共计48份,其中LM-BZ-47为青海西宁野生种。所有48份藜麦种质资源均由青海省农林科学院作物育种栽培研究所提供,种质资源编号和来源信息见表1。
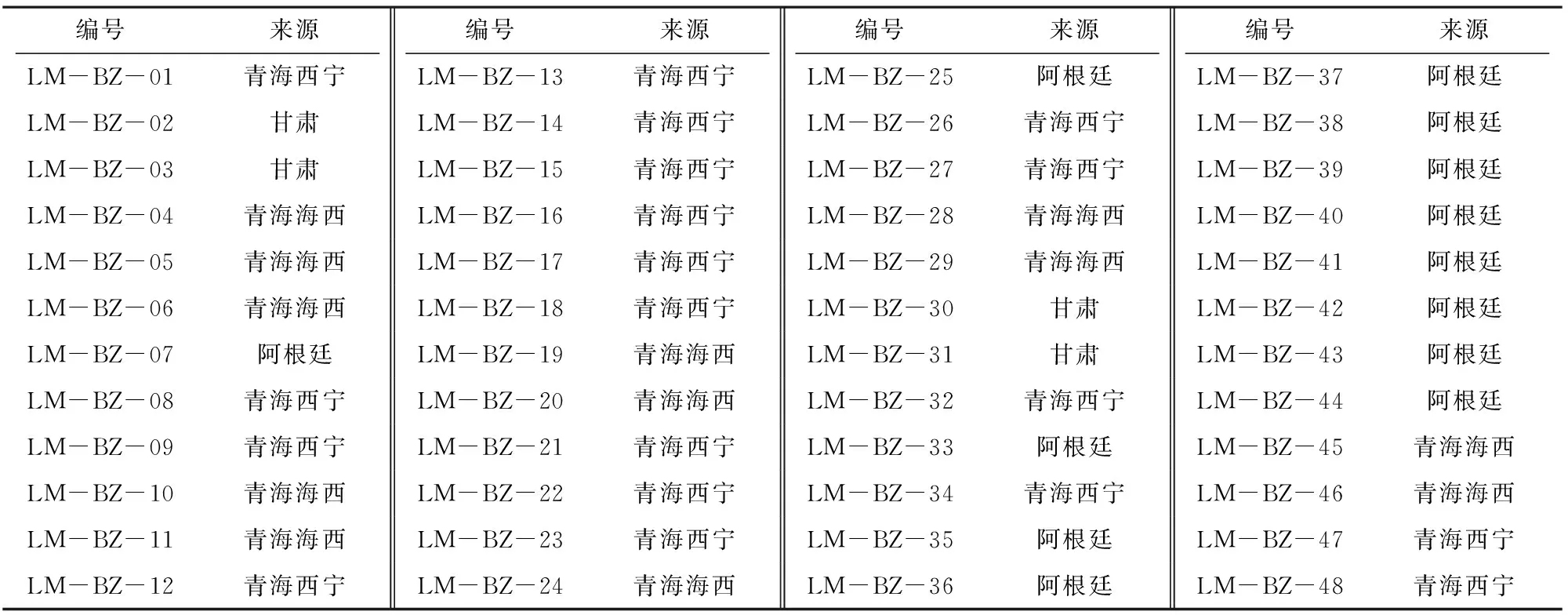
表1 48份藜麦种质资源编号及来源
1.2 DNA提取
藜麦于2020年3月在青海省农林科学院试验基地种植,海拔2 309 m左右,年均气温6 ℃左右,年均降水量约为380 mm。在藜麦苗期,选取5株长相一致的植株,等量混合叶片,利用十六烷基三甲基溴化铵(CTAB)法提取植物总DNA,检测DNA质量及浓度,稀释到50 ng/μL,-20 ℃保存备用。
1.3 引物来源及PCR检测
引物(表2)一部分来源于Jarvis公布的已知引物,一部分根据Jarvis公布的藜麦基因组测序结果开发新的SSR分子标记,用于PCR扩增。引物由上海捷瑞生物工程有限公司合成。PCR扩增体系:DNA 2 μL,10×Buffer 1 μL,2.5 mmol/L each的dNTPs 0.8 μL,5 U/μL的E 0.2 μL,Primer-F 0.5 μL,Primer-R 0.5 μL,ddHO 5 μL,总体积10 μL。反应程序:94 ℃ 2 min;94 ℃ 30 s,60 ℃(每个循环降低0.5 ℃) 45 s,72 ℃ 45 s,10个循环;94 ℃ 30 s,55 ℃ 45 s,72 ℃ 45 s,30个循环;72 ℃ 5 min,10 ℃保存。PCR结束后在扩增产物中加入适量的 Loading Buffer,进行变性聚丙烯酰胺凝胶电泳。电泳结束后将胶块银染显色、拍照并读带。
将特异片段利用San-Prep柱式DNA胶回收试剂盒[购自生工生物工程(上海)股份有限公司]回收,与pMD18-T Vector[购自宝生物工程(大连)有限公司]连接、转入DH5 α大肠杆菌感受态细胞[购自天根生化科技(北京)有限公司]并送往生工生物(上海)股份有限公司进行测序。随后与Jarvis公布的基因组进行比对。
1.4 数据处理
根据PCR扩增结果,对将同一引物扩增出的大小相同的目的条带视为1个等位变异,并进行记录。有条带的记为1,无条带的或无法辨别的带型记为0,构建[0,1]矩阵。利用Popgene 32软件计算Nei’s的基因多样性指数()、Shannon信息指数()、扩增总条带数等遗传参数。使用 PIC_calc 0.6 软件计算各引物位点的多态信息含量(PIC)。利用DPS软件UPGMA方法进行聚类分析。
2 结果与分析
2.1 引物筛选与验证
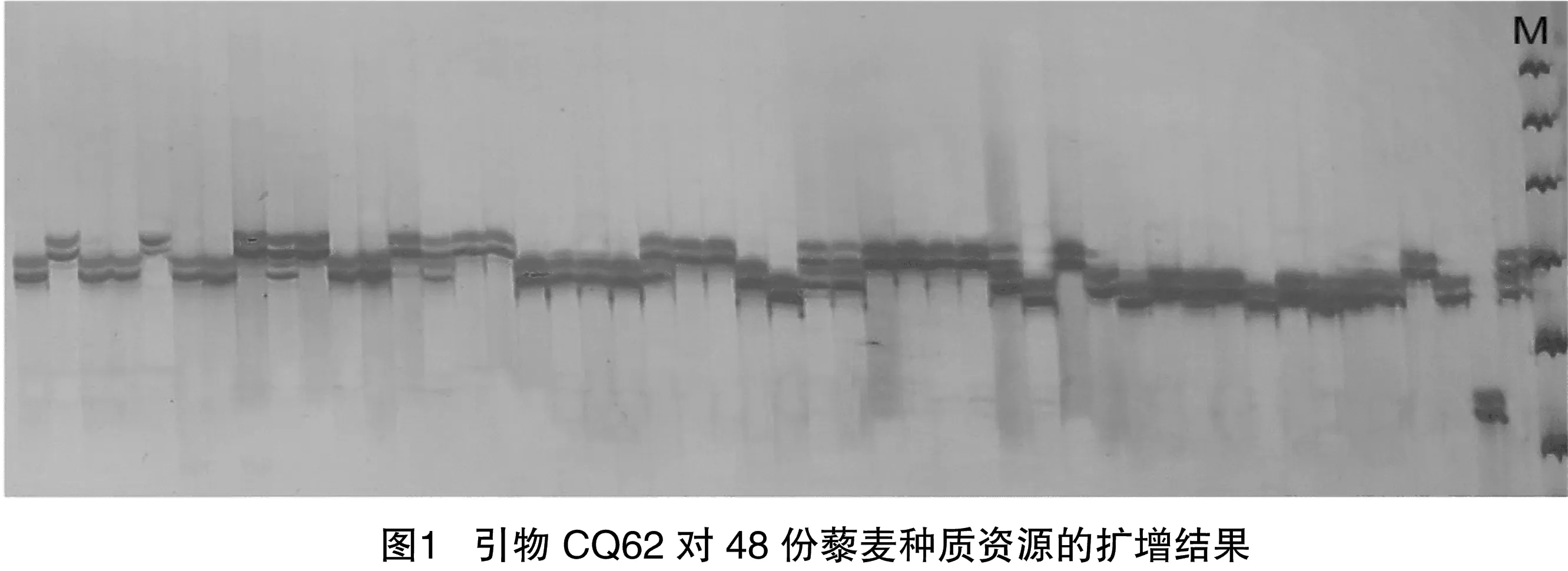
利用地理来源远、形态差异较大的6份藜麦种质资源对收集和开发的SSR引物进行PCR扩增,并对扩增产物进行变性聚丙烯酰胺凝胶电泳检测,淘汰不具多态性或多态性差的引物,最终筛选出25对条带清晰、多态性较高、扩增稳定的SSR引物(表2)。利用这25对SSR引物在48个藜麦种质资源中扩增(图1)。

表2 引物筛选结果

KAAT007(AAT)30AGGTACAGGCGCAAGGATACCGGTAGCATAGCACAGAACGKAAT018(ATT)11GCACCAACCTGAGTCCTAGCCGTGTCGCTGCTCATATTGTKAAT037(TAA)19TCAACCTCCGAATCCTATCAAGGATGCTGATTGGTGGATA-AAKAAT041(ATT)13AG(TAT)4TAG(TAT)5TG(TTA)5TGGGACTTCCATAAGGCAACATATTGCATGTCGAGCACCAKAAT043(AAT)24GGCTCCCACTAATTTCTTGTGTCATGCGGCTTGAGTAGTTTKCAA015(GTT)7TGGTTGGAGGCAAACATACCTGAGGGTGAAGAGGAGGATGKCAA078(CAA)3AAA(CAA)9AGGCGAGGATAACATGATCGAAGAAGCCATACCTCCCTCACKGA010(TC)11TGTTTCCTGCGTCCCTATTCGCTGAAGGTGAAATAGGTG-GAKGA145(AG)12CCAGGGTGAATCAGGGAATACTGGCAGGTGGGTCTTCTATBGA200(GA)20ACCAGCCACTTTGTCATTAGGGCCATGGTTGATGAATGAGA
2.2 遗传多样性分析
对筛选出的具有多态性的引物进行统计,见表3。25对引物共扩增多态性条带134条,其中每对引物等位基因数位于3~13之间,平均值为5;其中KAAT007的等位基因较多,为13个,CQ5、CQ6、CQ15、CQ27、CQ4-10、CQ9-3、CQ11-2、KCAA015和KGA010等位基因最少,仅3个。多态性信息含量()介于0.378 8~0.852 2,均值为0.604 2,仅CQ15、CQ27、CQ9-3、KGA010和BGA200的小于0.5,说明绝大部分引物多态性信息良好。
通过挖胶测序并与藜麦基因组比对后发现,25对引物较为均匀地分布在15条藜麦染色体上(表3),除6号和12号染色体无引物外,其余染色体至少1对引物,这为筛选出的25对分子标记的使用提供了更加完善的信息。遗传多样性分析表明,Nei’s基因多样性指数()为0.107 5~0.368 7,均值为0.242 4。Shannon信息指数() 为0.204 3~0.551 6,均值为0.383 3。表明48份藜麦种质资源遗传多样性丰富。
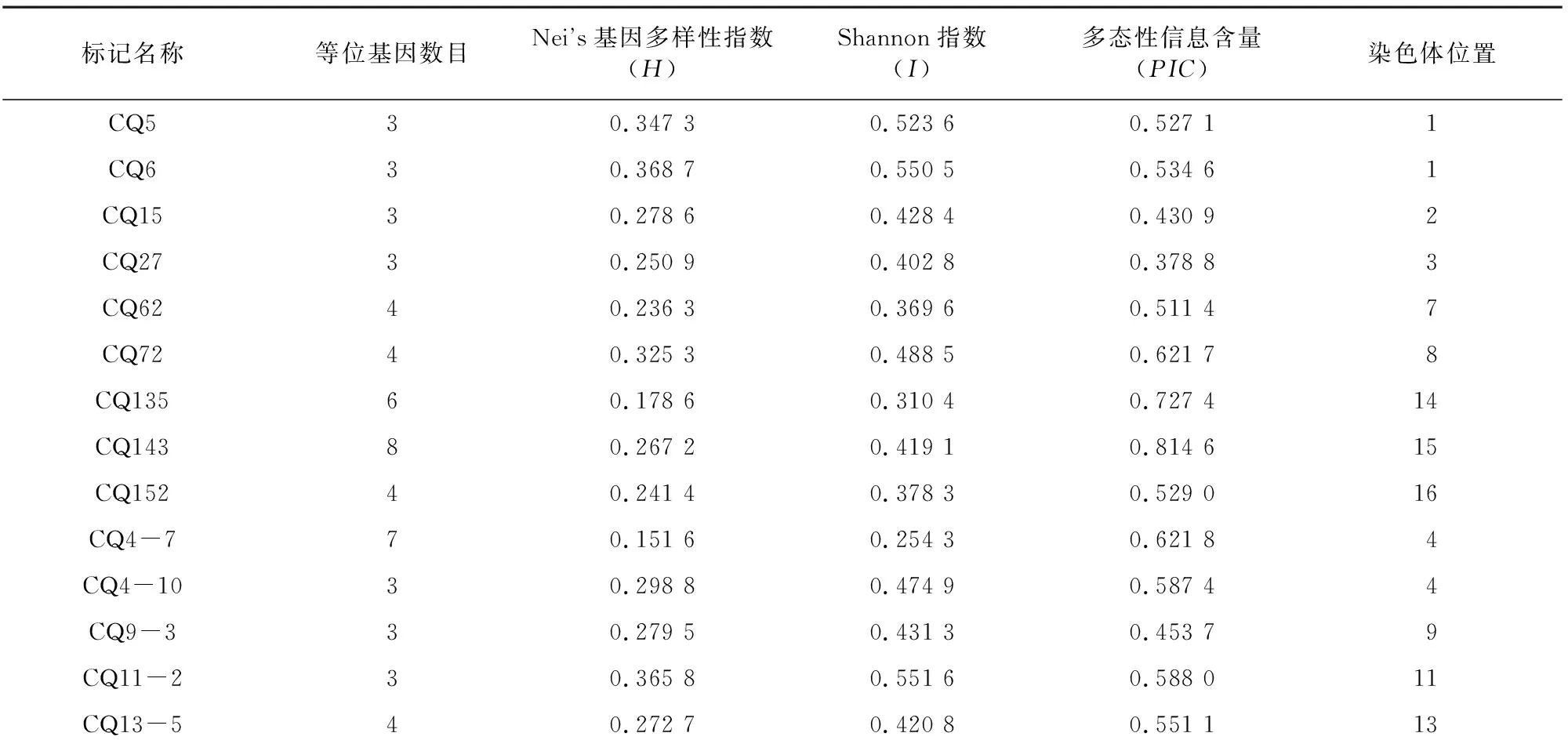
表3 多态性引物信息

KAAT00180.163 40.284 20.779 52KAAT007130.107 50.204 30.852 214KAAT01870.187 30.314 20.716 817KAAT03790.143 00.245 90.721 713KAAT04170.160 30.282 50.762 85KAAT043100.142 00.252 80.812 27KCAA01530.341 20.517 50.519 311KCAA07860.185 80.298 80.543 45KGA01030.296 40.452 70.423 010KGA14550.304 00.464 10.686 710BGA20050.167 00.262 80.410 33均值50.242 40.383 30.604 2最大值130.368 70.551 60.852 2最小值30.107 50.204 30.378 8
2.3 聚类分析
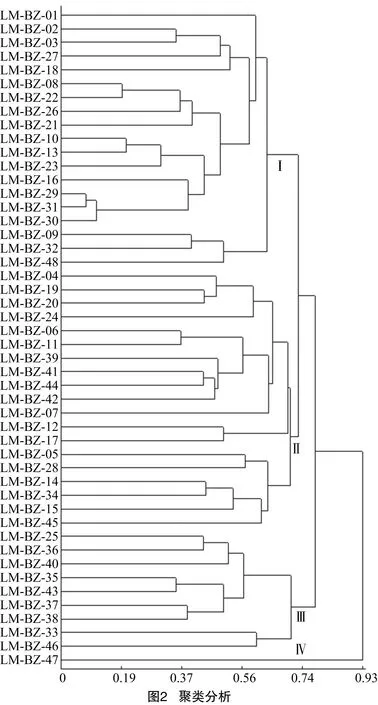
利用25对引物的134条条带对48份藜麦种质资源进行聚类分析,结果见图2。由图2可知,在遗传相似系数0.706处,48份藜麦种质资源可聚为4个组。第Ⅰ组包括19份藜麦种质资源,主要是来自于青海和甘肃的藜麦种质资源,青海与甘肃地理环境相邻,藜麦种质资源的遗传背景也表现得较为相似;第Ⅱ组包括19份种质资源,主要是青海和阿根廷藜麦种质资源,青海与阿根廷藜麦生态条件相近,所种植的藜麦种质资源的遗传背景也较为相似;第Ⅲ组包括9个种质资源,除LM-BZ-46外,其余均为阿根廷藜麦,表现为遗传背景相似;第Ⅳ组包括1个种质资源,LM-BZ-47,为青海野生种质资源,与其他种质资源遗传背景差异较大。
2.4 指纹图谱构建
在25对多态性引物中,CQ135、CQ143、KAAT001、KAAT007、KAAT018、KAAT037、KAAT041、KAAT043的多态性指数较高,且均能鉴定出多个藜麦种质资源,可用来构建藜麦指纹图谱。基于快速、经济的检测要求,对引物进行组合设计。根据利用最少引物鉴定最多品种的指纹图谱构建原则,48份藜麦种质资源通过3对SSR引物组合即可完全被区分开,即KAAT001、KAAT007、KAAT043引物组合。对每对引物所扩增的条带进行统计,得到每个品种的DNA指纹图谱数据库(表4)。
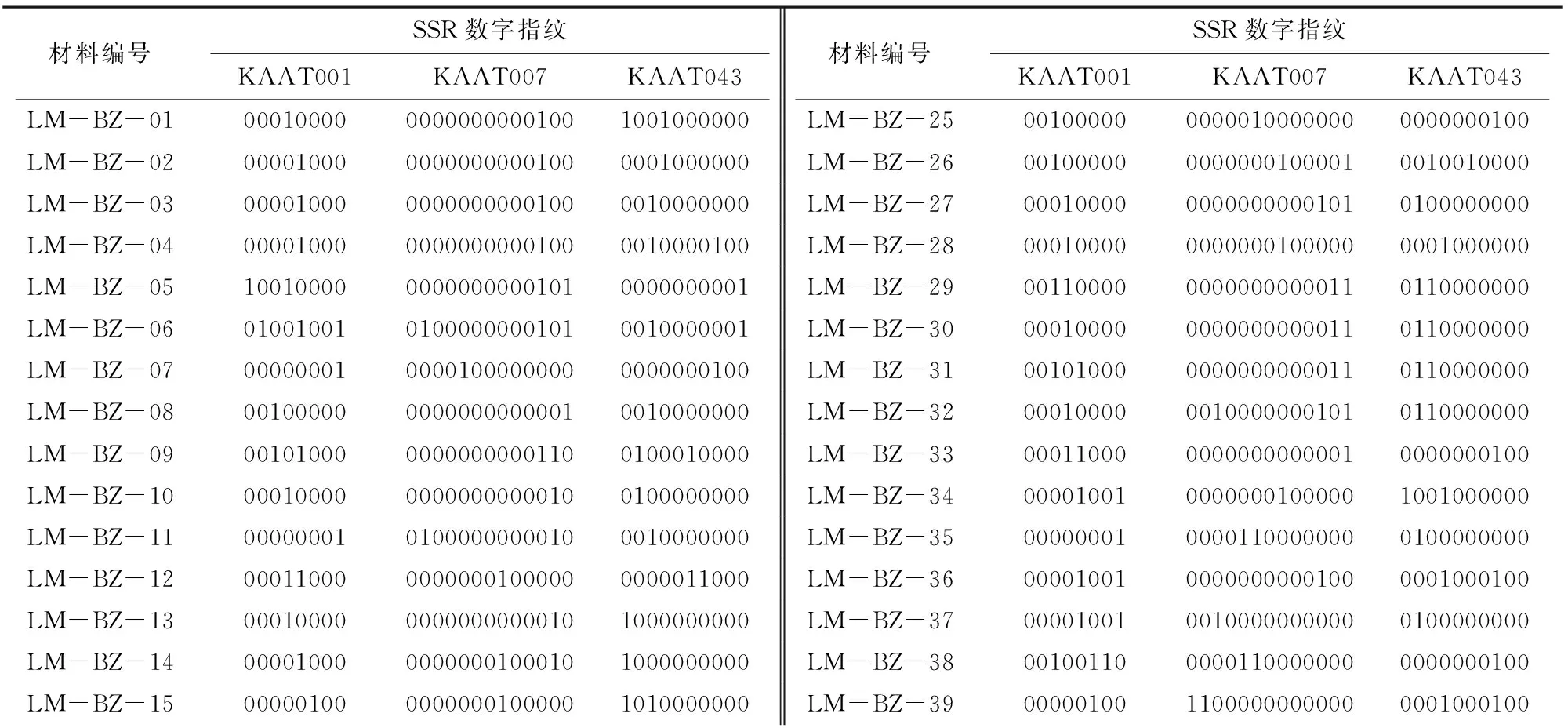
表4 48份藜麦种质资源SSR数字指纹图谱构建
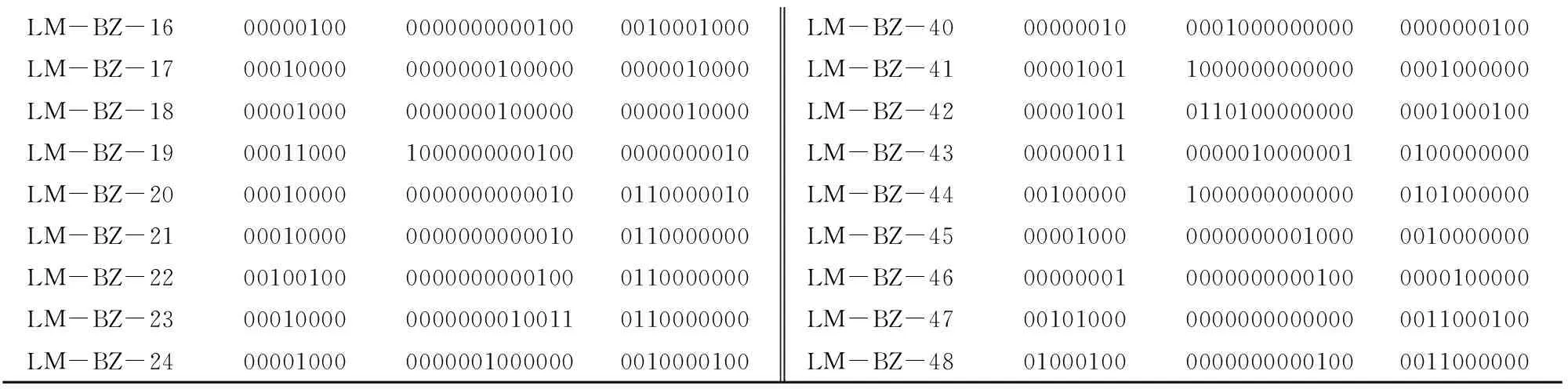
LM-BZ-160000010000000000001000010001000LM-BZ-400000001000010000000000000000100LM-BZ-170001000000000001000000000010000LM-BZ-410000100110000000000000001000000LM-BZ-180000100000000001000000000010000LM-BZ-420000100101101000000000001000100LM-BZ-190001100010000000001000000000010LM-BZ-430000001100000100000010100000000LM-BZ-200001000000000000000100110000010LM-BZ-440010000010000000000000101000000LM-BZ-210001000000000000000100110000000LM-BZ-450000100000000000010000010000000LM-BZ-220010010000000000001000110000000LM-BZ-460000000100000000001000000100000LM-BZ-230001000000000000100110110000000LM-BZ-470010100000000000000000011000100LM-BZ-240000100000000010000000010000100LM-BZ-480100010000000000001000011000000
3 讨论与结论
藜麦引入国内时间较短,研究基础薄弱、品种来源与遗传背景不明,不利于藜麦新品种选育与开发。藜麦品种间遗传差异的研究对于藜麦遗传改良具有重要意义。SSR分子标记被广泛地用于作物遗传多样性研究。一般认为,当<0.25 时,引物的多态性信息较低;当>0.50 时,引物的多态性信息较高。陆敏佳等从54对SSR引物中筛选出16对能明显扩增出稳定的多态性条带的引物,变幅为0.208~0.432,平均为0.366。孙梦涵等利用66对SSR标记在166份种质材料中检测到327个等位位点,平均多态性信息含量为0.524,但是多态性信息含量均较少。本研究利用25对SSR引物对48份藜麦种质资源进行遗传多样性分析,介于0.378 8~0.852 2,均值为0.604 2,说明绝大部分引物多态性信息良好,且本研究通过测序明确每对引物在藜麦染色体上的位置,为藜麦种质资源的鉴定和研究提供更加完善的信息。聚类分析将48份藜麦种质资源聚为4个组。第Ⅰ组19份种质资源,第Ⅱ组19份种质资源,第Ⅲ组9份种质资源,第Ⅳ组1份青海野生藜麦种质资源。聚类分析结果与藜麦种质资源的来源、地理分布等信息大体相似,少部分聚类结果与农艺性状表现有差异,这可能与所选分子标记的数量较少等原因有关,后续还需增加分子标记的数目。同时,聚类分析结果对于藜麦育种中材料的选择有一定的指导和借鉴作用。
SSR标记已经成功应用于多个作物的指纹图谱构建。潘根等利用SSR引物对24份来源于中国的亚麻品种进行DNA指纹数据库构建;胡文斌等利用引物-带型组合法,选取9对SSR引物构建了58个火龙果品种的指纹图谱,为品种鉴定提供依据。在藜麦研究方面,SSR技术多用于遗传多样性分析,而用于藜麦指纹图谱构建的则鲜有研究。本研究利用聚丙烯酰胺凝胶电泳首先筛选SSR引物,然后再进行重复性和稳定性检测,具有易操作、成本低的特点,为藜麦种质分类、品种鉴定和品种权保护提供重要的理论依据与技术支撑。
