冰胶聚合物的制备及其对Ag+、Pb2+、Zn2+和Cr3+的吸附性能
2022-07-28孙乾
孙 乾
(江苏大学化学化工学院,江苏 镇江 212003)
近年来,冰胶聚合物在重金属离子吸附领域显示出优异的性能。与其他吸附剂不同,由于其内部大孔隙的互联结构使背压相对较低,低温凝胶在吸附分离过程中得到了广泛的应用[1-3]。低温凝胶是由聚合物前体或单体的冷冻溶液聚合而成的凝胶基质[4-5],具有高的机械和化学抗性,作为吸附分离过程的材料引起人们的关注[6]。最近,蔺等[7]制备氧化石墨烯复合凝胶用于铜离子的吸附,证明了凝胶材料用于重金属离子吸附的可行性。同时,低温凝胶也已经用于选择性吸附生物重要分子、药物递送、预浓缩和从不同试样中去除有害重金属离子[8-10]。由于低温凝胶表面积小而导致的低吸附能力,使得其在应用上具有一定的不足[11]。传统的方法主要通过微珠等聚合物颗粒制备分离材料,或者嵌入聚合物微粒、SiO2和改性金纳米微粒到聚合物网络中来改善低温凝胶的吸附性能[12-16]。为了制备具有较好的生物相容性、无毒性和超大孔互联孔结构的冰胶聚合物[17-19],笔者拟将高吸附性能和低温凝胶背压较低的优点相结合,嵌入聚合物颗粒poly(HEMA-MAGA)到冰胶中,可以实现环境中多种重金属离子的选择性吸附。
本工作通过乳液共混法、自由基引发聚合与低温乳胶共聚成功构建了poly(HEMA-MAGA)/PHEMA冰胶聚合物,考察了不同冰胶材料对Ag+、Pb2+、Zn2+、Cr3+的吸附性能。
1 实 验
1.1 主要试剂与仪器
L-谷氨酸(w=99%)、甲基丙烯酸羟乙酯(w=96%)、三乙胺(w=≥99.5%)、N,N′-亚甲基双丙烯酰胺(MBAAm,w=99%)、四甲基乙二胺(TEMED,w≥99.5%)、硫酸铵(APS,w≥98%)、过氧化苯甲酰(w=98%),阿拉丁试剂有限公司。
iS50傅里叶变换红外光谱仪(FT-IR),美国Nicolet公司;Cary 8454紫外-可见光谱仪(UV-vis),美国Agilent公司;S-4800 Ⅱ扫描电子显微镜(SEM),日本 Hitachi 公司;VISTA-MPX电感耦合等离子体原子发射光谱(ICP-AES),澳大利亚Varian公司。
1.2 实验方法
1.2.1 2-甲基丙烯酰胺谷氨酸(MAGA)的合成
在100 mL二氯甲烷中加入5.0 g谷氨酸和0.2 g对苯二酚,0 ℃保存。然后充入氮气,并加入13.0 g三乙胺和4.0 mL甲基丙烯酰氯,室温磁力搅拌2 h。反应12 h后,加入10%NaOH,通过旋转蒸发器蒸发溶液中的水相,温度为78 ℃。将残渣放入60 ℃的真空干燥箱中至少24 h。干燥后的产品即是蓬松的MAGA及少量杂质,将MAGA残渣用乙醇洗涤一至两遍,去除MAGA表面所携带的杂质,然后浸泡保存。
1.2.2 自由基聚合制备PHEMA冰胶聚合物
加入2.6 mL HEMA作为冰胶聚合物PHEMA的结构单体,加入0.6 g MBAAm和10 mL去离子水,真空除去溶液中可溶性氧,单体总质量分数为12%。然后,添加20 mg APS,溶液在冰浴中冷却2~3 min,加入TEMED(25 μg,1%的总单体),磁力搅拌1 min后倒入25 mL烧杯中,在-12 ℃冷冻放置24 h。在室温下进行解冻处理,并用200 mL去离子水清洗,在0.02%NaN3中储存,实际使用时需在4 ℃进行操作。
1.2.3 利用乳液聚合技术制备poly(HEMA-MAGA)颗粒
分别将0.5 g过氧化苯甲酰和0.5 g聚丙烯醇加入50 mL圆底烧瓶中,然后加入0.5 g MAGA与10 mL HEMA,在60 ℃下密封反应12 h,待反应结束后,过滤洗涤,在真空烘箱中60 ℃干燥至少24 h。磨碎,备用。合成机理如图1。

图1 Poly(HEMA-MAGA)合成机理过程示意
1.2.4 PHEMA与poly(HEMA-MAGA)颗粒共混的冰胶聚合物的制备
先采用HEMA和含poly(HEMA-MAGA)颗粒的水溶液混合的方法制备poly(HEMA-MAGA)/PHEMA复合低温凝胶,然后将0.4 gN,N′-亚甲基双丙烯酰胺(MBAAm)加入20 mL去离子水中。将上述两种溶液混合在一起之后,在冰浴中加入20 mg的APS并将TEMED添加到溶液中,将聚合混合物放入20 mL烧杯中,在-18 ℃下聚合24 h,利用自由基聚合制备复合低温胶。在聚合结束时,得到了复合低温凝胶。反应结束后,复合低温凝胶在室温下解冻,然后用去离子水清洗,去除未反应的单体。清洗结束后在0.02% NaN3中储存,实际使用时需在4 ℃进行操作。
1.2.5 材料的表征方法
通过傅里叶变换红外光谱仪获取试样的表面官能团;利用扫描电子显微镜观察冰胶材料在共聚后微观表面结构变化。
1.3 吸附性能实验
1.3.1 动态吸附过程
采用拟一阶动力学模型,拟二阶动力学模型和内扩散模型来解释吸附机理随时间变化的关系[20-23]。
拟一阶动力学模型,拟二阶动力学模型非线性表达式见式(1)、式(2):
qt=qe[1-exp(-k1t)]
(1)
(2)
式中:qt、qe分别为时间t和吸附平衡时吸附材料对目标的吸附容量,mg/g;k1,k2分别为拟一阶、拟二阶动力学吸附速率常数。
Weber-Morris粒子内扩散动力学模型非线性表达式如下:
qt=kintt0.5+C
(3)
式中:t0.5为半衰期;kint为分子内扩散动力学吸附速率常数;C为自然常数。
1.3.2 静态吸附过程
在最佳吸附条件(pH=6.0,T=318 K)下,将25 mg吸附剂加入到不同初始质量浓度的铅离子溶液中,吸附360 min。在不同的吸附时间下进行动力学研究。根据不同温度下的平衡数据计算热力学参数,吸附-脱附实验重复7次。通过考察功能吸附材料的吸附量与平衡浓度的函数关系并用Langmuir和Freundlich等温吸附模型来拟合,来推测吸附剂的性质和对Pb2+的最大吸附容量。
Langmuir和Freundlich等温吸附模型非线性方程表达式见式(4)和式(5):
(4)
(5)
式中:qm为材料最大吸附量,mg/g;Ce为溶液中吸附平衡浓度,mg/L;KL、KF为吸附效率经验常数,L/mol;n>1表示此过程有利于吸附。
ΔG、ΔH和ΔS可以根据吉布斯方程和范托夫方程计算:
ΔG=-RTlnK
(6)
lnK=ΔS/R-ΔH/RT
(7)
式中:K为平衡态时的平衡分布系数,R为理想气体常数,T为热力学温度。
2 结果与讨论
2.1 基于FT-IR分析冰胶材料的化学组成
图2为MAGA、poly(HEMA-MAGA)、PHEMA及poly(HEMA-MAGA)/PHEMA的红外光谱。作为金属络合配体,新合成的poly(HEMA-MAGA)小珠的分子式如图1所示。如图2所示,MAGA的FT-IR光谱在1 645 cm-1和1 539 cm-1处具有拉伸振动带amide Ⅰ和amide Ⅱ的特征,在1 740 cm-1处具有羰基的拉伸振动带amide Ⅰ和amide Ⅱ的特征;在3 200~3 500 cm-1范围内的宽吸收峰主要是由于HEMA的—OH基团的伸缩振动产生。
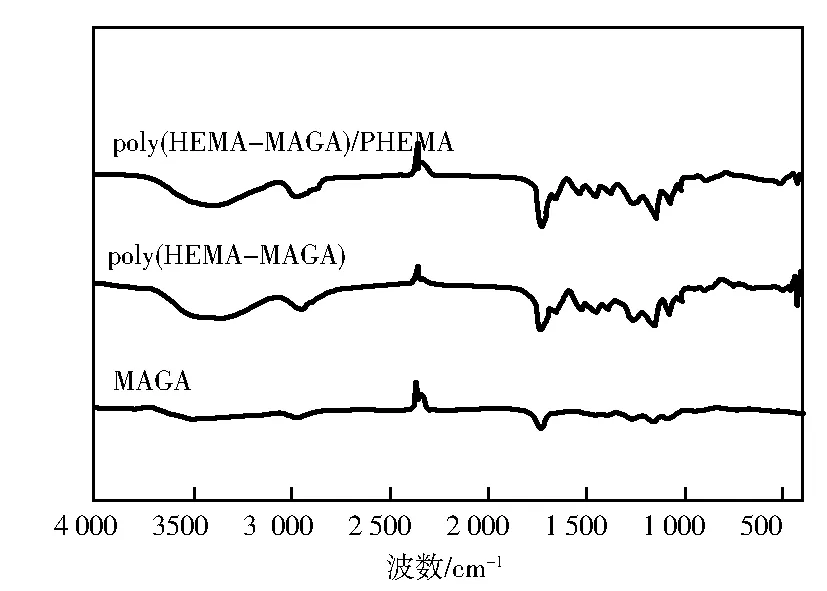
图2 MAGA、poly(HEMA-MAGA)及poly(HEMA-MAGA)/PHEMA红外光谱
2.2 基于SEM分析冰胶材料的表面形貌
图3为膜材料表面微观形貌。由图3可见,PHEMA冰胶孔隙是开放的、相互连通的,具有大型连续连通孔隙直径(5~10 μm)提供渠道流动相流经。随着poly(HEMA-MAGA)的含量增多,冰胶材料的孔道逐渐交联并最终形成了无明显孔道的冰胶聚合且表面聚合层厚实,冰胶聚合物表面粗糙。这也表明冰胶颗粒成功镶嵌在PHEMA冰胶内部,结合红外分析可知,堆砌的poly(HEMA-MAGA)颗粒小球与HEMA单体共聚,在吸附过程中相对稳定。

图3 PHEMA冰胶(a, b)与不同poly(HEMA-MAGA)颗粒添加量的poly(HEMA-MAGA)/PHEMA冰胶聚合物(c—0.5 g; d—0.1 g;e—0.2 g)SEM照片
2.3 poly(HEMA-MAGA)/PHEMA对于Ag+、Pb2+、Zn2+、Cr3+的最优吸附条件
2.3.1 pH值的优化
利用0.1 mol/L NaOH和0.1 mol/L HNO3控制pH值进行吸附实验,结果见图4。由图4可见,随着pH值的增加,对4种重金属离子吸附量有增加的趋势,羧酸基团与金属离子之间的相互作用增强。pH值到达6时,各离子吸附量达到最大值且Pb2+吸附量最大(119.83 mg/g)。这是由于冰胶聚合物材料表面大量游离氢氧根离子和poly(HEMA-MAGA)颗粒携带的羧基基团形成了对Pb2+产生配位作用的空腔。当pH值大于6时,各离子与氢氧根离子反应形成沉淀,难以准确测量吸附量。在pH值较低的情况下,由于各离子和H+之间存在竞争吸附,因此认为吸附量(56.54 mg/g)较低。

图4 pH值对重金属离子吸附能力的影响
2.3.2 吸附温度的优化
由图5可知,随着温度的升高,poly(HEMA-MAGA)/PHEMA冰胶聚合物对4种离子的吸附量呈上升趋势,在45 ℃时几乎达到饱和。在相同的温度条件下,4种重金属离子的吸附强度为Pb2+> Ag+>Zn2+>Cr3+。随着温度的增加,溶液的黏度降低,加快了各离子在材料边界层的扩散速度。温度由15 ℃提高到55 ℃,冰胶聚合物材料对Pb2+的吸附能力由59.8 mg/g提高到119.4 mg/g,吸附率由29.9%提高到59.7%。在室温条件下,该吸附剂材料对铅离子的吸附效果良好,具有良好的应用前景。
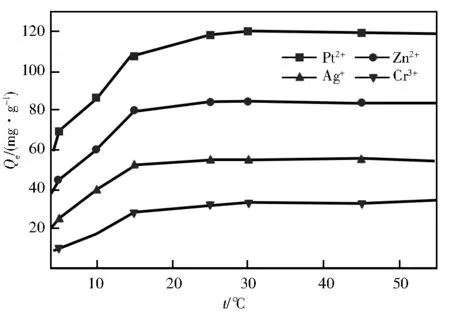
图5 温度对重金属离子吸附能力的影响
2.3.3 共混颗粒添加量的优化
由图6可见,随着poly(HEMA-MAGA)添加量增加,poly(HEMA-MAGA) /PHEMA冰胶聚合物对4种重金属离子的吸附量明显提升,其原因为乳胶共聚过程中更多的poly(HEMA-MAGA)参与反应,在冰胶聚合物上留下吸附活性位点增加,从而提升了其吸附量;当添加量达到0.1 g时,吸附量达到最高值,随后吸附量出现微弱的下滑,这是由于过高含量的poly(HEMA-MAGA)与单体比例失调,导致冰胶聚合物材料结构发生明显的变化(图3)并且无法与离子有效配位,从而使其无法形成有效的吸附活性位点。

图6 poly(HEMA-MAGA)添加量对重金属离子吸附能力的影响
2.3.4 不同初始浓度的优化
图7是不同初始浓度的离子对材料的去除率的影响。由图7可见,增加初始浓度将不可避免地增加在水中的离子吸附性能并且最终达到一个平衡值。在高剂量的吸附材料下,过量的吸附位点没有得到充分利用。因此,较理想的初始浓度为200 mg/L。然而,溶液的初始浓度越高,吸附容量越低。因为冰胶材料表面的单位吸附活性区域的数量是有限的,并有足够的吸附位点吸附浓度较低的目标离子。随着目标离子的浓度增加,冰胶材料表面活性区域不断减少,多余的离子只能分布在吸附剂材料的附近,导致吸附效率降低。

图7 离子初始浓度对重金属离子吸附能力的影响
2.4 PHEMA及poly(HEMA-MAGA)/PHEMA对Pb2+的吸附性能
2.4.1 动态吸附
PHEMA及poly(HEMA-MAGA)/PHEMA冰胶聚合物对于吸附Pb2+的动力学数据见表1和图8。通过比较不同模型的系数(R2)确定回归方程的拟合程度判断,认为二阶模型更适合。由拟二阶方程(表1)计算出的122.48 mg/g的平衡吸附量也接近于实际实验结果117.76 mg/g。这表明冰胶的吸附作用是化学吸附,形成的过程是氢氧根离子和Pb2+之间的配位作用。

表1 PHEMA和poly(HEMA-MAGA)/PHEMA的拟一阶和拟二阶吸附动力学常数
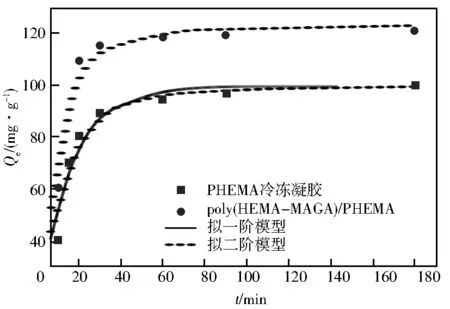
图8 PHEMA和poly(HEMA-MAGA)/PHEMA的动态拟合曲线
常采用韦伯-莫里斯颗粒内扩散模型分析动力学[23]。由图9可知,吸附数据拟合成3段直线并将吸附过程分为3个阶段。在第一阶段,由于溶液的浓度差导致大量的Pb2+迅速从水中迁移到新鲜吸附剂的外表面。这一过程主要是液体膜扩散,是化学吸附之外的过程。直线斜率更大。第二阶段为30~60 min,此时拟合直线平缓,由液膜扩散和膜内扩散控制。此后进入第三阶段,低浓度的Pb2+无对传质推动力,且平衡吸附量仍在增长,因为材料的表面羟基与Pb2+可以形成配位。此外,poly(HEMA-MAGA) /PHEMA不仅具有更丰富的外端羟基,由于交叉共聚的影响PHEMA内部还组成一个带有大量羧基离子空腔用来结合金属离子,所以poly(HEMA-MAGA)/PHEMA(122.48 mg/g)比PHEMA(99.52 mg/g)对Pb2+拥有更大的吸附容量。

图9 t1/2与PHEMA和poly(HEMA-MAGA)/PHEMA的动态吸附量拟合曲线
2.4.2 静态吸附
PHEMA与poly(HEMA-MAGA)/PHEMA冰胶聚合物对于吸附Pb2+的热力学数据见表2和图10。比较两个模型的相关系数R2,Langmuir模型比Freundlich模型更适合,表明吸附剂的吸附点均匀分布在材料的表面且材料对于Pb2+的吸附是单分子层吸附。PHEMA对应的Langmuir等温线模型的R2(0.941)略小于poly(HEMA-MAGA)/PHEMA冰胶聚合物(0.934<0.941),可能是材料内部有较多的吸附腔。此外,PHEMA的KL值最低,但其吸附量较大。这可能是因为Langmuir(单层吸附)不能完全描述PHEMA,忽略了PHEMA冰胶聚合物内部的吸附量,导致KL小于理论值。

表2 初始Pb2+的浓度的Langmuir和Freundlich参数
lnK对1/T的线性函数是基于在不同的温度下的平衡数据和ΔH与ΔS得到线性函数的斜率和截距的线性拟合(图11)。ΔG, ΔH和ΔS是吸附剂在不同的温度下的数据,表3中所示ΔG为负,表明由PHEMA及poly(HEMA-MAGA)/PHEMA冰胶聚合物对Pb2+的化学吸附可以自发地发生,且poly(HEMA-MAGA)/PHEMA自发吸附能力更强,这是归因于高密度的羟基基团。ΔH为正,表明吸附是一个吸热反应,温度升高有利于增加对目标离子的吸附材料。ΔS的数据表明,Pb(Ⅱ)的吸附熵增加过程和固液界面自由度的增加,表明水分子的运动和重金属离子在固液表面更加无序。

表3 PHEMA和poly(HEMA-MAGA)/PHEMA对于Pb2+吸附的热力学参数

图10 PHEMA和poly(HEMA-MAGA)/PHEMA吸附Pb2+的吸附平衡数据

图11 PHEMA和poly(HEMA-MAGA)/PHEMA的1/T与lnk的关系
2.5 poly(HEMA-MAGA)/PHEMA再生吸附性能
冰胶聚合物可以通过洗脱的方式循环再生[24]。实验中,利用洗脱液(1 mol/L HAc溶液)对吸附后的poly(HEMA-MAGA) /PHEMA进行洗脱处理以重新获得有效活性位点。经过7次吸附/脱附循环再生实验后,poly(HEMA-MAGA) /PHEMA 对4种重金属离子的吸附量保持在最初吸附量的 92%以上(图12)。
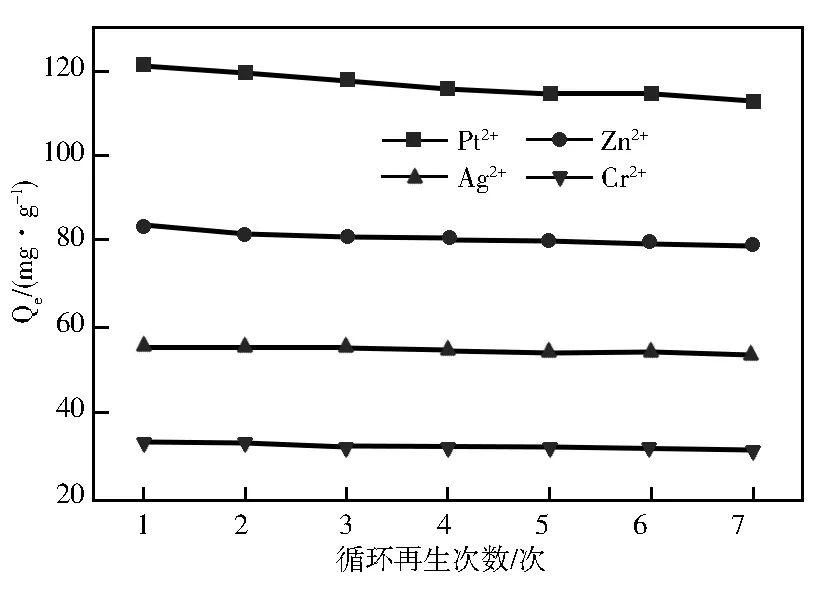
图12 poly(HEMA-MAGA)/PHEMA对重金属离子吸附能力的再生性能
再生率的略微下降归因于吸附/脱附循环过程中识别位点的不可逆破坏或表面经反复酸洗后在酸性条件下发生部分水解,表明poly(HEMA-MAGA) /PHEMA冰胶材料具有优异的再生性能和稳定性。
3 结 论
a.利用自由基引发聚合与低温乳胶共聚制备了poly(HEMA-MAGA)/PHEMA冰胶聚合物。poly(HEMA-MAGA)/PHEMA(122.48 mg/g)比PHEMA(99.52 mg/g)对Pb2+拥有更大的吸附容量能力。冰胶聚合物颗粒的嵌入改善了原材料的吸附性能,增加温度使系统的熵增加有利于提高吸附容量。在最佳吸附条件下,吸附量的差异体现了poly(HEMA-MAGA) /PHEMA冰胶表面有大量的羧基和游离氢氧根离子对二价重金属离子差生了一定的配位吸附。7次再生循环后poly(HEMA-MAGA)/PHEMA冰胶聚合物吸附量仍高于原始吸附量的92.8%,表明所制得的poly(HEMA-MAGA)/PHEMA冰胶聚合物具有良好的再生稳定性。
b.poly(HEMA-MAGA)/PHEMA冰胶聚合物及其制备方法能够为多种分离物料体系中选择性分离单一物料提供了方向,给在未来用于实际废水中不同价态的重金属离子的选择性吸附分离过程提供了实验基础。
