程序性死亡受体-配体1、E-钙黏蛋白、N-钙黏蛋白、信号转导及转录激活因子3表达与胸腺癌预后的关系研究
2022-07-28张馨文
张馨文,王 波,许 果
(四川绵阳四〇四医院,四川 绵阳 621000)
胸腺癌起源于胸腺上皮细胞恶变,该疾病侵袭性强、进展迅速、易复发转移[1]。既往研究表明接受根治性手术治疗联合术后辅助化疗可使胸腺癌患者显著获益,这也是目前胸腺癌患者较为理想的综合治疗方案[2]。近年来,部分细胞因子及酶蛋白的表达在肿瘤生长增殖及侵袭转移过程中的调控作用逐渐成为临床医学研究热点内容,程序性死亡受体-配体1(programmed cell death-ligand 1,PD-L1)调控肿瘤细胞免疫逃逸行为,在肿瘤免疫治疗领域发挥关键性作用[3];上皮-间质转化(epithelial-mesenchymal transition,EMT)期间肿瘤细胞上皮标记蛋白表达下调、间质标记蛋白表达上调,其信号传导机制较为复杂,对细胞浸润、迁移特性均起到一定的激活作用,通过测定相关标志物蛋白,如E-钙黏蛋白(E-cadherin,E-cad)、N-钙黏蛋白(N-cadherin,N-cad)将有助于临床了解肿瘤EMT转化进程[4];信号转导及转录激活子3(signal transducer and activator of transcription 3,STAT3)经多项研究证实参与介导恶性肿瘤的增殖和凋亡[5]。本研究围绕PD-L1、EMT相关蛋白、STAT3在胸腺癌病灶中的表达及其临床意义进行分析,现报道如下。
1 资料与方法
1.1 一般资料2016年5月至2018年3月于我院就诊的69例胸腺癌患者,纳入标准:①符合世界卫生组织2015年发布的胸腺癌分型诊断标准[6],经胸部CT扫描结合病理检测确诊病情,均为胸腺原发癌;②均为首次接受胸腺癌手术治疗,符合手术适应症条件;③均于术后接受以铂类药物为基础的全身性化疗治疗;④精神及认知正常;⑤患者临床信息完整。排除标准:①治疗药物过敏;②术前接受放化疗治疗的患者;③合并基础代谢疾病及内分泌异常疾病;④合并其它类型恶性肿瘤;⑤凝血功能障碍或先天功能不足者;⑥心、肺、肾、肝严重损伤。男45例,女24例;年龄29~56岁,年龄(43.22±5.48)岁;病程2~8月[(4.93±1.17)月];TNM病理分期[7]:Ⅰ期31例,Ⅱ期19例,Ⅲ期14例,Ⅳ期5例;Masaoka-Koga分期[8]:Ⅰ~Ⅱ期39例,Ⅲ~Ⅳ期30例;肿瘤最大直径1.9~12.7 cm[(7.2±1.5)cm]。本研究取得患者知情同意,且获得医院伦理委员会审批。
1.2 方法术中所取肿瘤组织及正常胸腺组织(癌组织旁的正常胸腺组织,距离癌组织>5 cm)制作病理标本,使用4%甲醛对标本进行固定,经石蜡包埋、切片后制得厚度为3~4 μm的胸腺癌切片样本,以上样本均于70 ℃条件下烘烤脱蜡,应用免疫组化EnVision二步法对切片进行染色,相关抗体试剂统一购自美国Santa Cruz公司,按说明书指示操作,染色完成后经清洗、逐级脱水、封固处理,于显微镜下观察统计染色阳性细胞数量,根据阳性细胞占比及切片染色强度分别进行计分,以磷酸盐缓冲液作为阴性对照,以已知阳性的胸腺癌病理切片作为阳性对照,最终标准分=染色强度得分×阳性细胞占比得分,分值达到4分及以上即表明结果为阳性[9]。
1.3 观察指标①分析PD-L1、E-cad、N-cad、STAT3在胸腺癌病理组织以及正常胸腺组织中的表达情况。②分析PD-L1、E-cad、N-cad、STAT3与临床病理特征的关系。③统计术后患者随访3年内的生存情况,依据PD-L1、E-cad、N-cad、STAT3表达结果分别绘制阳性及阴性患者生存曲线。④以患者的3年生存率作为因变量,分析性别、年龄、病程、TNM病理分期、Masaoka-Koga分期、肿瘤最大直径、淋巴结转移情况、合并重症肌无力、手术切除情况等临床基线资料以及PD-L1、E-cad、N-cad、STAT3的表达结果等自变量与患者预后的关系。⑤分析影响胸腺癌患者术后生存的独立预测因素。
1.4 统计学方法使用SPSS 22.0统计学软件包进行数据处理。计数资料以例数或百分比表示,采取χ2检验。生存分析采用Kaplan-Meier法,使用Log-rank法进行显著性检验;预后的影响因素采用COX多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 PD-L1、E-cad、N-cad、STAT3表达情况分析胸腺癌组织中PD-L1、N-cad、STAT3表达阳性率均高于正常胸腺组织,E-cad表达阳性率低于正常胸腺组织(P<0.05),见表1。
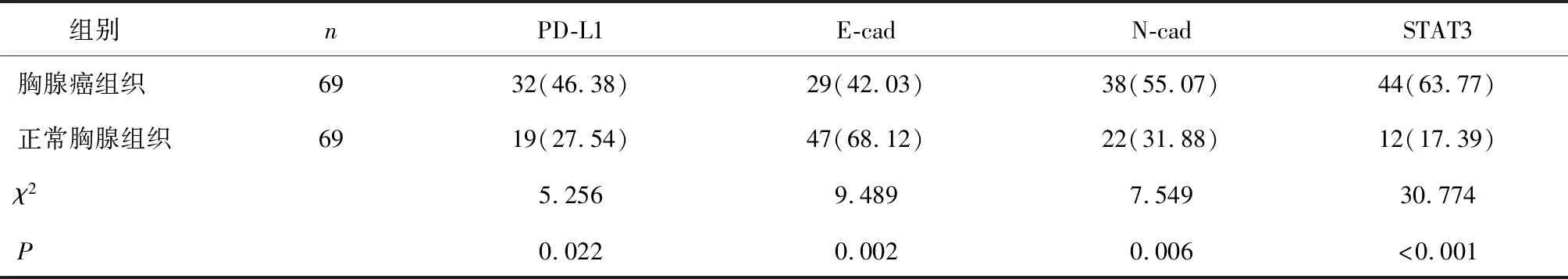
表1 胸腺癌组织与正常组织中PD-L1、E-cad、N-cad、STAT3表达情况比较 [n(%)]
2.2 不同临床病理特征胸腺癌患者PD-L1、E-cad、N-cad、STAT3表达阳性率比较不同TNM病理分期、不同Masaoka-Koga分期、不同淋巴结转移情况胸腺癌组织中PD-L1、E-cad、N-cad、STAT3的表达均存在显著差异,不同肿瘤直径癌组织中PD-L1、STAT3表达阳性率不同(P<0.05),见表2。

表2 不同临床病理特征胸腺癌患者PD-L1、E-cad、N-cad、STAT3表达阳性率比较 (n)
2.3 胸腺癌患者术后生存情况分析随访至术后3年,69例患者中51例存活(73.91%),18例死亡(26.09%)。分析结果显示,PD-L1、N-cad、STAT3表达阳性组术后3年生存率低于阴性组(log-Rankχ2=13.375、5.074、6.652,P<0.05),E-cad表达阳性组术后3年生存率高于阴性组(log-Rankχ2=3.921,P<0.05),见图1~4。

图1 不同蛋白表达患者生存曲线 a:PD-L1; b:E-cad; c:N-cad; d:STAT3
2.4 不同临床病理特征胸腺癌患者术后3年生存率比较不同TNM病理分期、Masaoka-Koga分期、淋巴结转移情况、手术切除情况、PD-L1、E-cad、N-cad、STAT3表达的胸腺癌患者术后3年生存率比较,差异均有统计学意义(P<0.05),见表3。

表3 不同临床病理特征胸腺癌患者术后3年生存率比较 [n(%)]
2.5 胸腺癌患者术后预后的影响因素分析TNM病理分期、Masaoka-Koga分期、手术切除程度、PD-L1及STAT3阳性表达均为胸腺癌患者预后独立预测因素(P<0.05),见表4。

表4 胸腺癌患者术后预后的影响因素分析
3 讨论
胸腺癌早期症状不明显,病情确诊时往往已进入进展期,胸腺周边肺叶、纵膈血管等组织易受肿瘤侵犯,也给根治性手术切除带来了一定的治疗难度。部分学者研究指出,根治性切除是影响胸腺癌患者生存的唯一独立预后影响因素[10],临床分型结果相近的胸腺癌患者远期预后仍然会表现出一定差异,原因主要在于肿瘤的生长分化机制复杂,不仅受到内源性基因及信号激活水平影响,还受到机体免疫抑制、蛋白表达等外源性因素影响[11],因此无法凭借单一标准对患者预后结局作出准确评价,明确其背后的影响机制将有助于临床采取针对性的治疗干预措施,降低癌症死亡风险并改善患者预后生存质量。
邹珏等[12]研究表明,PD-L1在肿瘤微环境中呈现高表达,其表达水平越高表明机体内源性抗肿瘤免疫效应越低,对T细胞活化增殖抑制效果越显著,肿瘤细胞逃避免疫杀伤能力越强,从而难以限制肿瘤进展;STAT3受上游生长因子激酶及细胞因子受体激活后所形成的的磷酸化STAT3二聚体将会直接影响到靶基因的转录,调节miRNAs和lncRNAs的表达,并通过多途径诱导免疫抑制因子分泌、促进肿瘤间质重塑、加快肿瘤细胞增殖[13]。本研究结果显示,胸腺癌组织中PD-L1、STAT3表达阳性率明显高于正常胸腺组织,同时PD-L1、STAT3的阳性表达均可作为患者预后的独立预测因子。蒙秋华等[14]研究指出,蛋白酪氨酸磷酸酶受体D相关微小RNA以及蛋白的表达水平可经靶向STAT3通路调控PD-L1过表达,陈丽等[15]研究发现微小RNA-195-5p可通过相似机制引导肿瘤细胞的增殖侵袭行为,表明PD-L1与STAT3均受胸腺癌相关基因调控,同时PD-L1的表达受到STAT3的直接影响,两者可能对肿瘤进展起到协同促进作用。这提示临床或许可通过应用PD-L1免疫抑制剂等方案控制病情进展[16],同时为临床探究PD-L1、E-cad、N-cad、STAT3上游基因在胸腺癌疾病中的调控机制以及靶向治疗方案的制定提供了新的思路。
E-cad、N-cad均为参与EMT程序的重要因子,E-cad表达下调将导致肿瘤细胞间黏附力下降,而N-cad在细胞发育过程中起到介导细胞分离、维护组织完整性的作用,其表达可能与PI3K/Akt信号通路激活相关,并对肿瘤存活、转移与侵袭行为产生直接影响[17,18]。本研究结果显示,胸腺癌组织中E-cad表达阳性率较正常胸腺组织偏低,而N-cad表达阳性率偏高,E-cad、N-cad的阳性表达率在不同临床TNM病理分期、Masaoka-Koga分期、淋巴结转移患者存在显著差异,而在不同肿瘤直径的患者间其阳性表达率并无明显差异。郝攀等[19]研究证实微小RNA301a可调节EMT相关基因表达,促使上皮细胞发生间质化转变,本研究中肿瘤细胞向淋巴结及全身的转移情况以及对周边正常组织细胞的浸润程度或许也受此影响。PD-L1、STAT3对肿瘤最大直径的影响较E-cad、N-cad更为显著,原因可能在于E-cad、N-cad主要调控肿瘤细胞的分离扩散,而PD-L1、STAT3对肿瘤生长的诱导作用更强。此结果表明,对于高浸润度、高转移风险的患者而言,术后还应密切关注患者辅助化疗期间肿瘤的生长情况[20],可通过提取附近组织检测E-cad、N-cad的表达预测局部病变发生远端转移的可能性。
综上所述,PD-L1、E-cad、N-cad、STAT3阳性表达率在不同TNM病理分期、不同Masaoka-Koga分期、不同淋巴结转移情况的胸腺癌患者组织中呈现显著差异,其中,PD-L1及STAT3阳性表达为预后的独立预测因素,临床或许可通过根治性手术切除、结合PD-L1免疫抑制剂药物治疗、针对性采取靶向治疗等方案改善患者的临床结局。
