盐胁迫下配施钙肥对花生根际土壤细菌群落结构的影响
2022-07-28戴良香张冠初史晓龙秦斐斐姜常松张智猛
戴良香,丁 红,徐 扬,张冠初,史晓龙, 秦斐斐,郭 庆,姜常松,张智猛
(1.山东省花生研究所,山东 青岛 266100;2.沈阳农业大学农学院,辽宁 沈阳 110866;3. 海阳市果业发展服务中心,山东 烟台 265100)
土地盐碱化是世界范围内面临的重要环境问题,近50%的灌溉土地有不同程度的次生盐碱化[1]。中国是世界上土地盐碱化面积最大的国家之一,可利用的盐碱地面积达670万公顷,其中中轻度盐碱地面积占30.1%,中重度盐渍化威胁的低产田占总耕地的22%,此区温光热等自然资源较为充沛,农业开发利用潜力巨大[2-3]。花生是重要的油料和经济作物,抗逆性较强,并具耐瘠、固氮、培肥地力等特性,还可耐受0.30%~0.45%的盐浓度,种植效益明显,抗风险能力较强,是盐碱土区重要经济和油料作物的适宜替代作物[4],在缓解粮油作物争地矛盾、保障我国食用油安全领域具有明显的产业优势。
植物根际微生境是土壤中活性最强的微生境,也是植物获取养分的主要区域。在此微域里植物—微生物—土壤—环境间相互作用,共同维持着根际微生态系统的平衡,影响作物生产[5]。研究表明,盐胁迫使土壤微生物群落结构和组成发生变化,植物根际微生态区系失衡,并与环境和植物种类有关[6-7]。滨海盐碱土较高含盐量的根层土壤微生物种类、优势种群数量和群落功能多样性较非盐碱土壤更为丰富[8]。外源施钙对盐碱土具有较强的降盐改土效果[9-11],对花生光合产物积累及产量品质提高具有促进作用[12-13],但有关外源钙对盐胁迫下花生不同生育时期根际微生物群落特征变化的影响鲜见报道。本试验以盐胁迫下旺盛生长期和成熟期花生根际土壤为研究对象,利用高通量测序技术对土壤中细菌种类及多样性进行系统分析,探讨盐胁迫下配施钙肥对不同生育时期花生根际土壤细菌群落组成和多样性的影响,有助于认识盐碱地花生根际土壤微生物群落功能调节并发掘新的功能类群,对改良盐碱土壤和开发利用盐碱土区资源、提高盐碱土区农业种植结构抗风险能力及盐碱地花生高产优质栽培均具重要意义。
1 材料与方法
1.1 试验材料
选择花生品种花育25号(HY25)为试验材料。供试土壤采用山东省花生研究所莱西试验站耕地0~20 cm表层土壤,其基本理化性质:土壤有机质含量12.84 g·kg-1,全氮1.82 g·kg-1,全磷(P2O5)1.02 g·kg-1,全钾(K2O)11.01 g·kg-1,水解氮(N)102.5 mg·kg-1,速效磷(P2O5)13.1 mg·kg-1,速效钾(K2O)114.2 mg·kg-1,土壤pH值6.9,土壤含水量9.34%。
1.2 试验设计
试验于山东省花生研究所试验站防雨棚中进行,土壤风干、过筛(1 cm)后装入同批次、同规格塑料盆中(底部直径为36 cm,高为26 cm),每盆装土量为18 kg。选取饱满均匀的种子,每盆播6粒,播深均为3 cm,留4株长势一致的幼苗。
设置3个盐胁迫梯度:0.00 g·kg-1(Y0)、1.5 g·kg-1(Y1)、3.0 g·kg-1(Y2),用分析纯NaCl重量法调节盐分浓度,以烘干土为基数。各处理均配合施用钙肥(CaO)150 kg·hm-2(C)。播种前先将供试三元复合肥(15∶15∶15)按300 kg·hm-2的用量与钙肥以基肥形式均匀施入各栽培盆中,随后各处理浇入2 L清水沉实,待土壤墒情适宜时将土壤充分混匀,以使盐分与施入的基肥和钙肥均匀分布。以原状土(不施钙肥、三元复合肥和NaCl)为对照,随机排列,6次重复。分别于开花下针期(播后75 d)和收获期(播后125 d)采集花生植株根际土壤样本。根际土壤样本的采集以处理为单元进行,采用多点混合样本采集方法,以盆为单位分别小心地从盆中取出植株,去除根际附着不紧密的土壤,然后用无菌刷收集附着紧密的土壤,混合每盆中植株根际土壤,每3重复根际土壤样品混合为1个生物学样本重复,每处理均获取2个生物学重复,封入无菌袋,置于冰盒带回实验室,保存于-80℃冰箱备用。
开花下针期各处理土壤样本分别表示为CK、CY0、CY1、CY2,收获期各处理土壤样本分别表示为HCK、HCY0、HCY1、HCY2。相关测试由北京诺赛基因公司进行。
1.3 土壤DNA提取
收集所得土壤样品利用OMEGA土壤总DNA提取试剂盒(OMEGA soil DNA kit)进行提取。所得DNA采用1.5%琼脂糖凝胶电泳和Nanodrop2000 分光光度计检测DNA的纯度和浓度。
1.4 16s rRNA文库构建及高通量测序
以提取的土壤样本DNA为模板,利用引物340F:CCTACGGGNBGCASCAG以及805R:GACTACNVGGGTATCTAATCC对16s rRNA基因的V3-V4区进行扩增。扩增程序:95℃预变性3 min;30个循环(95℃,30 sec;50℃,30 sec;72℃,60 sec);72℃,7 min。PCR 产物使用1.5%浓度的琼脂糖凝胶进行电泳检测;根据PCR 产物浓度进行等浓度混样,充分混匀后使用0.5×TBE 浓度1.5%的琼脂糖凝胶电泳纯化PCR 产物,割胶回收目标条带。产物纯化试剂盒使用的是QIAGEN公司的MinElute胶回收试剂盒。最后使用HiSeq2500进行250PE测序。
1.5 土壤微生物的生物信息学分析
对花生根际土壤微生物的多样性和丰富度进行Alpha多样性和样本间Beta多样性分析,同时进行群落结构统计分析和基于OTU的物种组成聚类,分析挖掘样本间物种组成差异和生物功能分析。
2 结果与分析
2.1 花生根际土壤微生物群落测序数据分析
OTU为基于序列相似性阈值的样本序列,一般将相似性值≥97%的序列定义为同一个OTU。图1A显示,多数样本序列平均长度在400~502 bp,部分样本序列长度在450~500 bp之间。通过维恩图分析,各处理根际土壤样本共有OTU数量 2 446个,存在于CY1、CK、CY2处理样本中的OTU数分别为29、25个和23个,而存在于HCK、HCY0和HCY2各处理样本中的OTU数均不足10个,表明各处理样本微生物组成非常相似,开花下针期根际微生物物种较为丰富(图1B)。
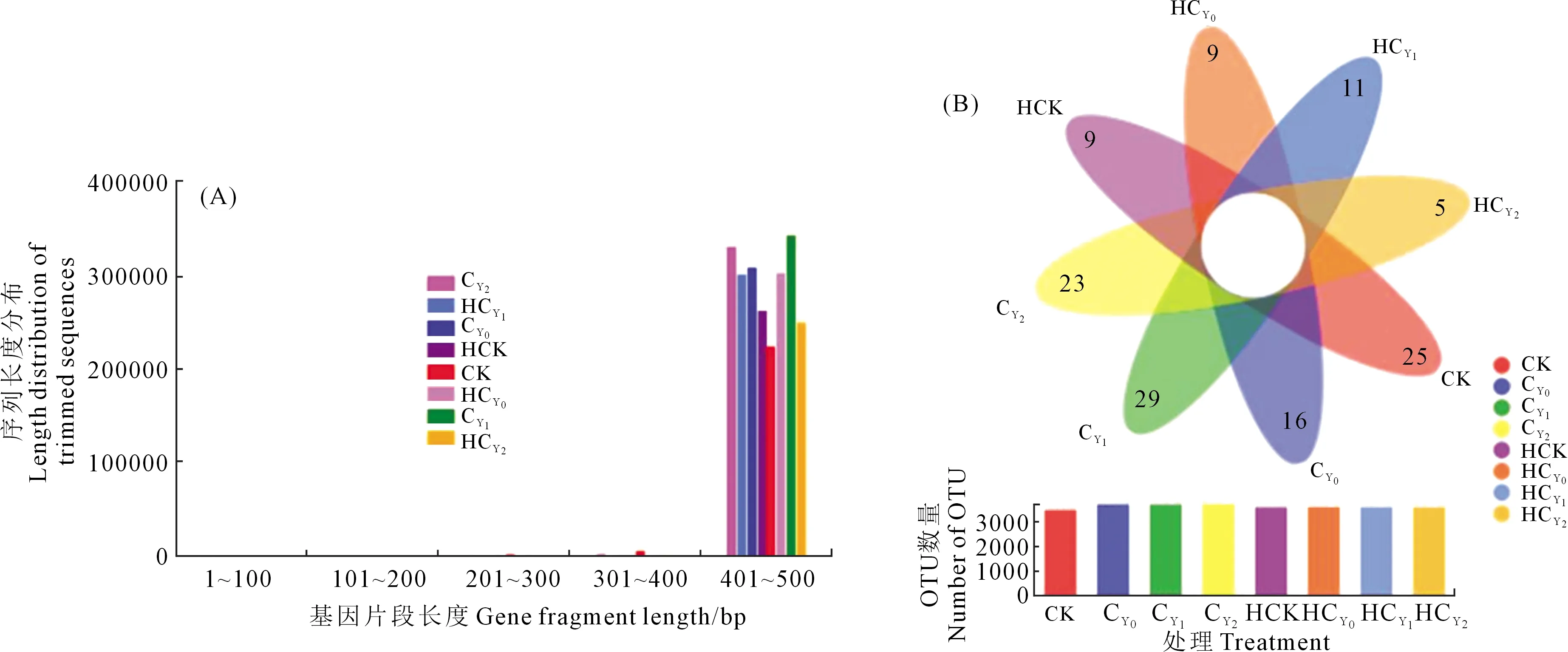
图1 花生根际土壤细菌群落测序数据分析Fig.1 Overall sequence data of bacterial communities in the peanut rhizosphere
2.2 多样性分析
2.2.1 稀释曲线 稀释性曲线(Rarefaction curves)可显示花生根际细菌基因测序深度和群落多样性,被用来评价测序量是否足以覆盖所有类群。如图2所示,随测序数据量的增加物种丰富度呈现前期迅速增加的趋势,各处理样本在测序量达到30 000条以上时,稀释曲线趋近平缓,各处理土壤样本微生物群落测序数据达到饱和,测序量能够覆盖花生根际土壤微生物组群落的绝大部分物种(图2A)。各处理样本重复间取其均值进行比较发现,对照、盐胁迫和配施钙肥各处理OTU数量基本一致,相互间均无显著差异。
Rank Abundance曲线能直观地显现各样本中OTU的均匀度和丰富度。当各样本OTU数量小于1 000时,曲线下降迅速、不平缓,相对应的物种相对丰度较高但均匀度较低,当OTU数量大于2 000时曲线较为平缓,相对应的物种相对丰度较低,在土壤样本分布较为均匀(图2B)。各处理样本间曲线宽度及平滑程度较为一致,表明不同处理样本中物种丰富度及均匀度均无显著差异。
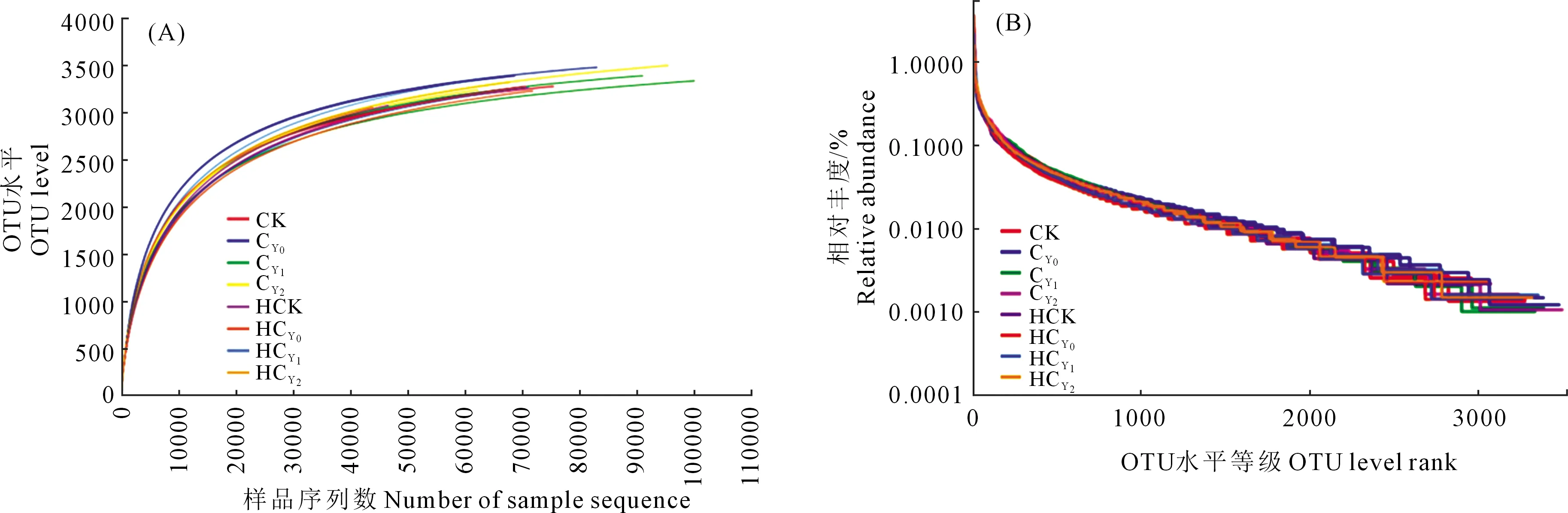
图2 稀释性曲线和Rank Abundance曲线分析Fig.2 Rarefaction curves and Rank Abundance curves analysis
2.2.2 多样性指数 通过多样性指数组间差异分析发现,各处理样本微生物群落中OTU的Chao和Sob指数分别为3522.40~3762.58和3113.00~3428.50。Shannon和Simpson多样性指数为6.57~7.11和0.001946~0.005682,Shannon多样性指数除HCY0与HCY1间、HCY1与HCY2间无显著差异外,其余处理间均呈显著或极显著差异;开花下针期各处理样本OTU的Shannon多样性指数均显著或极显著高于收获期,而Simpson多样性指数则是收获期显著或极显著高于开花下针期(图3A,3B,3C,3D)。盐胁迫可提高花生根际微生物群落丰富度和多样性,并与生育时期有关。
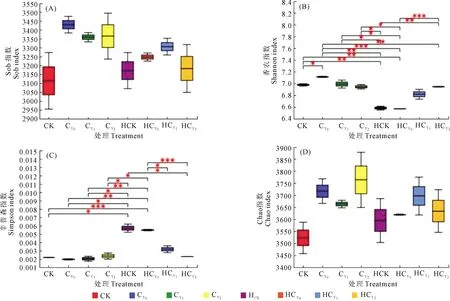
图3 多样性指数组间差异分析Fig.3 Difference analysis of diversity index between groups
2.3 花生根际土壤细菌物种群落组成分析
2.3.1 全样本纲水平菌落结构分析 各处理样本群落物种组成共有73个纲, Top11(其余合并<0.03)菌纲相对丰度之和为85.09%,其中Actinobacteria放线菌纲、α-变形菌纲(Alphaproteobacteria)和γ-变形杆菌纲(Gammaproteobacteria)3个菌纲相对丰度均在12.64%以上,三者之和为45.88%。疣微菌纲(Verrucomicrobiae)、Saccharimonadia、芽单胞菌纲(Gemmatimonadetes)、拟杆菌纲(Bacteroidia)和酸杆菌纲(Acidobacteriia)的相对丰度均在5.01%以上。基施钙肥处理可使放线菌纲(Actinobacteria)、Saccharimonadia菌纲丰度明显降低,并随盐胁迫强度提高丰度降幅明显,且以开花下针期降幅较大,其CY2、HCY2分别较其对照降低-43.36%、-27.59%和-92.456%、-78.31%。施钙肥使γ-变形杆菌纲和疣微菌纲丰度提高,并有随盐胁迫强度升高呈升高趋势,其CY2、HCY2分别是其对照的1.2、1.8倍和1.6、1.5倍,尤以收获期升高明显(图4)。表明盐胁迫及其强度和基施钙肥处理能显著提高γ-变形杆菌纲和疣微菌纲丰度,并随生育时期的延长更为明显。
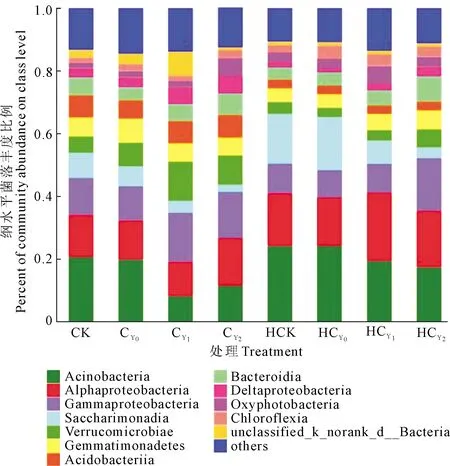
图4 花生根际土壤细菌菌落纲水平结构Fig.4 Bacterial community structure in peanut rhizosphere at class levels
2.3.2 全样本科水平菌落结构分析 图5示出,所有样品包含的351个科中其Top12(其余合并<0.03)菌科相对丰度之和为42.77%,其中,相对丰度在3.24%以上的优势菌科有norank_o__Saccharimonadales、鞘脂单胞菌科、芽单胞菌科、伯克氏菌科和norank_o__Gaiellales菌科等5个,其相对丰度分别为7.59%、6.41%、5.08%、4.14%和3.24%。norank_o__Saccharimonadales、norank_o__Gaiellales、噬几丁质菌科(Chitinophagaceae)和丰佑菌科(Opitutaceae)丰度受盐胁迫强度和花生生育进程影响较大,并随盐胁迫强度的升高增降幅度显著,其中,norank_o__Saccharimonadales和norank_o__Gaiellales两菌科丰度于开花下针期和收获期分别较对照增加-72.27%、-67.08%和-81.20%、-51.75%,噬几丁质菌科和丰佑菌科(Opitutaceae)丰度则分别增加56.58%、120.98%和86.15%、137.41%。收获期norank_o__Saccharimonadales和鞘脂单胞菌科各处理的平均相对丰度是开花下针期的2.1倍和1.87倍,其中,HCK、HCY0分别是CK、CY0的1.92倍和2.68倍。
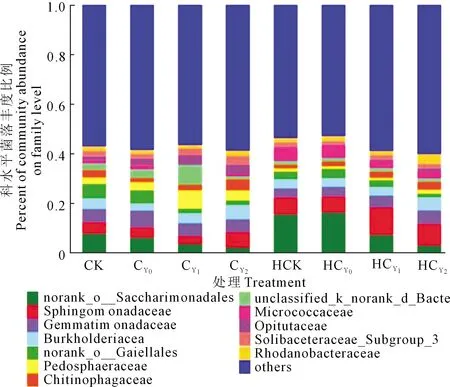
图5 花生根际土壤细菌菌落科水平结构Fig.5 Bacterial community structure in peanut rhizosphere at family levels
2.3.3 全样本种水平菌落结构分析 图6示出,各处理花生根际土壤样品包含1 279个菌种,Top13(其余合并<0.02)菌种相对丰度总和为22.56%。两生育时期unclassified_g_norank_f_norank_o_Saccharimonadales、uncultured_bacterium_g_norank_f_norank_o_Saccharimonadales和unclassified_f_Micrococcaceae丰度均随盐胁迫强度的升高明显降低且收获期均显著高于开花下针期。但开花下针期unclassified_k_norank_d_Bacteria丰度则显著高于收获期。其中,HCK和HCY0分别是CK和CY0的3.7、2.0倍。花生生育时期和盐胁迫显著影响根际细菌菌种水平组成的相对丰度。
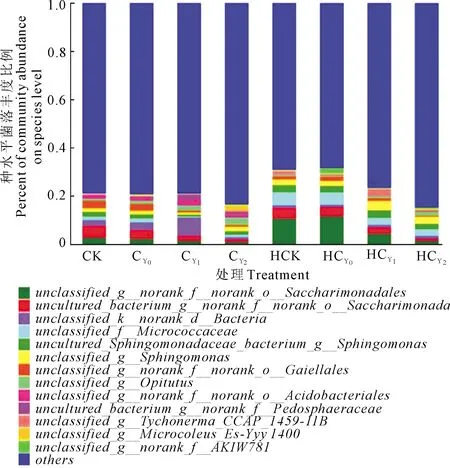
图6 花生根际土壤细菌菌落种水平结构Fig.6 Bacterial community structure in peanut rhizosphere at species levels
2.4 花生根际土壤细菌多样性分析
利用Qiime软件对各处理样本细菌群落进行PCoA分析(OTU水平),观察个体或群体间的差异。
两轴对排序结果的解释率分别为41.35 %和18.88 %,HCK、HCY0、HCY1和HCY2收获期各样本聚集于图左侧,开花下针期样品聚集于图右侧,HCK、HCY0、CK和CY0处理的样本分布于图中下部,盐胁迫及施用钙肥处理的样本则分布于图上部(图7A)。花生根际微生物菌群类型盐胁迫影响强烈,非盐碱土壤及其基施钙肥处理微生物菌群类型受影响较小,生育时期不同根际微生物菌群分异明显。
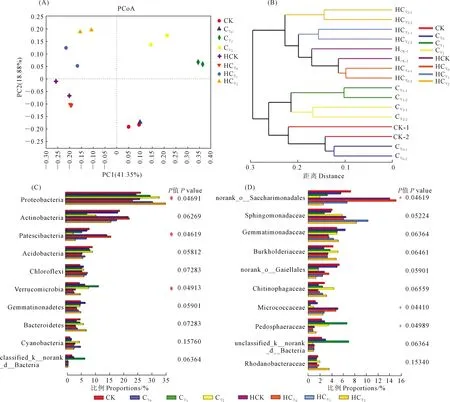
注:*代表P<0.05。 Note: * indicates P<0.05.图7 基于weighted unifrac 距离的土壤微生物群落多样性分析(PCoA)Fig.7 Principal coordinate analysis (PCoA) of soil microbial communities based on weighted unifrac distance
对距离矩阵进行OTU水平层级聚类(Hierarchical clustering),可以看出,在0.15~0.22相似性水平上,16个样本细菌组成可以分为4大组,CK和CY0、CY1和CY2分别聚为一组,HCY0、HCK和HCY1聚为一组,HCY2为一组。之后,又以生育时期为单位(开花下针期和收获期)各聚为一组后,所有样品聚为一族。CK、 CY0和CY1处理在聚类图与其他样品距离最远,与其他样品细菌群落差异最大(图7B)。花生旺盛生长期无盐和低盐处理根际微生物细菌群落与高盐胁迫和成熟期根际样品间差异明显。
运用Kruskal-Wallis秩和检验(Kruskal-Wallis H test),对各处理样本进行优势菌门(图7C)和优势菌科(图7D)的组间差异显著性检验分析,结果表明,在门水平,变形菌门、Patescibacteria和疣微菌门在各处理间存在显著差异。在科水平,norank_o_Saccharimonadales、Micrococcaceae和Pedosphaeraceae各处理间差异显著(*,P<0.05;**,P<0.01)。
2.5 16S功能预测分析
16S功能预测是通过PICRUSt10(phylogenetic investigation of communities by reconstruction of unobserved states)对OTU丰度表进行标准化,去除16S marker gene在物种基因组中拷贝数目的影响,通过每个OTU对应的greengene id,获得OTU对应的COG家族信息以及功能信息,从而得到花生根际微生物群落的功能丰度谱。图8示出,与物种组成相比,所有样本的COG功能组成较为相似。各处理样本富集功能(COG功能)均主要包括氨基酸转运与代谢、能量生产和转换、信号转导机制、转录、细胞壁/膜/包膜生物发生、碳水化合物的运输和代谢、无机离子的运输和代谢、复制重组和修复、翻译/核糖体结构和生物发生等,表明各处理根际样本中微生物代谢功能非常丰富(图8A)。
通过KEGG代谢途径的预测差异分析发现,CK、HCK、HCY2处理样品中微生物群落的功能丰度均明显降低,尤以其他次生代谢产物的生物合成、聚糖的生物合成与代谢、萜类和聚酮化合物的代谢、细胞运动和抗菌耐药性显著降低;CY0、CY1、CY2、HCY0和HCY1处理丰度均明显提高,尤以氨基酸代谢、能量代谢、辅助因子和维生素的代谢和核苷酸代谢各功能富集明显。施用钙肥明显提高根际土壤细菌能量代谢、氨基酸和核苷酸等物质代谢功能,抗逆性和聚糖、萜类和聚酮化合物等其他次生代谢产物的生物合成物种丰度明显降低(图8B)。无盐胁迫处理样品的微生物群落功能丰度和高浓度盐胁迫下收获期样品的微生物群落功能丰度均明显降低,适度盐胁迫使得根际土壤微生物群落功能丰度升高,其物质、能量代谢功能增强,以抵抗盐胁迫逆境的抑制和危害。
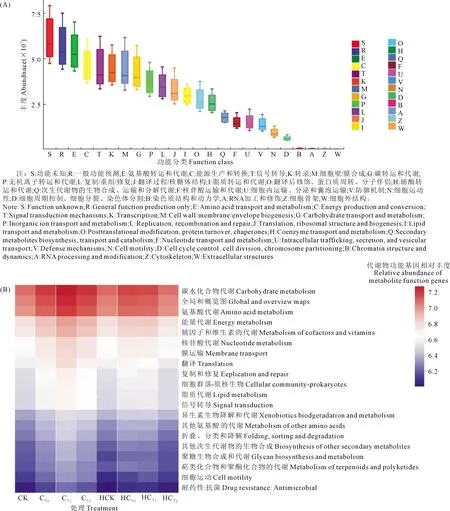
图8 土壤细菌菌群功能预测Fig.8 Bacterial functional features on cluster of orthologous groups (COG) analysis
2.6 盐胁迫下配施钙肥对花生产量的影响
由表1看出,盐胁迫明显影响花生出米率、百果质量、百仁质量和荚果产量,并随盐胁迫程度的提高作用显著,施用钙肥可显著提高无盐胁迫处理下的百果质量和荚果产量,对出米率和百仁质量有促进作用但不显著,盐胁迫处理的百仁质量较CK和CY0分别降低12.94%、20.44%和38.70%、43.98%,高盐胁迫处理的荚果产量仅分别为CK和CY0的50.0%和40.4%。可见,盐胁迫严重抑制花生籽仁发育和产量形成,施用钙肥可提高花生产量,钙肥对盐胁迫下的作用机理有待深入研究。
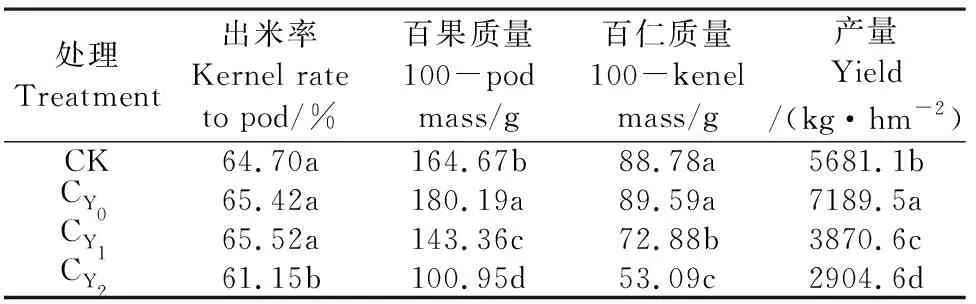
表1 盐胁迫下施钙肥对花生产量及产量构成因素的影响Table 1 Effects of calcium fertilizer application on peanut yield and its components under salt stress
3 讨 论
植物根际环境与土壤中的微生物菌群关系密切,其根际微生物群落动态极可能直接影响着植物健康及养分高效利用。在植物生长过程中,环境微生物受根际分泌物的刺激和盐浓度影响,存在着微生物适应性和群落分布的演变,受植物种类、生长阶段、水肥吸收规律、健康状况及土壤理化性质等的影响[14-16]。土壤盐渍化所引发的生态灾难是由盐胁迫对地上部植物群落与土壤微生物群落同时作用后产生的结果[17-19]。土壤盐胁迫程度影响根际微生物类型和群落组成,在无盐或低盐条件下土壤微生物数量、丰富度、活性与盐分含量呈负相关,盐碱胁迫处理显著降低根际土壤细菌群落丰富度和群落功能稳定性[20-23]。盐胁迫条件下耐盐植物根际环境中细菌群落组成与其耐盐性有关,中度耐盐植物根际环境中变形菌门和厚壁菌门较丰富,轻度耐盐植物根际环境中含有较多的酸杆菌门和芽单胞菌门细菌[7,24]。黄河三角洲滨海盐碱土高含盐量土壤根际微生物种类、优势种群数量和群落功能多样性较非盐碱土更为丰富。滨海盐碱地花生根际土壤优势细菌门为变形菌纲(α-变形菌纲、γ-变形菌纲、β-变形菌纲和δ-变形菌纲)、放线菌门、酸微菌纲、厌氧绳菌纲、嗜热油菌纲、纤维粘网菌纲和芽孢杆菌纲等。盐碱土壤花生根际γ-变形菌纲和酸微菌纲/目(Acidimicrobiia)丰度是非盐碱土壤花生根际的3~5倍,而嗜热油菌纲和Gaiellales菌目的丰度则正好相反,其仅是非盐碱土壤花生根际的1/5~1/3[25-27],本试验结果与前人研究结果基本一致。盐胁迫和较高的强度显著影响根际微域群落结构,对花生根际细菌菌群组成结构具有显著调控效应,其丰富度和多样性提高,在花生旺盛生长期作用更为明显。但盐胁迫下外源施钙对根际微生物菌群结构的影响较小。各处理根际样本其优势菌纲均为放线菌纲、α-变形菌纲、γ-变形杆菌纲、疣微菌纲、Saccharimonadia、芽单胞菌纲、拟杆菌纲和酸杆菌纲等。优势菌科有norank_o__Saccharimonadales、鞘脂单胞菌科、芽单胞菌科、伯克氏菌科和norank_o__Gaiellales菌科。
盐胁迫和基施钙肥处理均能显著提高γ-变形杆菌纲和疣微菌纲丰度,并随生育期的推进和盐胁迫强度提高更为明显。但盐胁迫下基施钙肥处理可使放线菌纲、Saccharimonadia菌纲丰度明显降低,并随盐胁迫强度提高丰度降幅明显,且开花下针期降幅较大。噬几丁质菌科和丰佑菌科的丰度受盐胁迫强度和生长阶段影响显著,并随盐胁迫强度升高而显著提高。各处理变形菌门、Patescibacteria和疣微菌门间以及norank_o__Saccharimonadales、Micrococcaceae和Pedosphaeraceae菌科间差异均达显著水平。
根际微生物群落在植物和土壤之间发挥着重要作用,植物在不同生长阶段对其根际微生物种类及丰度产生显著影响[28-29]。不同的发育阶段其根际微生物种类和数量存在较大差异,黄瓜、大豆、玉米等作物主要根际微生物数量随生长发育呈动态变化,从生长初期到盛果期持续增加,生长后期有所下降[30-32]。蒙古黄芪不同生育期内根际土壤细菌变化最为明显,不同种源间根际微生物群落组成相似[33-34]。本试验结果表明,花生生长发育时期对根际菌群结构影响显著,不同生育时期根际微生物菌群类型分异明显,旺盛生长期低盐处理根际微生物细菌群落与高盐胁迫和成熟期根际样品间差异明显。生长盛期和基施钙肥处理的氨基酸代谢、能量代谢、辅助因子和维生素的代谢和核苷酸代谢等功能基因丰度显著提高。因此,从植物根际分离筛选具有多种植物促生耐盐特性的优势菌株,开发具有增强主要粮食作物耐盐胁迫能力的根际促生菌,研制盐碱地粮食增产的专用微生物肥料,为盐碱地高效利用和农业增产提供技术保障,是今后高效开发利用盐碱地潜力的重要方向。
4 结论
花生根际土壤微生物优势菌群组成结构不受盐胁迫和生育时期的影响,各处理根际样本微生物组成相似,并以开花下针期根际微生物物种较为丰富,但根际细菌群落相对丰度受盐胁迫及其强度影响。各处理优势菌纲均为放线菌纲、α-变形菌纲、γ-变形杆菌纲、疣微菌纲、芽单胞菌纲、拟杆菌纲和酸杆菌纲,盐胁迫和基施钙肥可显著提高γ-变形杆菌纲和疣微菌纲丰度,并随生育时期的延长更为明显。施用钙肥使得变形菌门、Patescibacteria和疣微菌门在门水平下各处理间显著差异;花生生长时期、盐胁迫强度使根际微生物细菌群落间差异明显。较高浓度盐胁迫下花生收获期样品的微生物群落功能丰度明显降低,但较低强度盐胁迫使其丰度升高,其物质、能量代谢功能增强,以抵抗盐胁迫逆境的抑制和危害。
