基于TGF-β1/Smad2/3信号通路探究刺梨多糖缓解运动性免疫抑制发生的机制
2022-07-28张帅军唐月梅宋红利牛英鹏
张帅军,唐月梅,宋红利,牛英鹏,张 锦
运动性免疫抑制(Exercise-induced Immunosuppression,EIS)是由长期大强度运动引起机体免疫功能低下的一种异常体征,表现为淋巴细胞计数紊乱,自然杀伤细胞活性降低,淋巴细胞转化减低以及分泌型IgA减少等。EIS严重影响运动员体质健康和运动成绩的提升,探索EIS的发生机制和调理措施对提升竞技运动成绩具有重要的现实意义。目前,国内外学者在EIS研究方面提出了神经内分泌紊乱、免疫抑制因子产生、自由基增加、营养物质耗竭、心理应激增强等揭示EIS发生的学说和以心理、营养、中医药等干预EIS发展的措施,对认识和干预EIS的发生、发展具有重要的意义。
刺梨多糖(Rosa Roxburghii Polysaccharide,PRR)是蔷薇科落叶灌木刺梨最主要的活性成分之一。其免疫调节作用在动物和离体细胞培养等方面早已被证实,崔昊等研究指出,PRR具有抗补体活性功能;路筱涛等研究表明,PRR具有提升小鼠免疫低下的功能作用;陈代雄等研究显示,PRR具有提升动物免疫功能的作用。但目前PRR免疫调节机制的报道还不多,在EIS方面的作用和机制还不清楚,因此,本研究在建立运动性免疫抑制大鼠模型的基础上,通过补充不同剂量的PRR,观察大鼠体质量和脾脏组织形态结构变化,检测大鼠血清氧化应激指标、生化指标水平,并结合TGF-1/Smad2/3信号通路相关因子基因和蛋白的表达水平,从细胞信号转导通路方面探讨PRR缓解EIS发生、发展的作用机制,对提升运动员体质健康和运动成绩具有重要的现实意义,同时,也为刺梨作为天然抗氧化剂及免疫调节剂的开发利用提供理论依据。
1 材料与方法
1.1 动物、材料与试剂

刺梨果粉:陕西森元生物科技有限公司。
sIgA试剂盒(上海将来实业股份有限公司);T淋巴细胞亚群CD4-FITC/CD8-PE荧光单克隆抗体试剂盒(艾博抗上海有限公司);IFN--FITC/IL-4-PE 单抗(美国Becton Dickinson公司);转化生长因子-1(TGF-1)单克隆抗体、转化生长因子-2型受体(TR2)单克隆抗体、Smad2/3多克隆抗体、HRP标记山羊抗兔IgG(亚科因武汉生物技术有限公司)。
1.2 仪器与设备
JD-PT动物实验跑台(上海继德教学实验器械厂),YKY-1100显微镜(基恩士中国有限公司),LD-96A酶标仪、莱恩德荧光定量PCR仪(山东莱恩德智能科技有限公司),Countstar Rigel S2智能细胞分析(上海睿钰生物科技有限公司),DYCZ-40K转印电泳仪、WD-9413B型凝胶成像分析系统(北京六一生物科技有限公司)。
1.3 方 法
1.3.1 刺梨多糖提取和含量测定

1.3.2 刺梨多糖溶液的配制
参照文献称取1 g刺梨多糖溶于20 ml去离子水中,配置质量浓度为50 mg/ml的刺梨多糖溶液。
1.3.3 分组、建模
按体质量大小排序,采用区组化随机分组的方法,分为正常对照组(C组,10只)、运动训练组(E组,10只)、运动+小剂量刺梨多糖组(ES组,10只)、运动+大剂量刺梨多糖组(EB组,10只)。运动方案参照经典的Bedford方法改良,采用6周递增负荷跑台训练模式造模EIS大鼠模型(具体方案见图1)。实验前E组、ES组和EB组进行为期3天的适应性跑台运动,正式训练以初始速度10 m/min开始,40 m/min为大鼠极限负荷强度。训练时间按照训练方案上的具体时间严格执行,每周训练5天(周一至周五)。从第2周开始每次训练时间的后1/3达目标速度并持续在目标速度上运动,直至力竭。训练中采用声、光、电刺激大鼠尾部促使持续运动,有个别大鼠不能维持预定的运动强度时,可休息1~2 min,但总休息时间不能超过5 min。由于大鼠的有氧能力存在差异,实验中以大鼠力竭不能再继续运动而结束当天训练。运动中以大鼠滞跑道的后1/3处达3次以上,不能维持原有强度运动,且刺激驱赶无效(10 s)视为力竭标准。实验过程中可能训练强度过大或其它原因,导致E组2只死亡、ES组2只死亡、EB组1只死亡。参考《动物实验学》中人与动物剂量的换算标准,按照6 mL/kg剂量灌胃,C组、E组灌胃生理盐水,ES组、EB组分别以100 mg/kg、200 mg/kg的含量灌胃刺梨多糖溶液,每天1次。

图1 大鼠跑台训练方案图
1.4 指标检测
1.4.1 取 材

1.4.2 各组大鼠体质量和鼻腔冲洗液sIgA含量
每周称量大鼠体质量并记录。ELISA法测定鼻腔冲洗液中的sIgA含量。
1.4.3 各组大鼠脾脏组织微结构变化
将脾脏从固定液中取出,放入包埋盒中、流水冲洗30 min、置于不同浓度梯度的酒精中脱水、透明剂二甲苯中渗透、石蜡包埋、切片、展片、烤片、脱蜡、HE染色、光镜下观察脾脏微结构变化。
1.4.4 各组外周血T淋巴细胞亚群数量以及细胞因子水平的检测
取待测血液100 μl,加20 μl CD-FITC/CD-PE单抗,对照管加入IgG1-FITC/IgG1-PE单抗,摇匀、避光、25℃孵育1 h,加入红细胞裂解液,PBS洗涤,智能细胞分析仪检测CD、CD的数量。

1.4.5 各组脾脏组织TGF-1、TR、Smad2/3蛋白表达水平的检测

1.4.6 各组脾脏组织中TGF-1、TR2、Smad2/3的mRNA相对量的检测
RT-PCR检测:取待测组织液,加含PMSF的RIPA裂解液,摇匀、沉淀。用Trizol法提取总RNA,以2 μg RNA作为初始模板,在逆转录酶的作用下反转录成cDNA。参照何云娇等设计的基因引物序列(表1),按试剂盒上说明配置20 μl的反应体系,每组样本检测3个复孔,反应条件为预变性95℃、30 s,PCR反应经95℃、5 s变性后,95℃ 5 s、56℃ 10 s、72℃ 30 s,共40个循环,最后根据各反应孔的Ct值,采用2法测定目的基因的相对表达量。

表1 Real-time PCR基因引物序列表
1.5 数据处理与分析

2 实验结果与分析
2.1 各组大鼠运动性免疫抑制标志物的变化

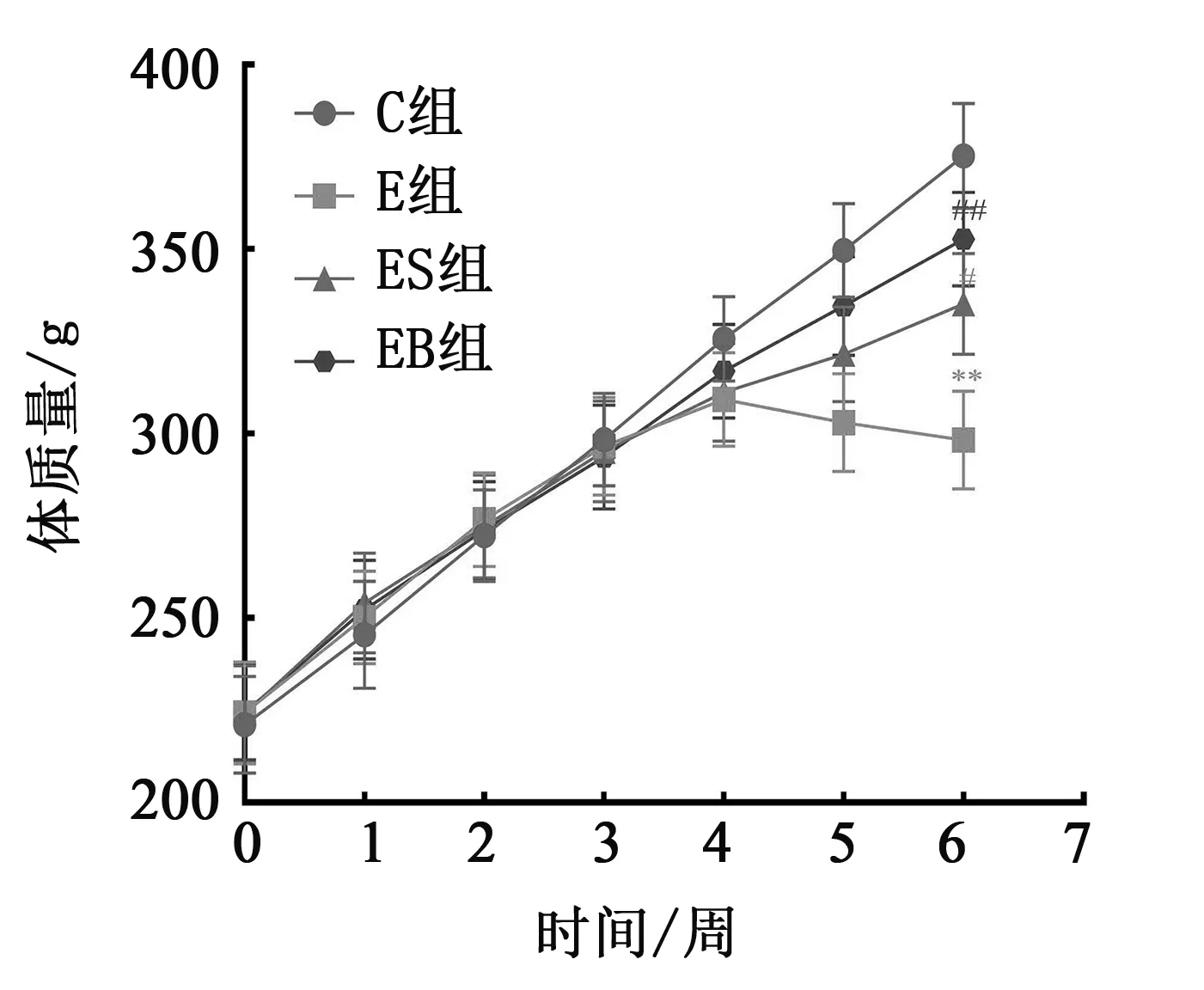
图2 各组大鼠体质量变化趋势图
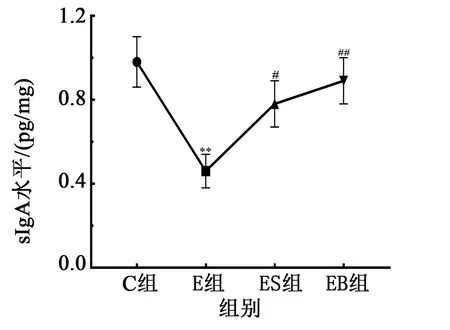
图3 各组大鼠鼻腔冲洗液sIgA水平图
2.2 各组大鼠脾脏组织结构形态的变化
由图4可知,光镜下观察C组被膜完整,脾索分布均匀,脾脏实质细胞均匀分布,组织无浸润现象;E组结构较C组发生明显变化,被膜发生玻璃样变,可见包涵体样物质,脾脏实质细胞弥散,有浸润现象;ES组结构变化较E组有所改善,被膜玻璃样变程度减轻,局部有浸润现象;EB组结构较E组有较好改变,被膜玻璃样变几乎没有,只是局部偶见细胞浸润。说明刺梨多糖在抗氧化降低脾脏组织炎症方面具有积极的作用。
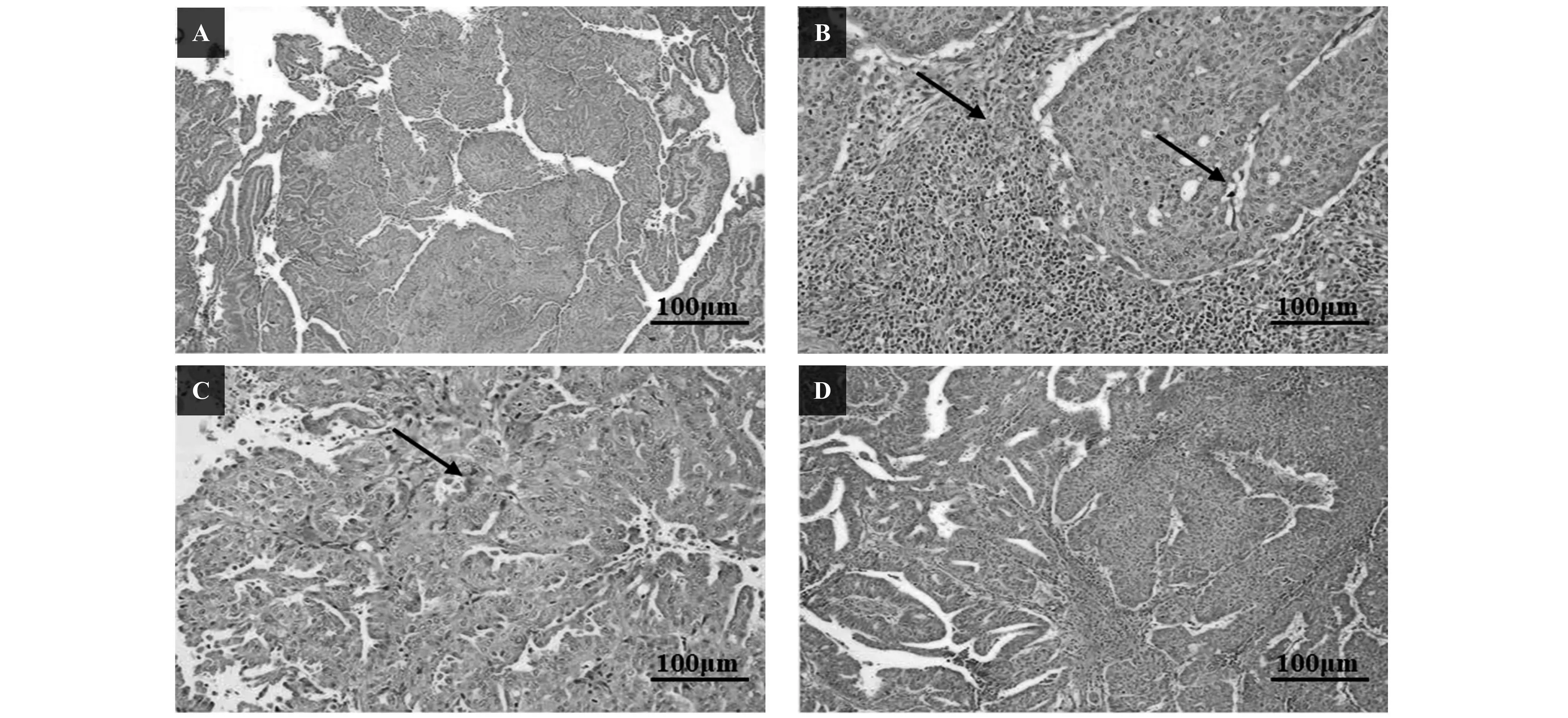
图4 各组大鼠脾脏组织微结构病理变化HE染色 标尺示100μm
2.3 各组大鼠T淋巴细胞亚群CD4+、CD8+以及细胞因子INF-γ、IL-4的变化
如表2所示,T淋巴细胞亚群方面:与C组相比,E组CD下降(<0.01),CD/CD比值下降(<0.05);与E组相比,ES组、EB组CD均升高(<0.05),CD/CD比值也均升高(<0.05),且存在量效关系;CD在各组间没有统计学差异性(>0.05)。细胞因子方面:与C组相比,E组INF-、IL-4水平升高(<0.01),INF-/IL-4比值降低(<0.01);与E组相比,ES、EB组INF-(<0.05),IL-4水平降低(<0.05或<0.01),INF-/IL-4比值升高(<0.05或<0.01),且存在量效关系。说明刺梨多糖在调节T淋巴细胞亚群及细胞因子方面具有积极的作用。

表2 外周血CD4+、CD8+以及INF-γ、IL-4的变化
2.4 各组大鼠脾脏组织中TGF-β1、TβR2、Smad2/3 mRNA相对表达量的变化
如图5所示,与C组相比,E组TGF-1、Smad2/3 mRNA相对表达水平明显降低(<0.01);与E组相比,ES组TGF-1、Smad2/3 mRNA相对表达水平升高(<0.05)、EB组TGF-1、Smad2/3 mRNA相对表达水平明显升高(<0.01);且在TGF-1方面存在量效关系;TR2在各组之间没有统计学差异性(>0.05)。说明刺梨多糖可上调TGF-1/Smad2/3信号通路上部分转录因子基因的相对表达量。
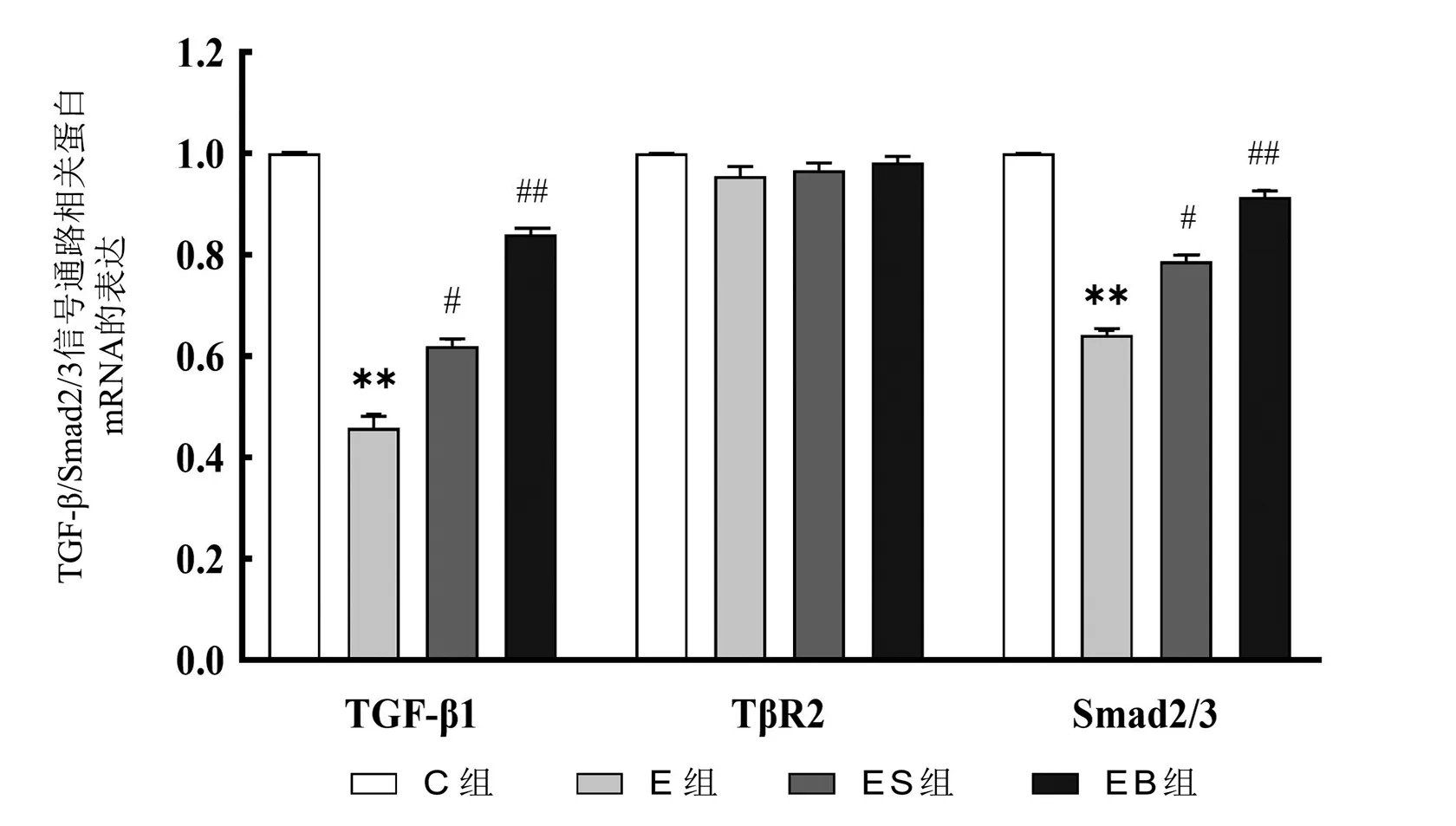
图5 各组大鼠脾脏组织中TGF-β1、TβR2、Smad2/3的mRNA相对表达量图
2.5 各组大鼠脾脏组织中TGF-β1、TβR2、Smad2/3蛋白表达的变化
如图6所示,与C组相比E组TGF-1蛋白表达显著升高(<0.01)、Smad2/3蛋白表达显著降低(<0.01);与E组相比,ES组TGF-1蛋白表达下降(<0.05)、Smad2/3蛋白表达升高(<0.05)、EB组TGF-1蛋白表达下降(<0.01)、Smad2/3蛋白表达显著升高(<0.01),且组间存在剂量关系;TR2在各组之间没有统计学差异性(>0.05)。说明刺梨多糖可介导TGF-1/Smad2/3信号通路上部分转录因子蛋白的表达。
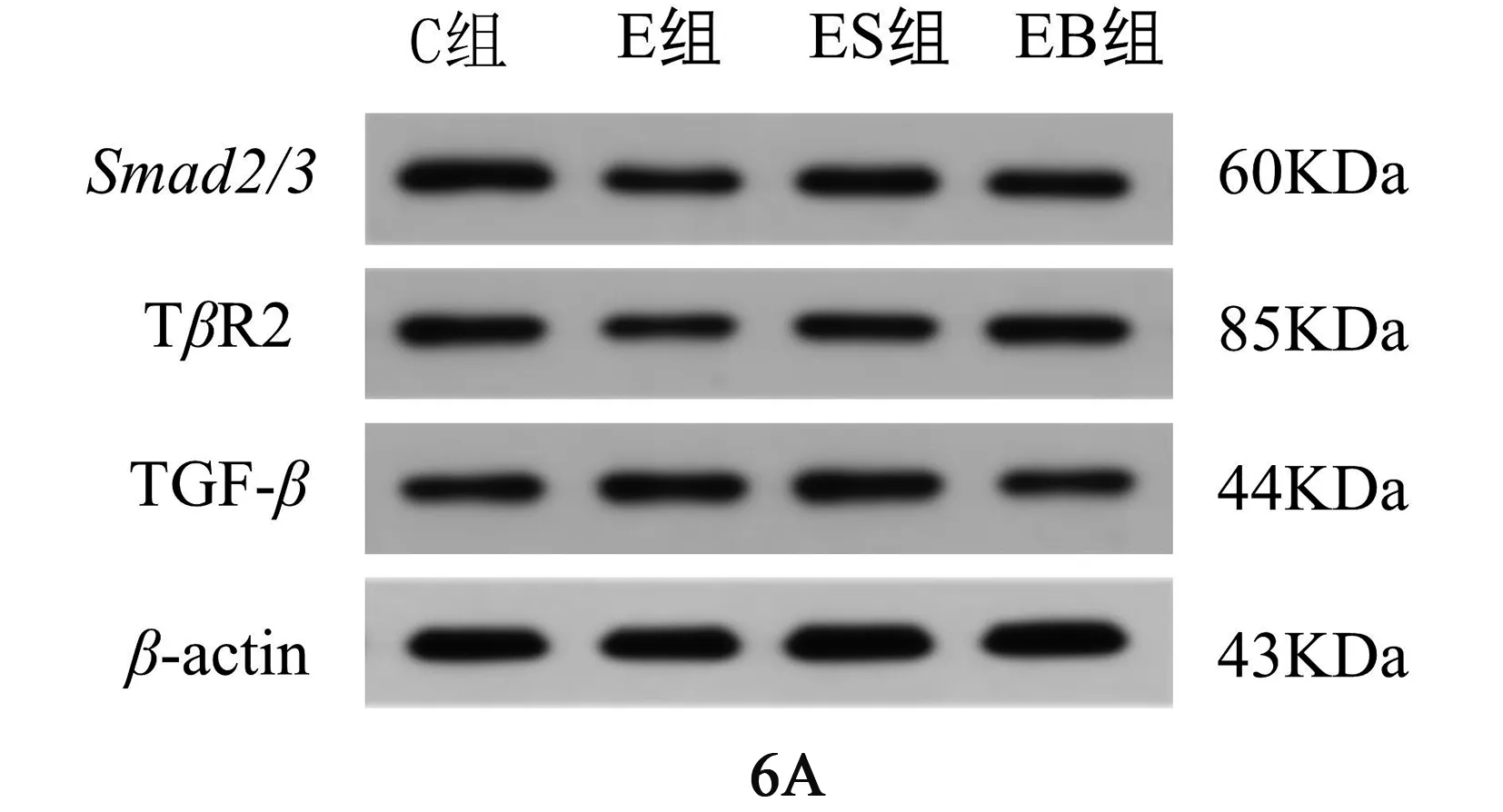
图6 各组大鼠脾脏组织中TGF-β1、TβR2、Smad2/3蛋白表达图
3 讨 论
3.1 刺梨多糖对运动性免疫抑制大鼠体质量、sIgA和脾脏组织结构形态变化的影响
大量研究已证实长期大强度运动能引起机体出现免疫抑制,即身体机能、免疫功能低下,T淋巴细胞亚群稳态失衡,分泌型免疫球蛋白(sIgA)减少,患上呼吸道感染的几率增加。长期大强度的运动,除引起能量和能源物质的大量消耗外,还可造成中枢神经的过应激等,进而引发过度疲劳或过度训练,触发机体免疫功能的下降。徐玉娥研究显示,长期大强度运动产生大量活性氧,在运动中或运动后相当长一段时间内过度攻击细胞膜,引起免疫细胞结构损伤,导致免疫功能降低。本研究结果显示,长期大强度运动后,E组体质量明显下降、活动能力降低、鼻腔分泌液中sIgA水平下降,这与已有的运动性免疫抑制大鼠研究模型表现相一致,说明运动免疫抑制大鼠造模成功。刺梨多糖干预大鼠EIS 症状在试验中后期表现出逐渐下降,说明PRR在缓解运动性免疫抑制发生中具有积极的作用,其作用可能与PRR作为构成生物体重要的基础能源物质有关,在能量和能源物质过消耗的状况下,PRR能够提供更多的能量,减缓运动对机体的过应激反应,从而预防或减缓EIS的发生。
3.2 刺梨多糖对运动性免疫抑制大鼠T淋巴细胞亚群CD4+、CD8+以及细胞因子INF-γ、IL-4的影响
T淋巴细胞(CD)在免疫平衡、稳定中发挥着重要作用。T淋巴细胞分为辅助/诱导T淋巴细胞(CD或Th)和抑制/细胞毒T淋巴细胞(CD或Tc)等。正常生理状况下,机体免疫功能的稳定有赖于淋巴细胞亚群维持一定的比例,即CD/CD比值的稳态。Th进一步分化为Th1和Th2,研究指出,Th1/Th2失衡可影响到整个免疫系统。INF-和IL-4被认为是Th1和Th2细胞的特征性因子,通常以INF-/IL-4比值变化反映Th1/Th2漂移。GRABS研究指出,长期大强度运动可造成细胞损伤或运动器官损伤,进而引发炎症反应;胡柏平等研究表明,长期大强度运动可引起CD、CD数量的变化,引起T淋巴细胞亚群失衡;方子龙等研究表明,长时间大或中强度运动可导致血糖和谷氨酰胺水平显著下降,影响淋巴细胞、巨噬细胞等细胞的能源供应,导致免疫细胞生成的减少;王茹等研究指出,长期大强度运动可引起淋巴细胞释放的细胞因子失衡,导致免疫机能下降。本研究结果显示,E组外周血INF-、IL-4水平升高,CD、CD、CD/CD、INF-/IL-4下降,以及脾脏组织微结构病理变化明显,说明长期大强度运动中或运动后触发过氧化应激,导致自由基的大量产生,自由基攻击细胞膜,造成细胞、组织损伤,从而引发炎症,炎症触发T淋巴细胞介导的细胞免疫、体液免疫以及特异性免疫等功能下降。这与已有的炎症是免疫系统激活的开关等研究具有一致性。刺梨多糖干预大鼠外周血免疫指标INF-、IL-4下降,CD、CD、CD/CD、INF-/IL-4升高,以及脾脏组织微结构病理变化不明显,且EB组与C组效果比较接近,说明PRR在减轻炎症和提升免疫能力方面具有一定的作用。其原因可能与PRR的抗氧化有关,通过降低氧化应激,减轻炎症症状,调控体内固有免疫系统,产生抗原递呈、活化淋巴细胞、实现免疫应答、维持免疫稳定。
3.3 刺梨多糖对运动性免疫抑制大鼠TGF-β1、TβR2、Smad2/3 蛋白表达的影响
TGF-1/Smad2/3信号通路是蛋白激酶偶联受体介导的细胞信号转导通路,对T细胞的增殖、分化起着重要的调控作用。TGF-1与其下游受体TR结合后,通过Smads蛋白将胞外的信号转导到核内,介导基因的转录和蛋白的表达调控早期T细胞的发育以及成熟T细胞的增殖分化等。研究表明,TGF-1是一种有效的免疫抑制剂,通过负调控T淋巴细胞的增殖、分化和激活,发挥免疫调节功能。大量研究证实长期大强度运动能够改变TGF-1/Smad2/3信号通路相关蛋白的表达,影响TGF-1/Smad2/3细胞信号的转导。孙培江等指出,长期大强度运动可上调大鼠外周血TGF-1水平,降低Smads水平,引起免疫低下;姚俊等研究表明,过度运动能够导致大鼠肾组织TGF-1水平升高,TR水平下降,引起肾小球滤过功能下降。林森等研究表明,大强度运动可升高糖尿病大鼠肾脏TGF-1的含量,提升炎症水平。大量研究证实,炎症是TGF-1/Smad2/3信号通路激活的重要因素且呈现正相关性。本研究结果显示,E组脾脏组织TGF-1蛋白表达明显升高,Smad2/3蛋白表达显著下降,说明长期大强度运动可引起TGF-1/Smad2/3信号通路相关蛋白表达的变化,这与上述的研究具有一致性。其原因可能是长期大强度运动,机体长期承受过应激,导致炎症加重,触发TGF-1/Smad2/3信号通路引起TGF-1、TR、Smad2/3基因和蛋白表达的变化。刺梨多糖干预大鼠脾脏组织TGF-1水平明显下降,Smad2/3水平显著升高,且效果与C组比较接近。说明PRR可介导TGF-1/Smad2/3信号通路调控部分基因的转录和蛋白表达,发挥细胞信号转导作用。这与孟力力、李承德、金智生等研究植物多糖对TGF-1/Smad2/3信号通路影响具有一致性。其原因可能与PRR及其缀合物在机体内参与细胞识别、代谢调控和免疫保护等多种活动中,具有多环节和多靶点的作用特征,能激发或诱发机体固有的细胞信号通路,发挥时效和量效的整体、双向、自限等调节,提升机体免疫功能。
3.4 刺梨多糖缓解运动性免疫抑制发生、发展的机制
生命科学的发展,细胞信号传递分子途径极大地深化了人们对生命信息流或细胞通讯的认识,PRR介导TGF-1/Smad2/3信号通路缓解运动性免疫抑制发生、发展的可能机制为:PRR可通过抗氧化和参与细胞识别、代谢调控等作用,引起机体神经-内分泌-免疫系统的改变,促使细胞因子的产生、分泌,细胞因子与细胞膜上相应的受体结合,能够引起胞膜上TGF-1二聚体配体与膜上没有活性的TR1型受体结合形成复合物,复合物激活TR2型受体,活化的TR2型受体募集并结合TR1形成TR1-TR2型受体异源二聚体,且同时激活TR1型受体胞内结构域中的Gs区,TR1型受体活化,活化的TR1发生磷酸化,与Smad2/3受体上富含丝氨酸/苏氨酸的linlcer区结合,使Smad2/3的羧基端磷酸化,磷酸化的Smad2/3分子在胞质内与通用型Smad4结合成复合体Smads。Smads既是信号转导分子,又是转录因子,由MH1和MH2结构域和链接它们的铰链区组成,MH1结构域有结合DNA的位点,MH2结构域有与其它转录因子相互作用的位点。Smads转运入核内,激活T淋巴细胞分化为Th(CD)和Tc(CD)细胞,调控T淋巴细胞下游靶基因的表达,活化Th(CD)分化为Th1和Th2细胞,促进Th1、Th2细胞分泌IFN-、IL-2、IL-4、IL-10等细胞因子;还可通过TGF-1/Smad2/3信号通路的交叉调控(cross-talking)——磷脂酰肌醇代谢途径形成信号转导网络,活化丝氨酸/苏氨酸特异的蛋白激酶C,影响T淋巴细胞的增殖分化,从而缓解运动性免疫抑制的发生发展。
4 结 论
综上所述,刺梨多糖能够影响运动性免疫抑制指标的变化,可调节TGF-1/Smad2/3信号通路上因子TGF-1和Smad2/3蛋白的表达,发挥免疫调节和免疫稳定作用,缓解运动性免疫抑制的发生、发展,对提升运动员体质健康和运动成绩具有现实意义,同时可促进刺梨功能性饮料的进一步开发。
