厚游仆虫(Euplotes crassus)对有毒赤潮藻的清除效应研究
2022-07-27闫昊林玉雲王路
闫昊, 林玉雲, 王路
厚游仆虫()对有毒赤潮藻的清除效应研究
闫昊, 林玉雲, 王路*
闽江学院地理与海洋学院, 福州 350108
原生动物是水生食物网中主要的植食性生物, 在自然水体中能够有效控制浮游植物的生物量, 具有预防及延缓赤潮发生的潜在应用价值。在福建沿岸分离筛选出一种常见的原生动物—厚游仆虫(), 通过研究其对三种常见有毒赤潮藻类的毒素耐受性、抑藻率及自身在赤潮压力下的生长速率, 评测厚游仆虫对常见有毒赤潮藻类的抑制作用, 挖掘其作为控藻生物的应用潜力。将厚游仆虫分别接种于不同浓度的剧毒卡尔藻()、赤潮异弯藻()及米氏凯伦藻()中, 在温度20 ℃、光照度100 μmol·M–2·s–1和光暗比12 h: 12 h 的条件下进行共培养。结果显示, 厚游仆虫对剧毒卡尔藻和赤潮异弯藻具有明显的抑制作用, 持续抑藻时间可达72 h以上, 且未见藻细胞数量的明显反弹, 而对于米氏凯伦藻则没有明显的抑制能力。说明厚游仆虫在一定条件下可作为一种有效可行的控藻生物, 但其对赤潮藻类的抑制作用具有一定的种类特异性。结果证明, 在赤潮形成初期厚游仆虫对赤潮藻类的摄食压力可能有助于抑制或延缓剧毒卡尔藻及赤潮异弯藻赤潮的发生与发展, 其在赤潮治理中的实际应用还需结合野外水体做进一步研究。
原生动物; 厚游仆虫; 有害赤潮; 摄食; 抑制
0 前言
赤潮是一种严重的全球性海洋自然灾害,已经引起世界各地的高度关注。近年来, 我国近海海域污染加剧, 局部海域富营养化问题突出, 赤潮爆发日益频繁, 给近岸水域带来了严重的生态、资源和环境问题, 并造成巨大的经济损失, 是滨海生态安全和沿海经济可持续发展的重大威胁。福建省由于其特殊的环境与气候特征一直是全国赤潮灾害多发省份之一[1], 其省会福州市更是赤潮灾害高发区, 2011—2016年赤潮灾害发生数累计达11起, 高居全省首位[2]。2019年5月下旬, 福建平潭养殖区爆发了以卡尔藻(sp)为优势种的有毒有害赤潮, 密度约106个·L–1,并伴有东海原甲藻()、赤潮异弯藻()、米氏凯伦藻()、斯克里普藻(sp.)、血红哈卡()等其他赤潮种类, 最大影响面积约3.5平方公里, 引发养殖区及周边海域真鲷、花尾胡椒鲷等养殖鱼类大量死亡, 造成极大经济损失[3]。因此, 对赤潮藻类以及新型赤潮调控方法的研究在赤潮预警及治理等方面具有重要意义。
随着世界沿海范围内赤潮问题的日益严峻, 如何治理赤潮, 降低其对海洋环境、水产养殖业及人类健康的危害, 已成为人们普遍关注的一个大问题[2]。当前对于赤潮治理的方法主要分为物理法、化学法及生物法[4], 物理及化学方法无法从根本上治理赤潮, 且极有可能对其他生物造成负面影响, 对海洋环境也存在破坏作用[5]。在利用物理、化学方法不甚理想的情况下, 越来越多的研究者将目光投向了生物防治技术。生物法被认为是一种最有发展前途且对环境无二次污染的方法, 也是目前研究最为热门的一种赤潮治理方法[6]。浮游动物对浮游植物的摄食是引起浮游植物生物量减少的主要原因之一[7-8], 自然水体中微型浮游动物相对于大型浮游动物的生物量更高, 且极高的生长速率伴随着其对浮游植物的高消耗[9]。以往研究显示, 赤潮期间原生动物能够通过摄食来有效地控制赤潮藻类的生物量, 并保持最优的生长与繁殖速率[10-12]。例如, 某些纤毛虫对不同赤潮藻类具有较强的摄食能力, 包括抑食金球藻()、亚历山大藻(sp.)、微小原甲藻()等[13-15]。因此, 在自然海区中原生动物的存在能够有效控制或延缓赤潮的发生[16],被认为是一种很有实用前景的控藻因子[17]。
本研究在福建沿岸分离了不同种类的原生动物, 并筛选得到具有一定抑藻能力的原生动物—厚游仆虫(), 研究其对不同有毒赤潮藻—剧毒卡尔藻()、赤潮异弯藻()和米氏凯伦藻()的毒素耐受性与摄食情况, 并比较不同藻细胞浓度下厚游仆虫的生长速率和抑藻率, 旨在厘清厚游仆虫对常见有毒赤潮藻类的抑制作用, 挖掘其作为控藻生物的应用潜力。
1 实验材料与方法
1.1 藻类培养
实验采用的藻类为常见有毒赤潮藻—剧毒卡尔藻()、赤潮异弯藻()和米氏凯伦藻(), 藻种由厦门大学海洋藻类保种中心提供。上述三种藻类均培养于人工海水中, 人工海水由红海盐(Red Sea, Israeli)和纯水配制而成, 盐度调至30 ppt, 经高压灭菌后添加L1培养液培养, 培养温度为20 ℃, 光照强度为100μmol·m–2·s–1, 光暗比12 h:12 h。
1.2 抑藻原生动物的筛选、鉴定与培养
在福建沿岸的福州、厦门、连江及平潭等地采集表层海水, 将海水中形态不同的单个原生动物个体放入24孔板中, 孔板中提前放入过滤后的灭菌海水及灭菌的大米或虾饲料, 于20 ℃培养箱扩大培养后命名为不同的株系, 并进行分子鉴定以确定其物种。将培养后的不同种类原生动物放入剧毒卡尔藻液中进行20℃共培养, 3—4天后选取数量明显增多的原生动物种类。将选取的抑藻效果最佳的原生动物进行纯培养, 喂食一定大米或虾饲料, 培养温度为20 ℃, 光暗比12 h:12 h。
显微镜下挑取抑藻效果最佳的原生动物, 使用CTAB法进行DNA的提取与PCR扩增, 扩增产物为核糖体小亚基(SSU)全长片段。利用基因数据库(NCBI GenBank)提供的BLAST分析, 将测序结果进行序列比对, 得到与已知rDNA相似性最高的基因序列编号为LT628500, 该序列对应的物种名称为厚游仆虫(), 序列相似度为99.94%。
1.3 荧光显微镜观察
赤潮甲藻细胞内含有大量叶绿素, 在紫外光激发下可以发射出红色荧光, 藻细胞被吞食进入食物泡后, 仍可以发出荧光。根据食物泡的大小和荧光强弱可以研究藻细胞物质在原生动物体内的消化情况。厚游仆虫与不同种类的赤潮藻共培养24—48 h后, 将厚游仆虫用甲醛固定, 固定后甲醛终浓度为2%, 在荧光显微镜(ZEISS Axioscope 5)下进行拍照记录。
1.4 生长与摄食实验
将处于指数生长期的厚游仆虫移至装有无菌海水的培养皿中进行饥饿处理。24 h后在显微镜下置于24孔板中备用, 每孔放10只。将处于指数生长期的剧毒卡尔藻、赤潮异弯藻的初始浓度分别调至5000 个·mL–1、10000 个·mL–1、15000 个·mL–1, 米氏凯伦藻液初始浓度调至2000 个·mL–1、5000 个·mL–1、10000个·mL–1, 并将调整后不同浓度的剧毒卡尔藻、赤潮异弯藻和米氏凯伦藻液转移至24孔培养板中, 与厚游仆虫共培养, 每种浓度的处理组包含18个生物学重复, 另设仅含藻液和仅含厚游仆虫的空白对照。将24孔板置于20 ℃光照培养箱中, 光照强度100μmol·m–2·s–1, 光暗周期12 h:12 h的条件下孵育72 h。每隔12 h在显微镜下对不同处理组的原生动物进行活体计数, 并取不同处理组的三个生物学重复进行藻细胞的固定与计数, 藻细胞计数后的生物学重复样品废弃。
2 结果与分析
2.1 厚游仆虫对不同浓度剧毒卡尔藻的毒素耐受性
将浓度为5000 个·mL–1、10000 个·mL–1、15000 个·mL–1的剧毒卡尔藻, 分别与相同数量的厚游仆虫(10 个·孔–1)进行共培养。设置空白对照, 对照组为相同数量的游仆虫以及不含有藻液的灭菌人工海水。在12 h、24 h、36 h、48 h、60 h、72 h进行显微镜观察, 对不同处理组中的生物学重复样品进行原生动物及藻细胞计数。其结果见图1和图2。从图1可知, 剧毒卡尔藻密度为5000 个·mL–1、10000 个·mL–1、15000 个·mL–1时, 厚游仆虫个体数均明显增加, 由原来的10 个·well–1长至约120 个·well–1, 增长倍数达10—12倍。说明厚游仆虫对剧毒卡尔藻的毒素耐受性强, 当卡尔藻密度高达15000 个·mL–1时, 厚游仆虫的个体数依然增加明显。此外, 在不含有藻液的空白对照组中, 厚游仆虫仍少量增加, 可能由于实验过程中无法完全去除和隔离细菌, 使得残余在水体中的微量细菌逐渐增多并成为厚游仆虫的食物。
从图2可知, 厚游仆虫从24 h处开始出现明显增长, 且在藻浓度10000 个·mL–1的条件下, 厚游仆虫增长率最明显。说明厚游仆虫对剧毒卡尔藻的毒素耐受性强, 当卡尔藻密度高达10000 个·mL–1时, 在共培养48 h后, 厚游仆虫的个体数依然增加明显。培养时间高达72 h时, 厚游仆虫在不同藻浓度下的个体数依然增加明显, 而生长速率略微下降。
2.2 厚游仆虫对不同浓度剧毒卡尔藻的抑制率
将浓度为5000 个·mL–1(图3a)、10000 个·mL–1(图3b)、15000 个·mL–1(图3c)的剧毒卡尔藻, 分别与相同数量的厚游仆虫(10 个·孔–1)进行共培养, 培养条件同上。在12 h、24 h、36 h、48 h、60 h、72 h的不同时间段, 进行藻细胞计数, 并进一步计算藻细胞损失率, 其结果见图3和图4。从图3可以看出, 与厚游仆虫共培养后的藻细胞密度与对照组相比, 均出现了不同程度地降低。图4显示, 12h开始厚游仆虫对不同浓度的藻细胞出现了明显的抑制作用, 但抑制程度各不相同。在48 h之前, 厚游仆虫对10000 个·mL–1浓度下的抑制效果较显著; 在48 h之后, 厚游仆虫对5000 个·mL–1浓度下的抑制效果较显著。
2.3 厚游仆虫体内被摄食的剧毒卡尔藻的自发荧光信号
将厚游仆虫与剧毒卡尔藻以1:1500、1:3000、1:4500细胞个数比共培养, 20 ℃恒温培养12—24 h后, 使用甲醛溶液对厚游仆虫进行固定。使用荧光显微镜观察厚游仆虫体内的自发荧光, 荧光通道为PE通道。1:1500细胞个数比的结果见图5, 分别显示存在藻液(a和b)和不存在藻液(c和d)情况下, 厚游仆虫体内的藻类自发荧光情况。

图1 不同剧毒卡尔藻浓度下厚游仆虫的数量变化
Figure 1 Changes in cell number ofunder different concentration of

图2 不同剧毒卡尔藻浓度下厚游仆虫的增长率
Figure 2 The growth rate ofincubated withat different concentrations
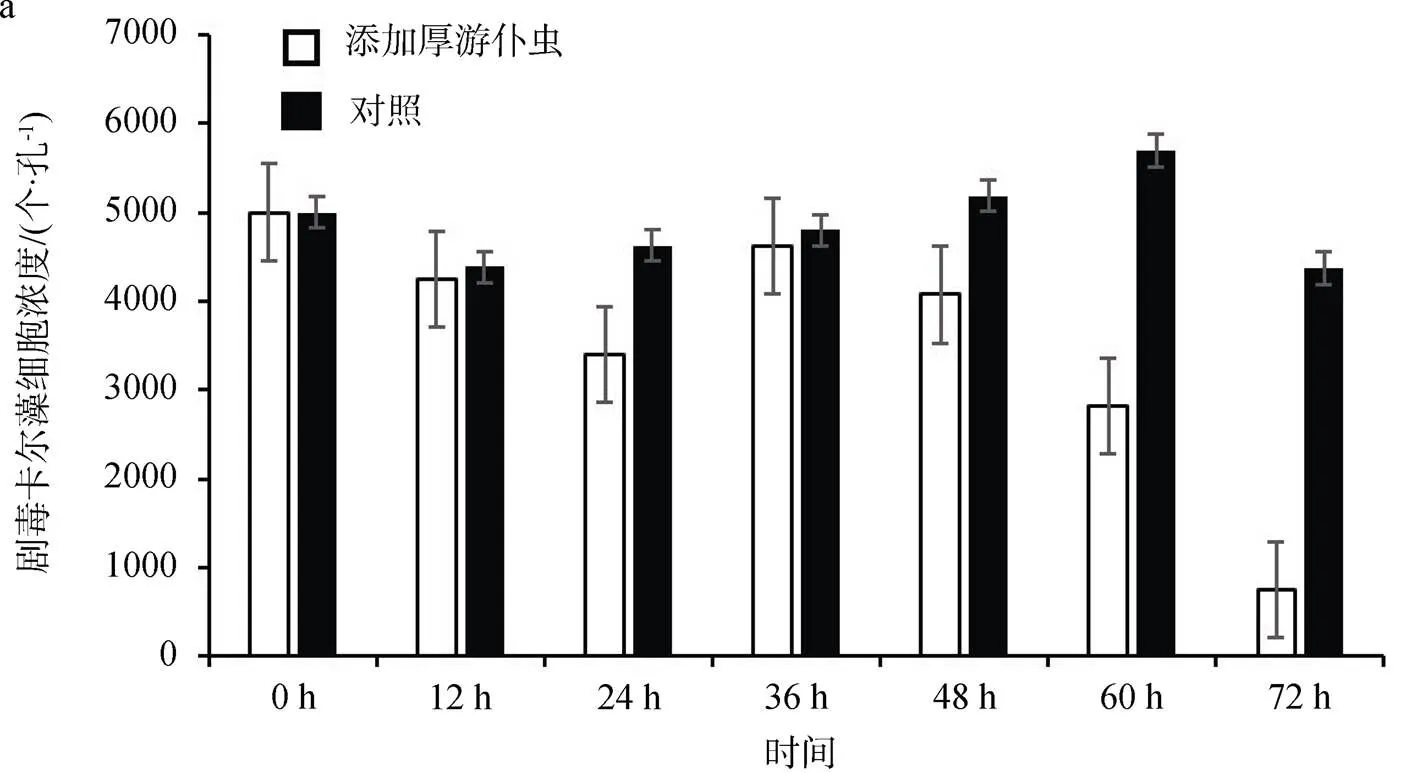
Figure 3 The effect ofonat different concentrations

图4 厚游仆虫对不同浓度剧毒卡尔藻的抑制率
Figure 4 The inhibition rate ofonat different concentrations.
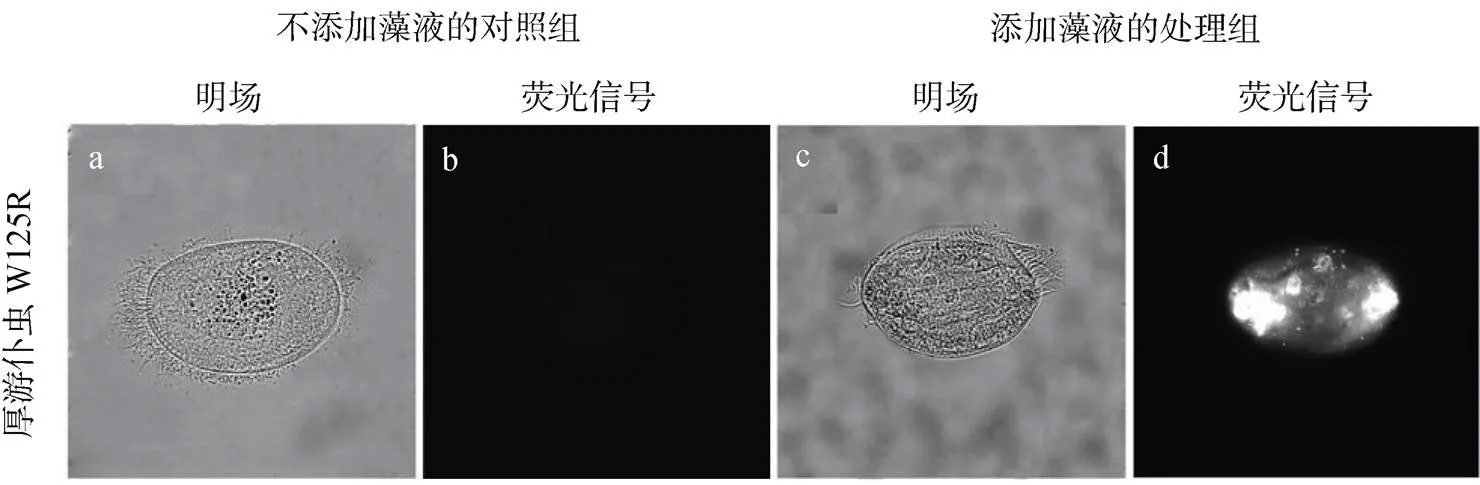
图5 厚游仆虫对剧毒卡尔藻的摄食
Figure 5 Ingestion ofby
由图5可知, 置于人工海水中的厚游仆虫体内, 未显示藻类自发荧光信号(图5b), 而置于藻液中的厚游仆虫体内, 显示较强的藻类自发荧光信号(图5d), 说明厚游仆虫能够摄食剧毒卡尔藻并进行消化。
2.4 厚游仆虫对其他常见赤潮藻的抑制作用
将厚游仆虫(10 个·孔–1)分别接种于对数生长期的赤潮异弯藻液(3 mL)中, 藻浓度分别为5000 个·mL–1、10000 个·mL–1、15000 个·mL–1, 在12 h、24 h、36 h、48 h、60 h、72 h的不同时间段, 对厚游仆虫进行活体计数。结果如图6所示, 不同赤潮异弯藻浓度下, 厚游仆虫个体数与对照组相比均出现了明显增加。由此可见, 厚游仆虫对另一种常见赤潮藻--赤潮异弯藻具有一定的抑制作用。
将厚游仆虫(10 个·孔–1)分别接种于对数生长期的米氏凯伦藻藻液中, 藻浓度分别为2000 个·mL–1、5000 个·mL–1、10000 个·mL–1, 在不同时间段对厚游仆虫进行细胞计数。结果如图7所示, 不同米氏凯伦藻浓度下, 厚游仆虫个体数与对照组相比均明显减少。由此可见, 厚游仆虫对有毒赤潮藻—米氏凯伦藻无明显的抑制作用。
3 讨论
在研究自然水体原生动物的食藻过程中, 有很多关于原生动物大量繁殖导致赤潮消退的报道[18-19], 但人为利用原生动物成功控制赤潮的研究大都处在尝试阶段[20-21]。本文对分离获得的原生动物—厚游仆虫进行了一系列的控藻实验。结果发现, 厚游仆虫具有较强的毒素耐受性, 在实验室条件下能够摄食剧毒卡尔藻和赤潮异弯藻, 对这两种藻类均具有明显的抑制作用, 而对于米氏凯伦藻则没有抑制能力。说明厚游仆虫对赤潮藻类的抑制作用具有一定的种类特异性, 可能由于不同藻种的毒性、适口性、营养含量有所差异, 捕食者对不同藻类的滤食率也参差不齐[22]。但此种特异性在赤潮期间可能会改变藻类的种群结构及群落的演替方向[23]。

图6 不同赤潮异湾藻浓度下厚游仆虫的数量变化
Figure 6 Changes in cell number of, incubated withat different concentrations

图7 不同米氏凯伦藻浓度下厚游仆虫的数量变化
Figure 7 Changes in cell number of, incubated withat different concentrations
本研究中的厚游仆虫具有生长速率快、适应性强、捕食量大等特点, 在短时间内可以大量摄取不同的赤潮藻类, 说明其具有预防及控制赤潮发生的潜在应用价值, 可能成为一种新型高效环保的控藻生物。然而, 尽管浮游动物摄食在赤潮生消过程中起相当重要的作用, 但环境水体的多变性、摄食过程的复杂性和生物物种与个体行为存在的多样性, 使得这一赤潮调控方法在野外环境中的应用具有相当难度[16]。例如, 天然水体环境和实验室培养条件之间的差异, 使得原生动物的数量相对藻类生物量无法达到一定优势, 会严重影响实际的控藻效果[24], 此外, 野外环境水体中常伴随混合种赤潮或种群演替现象, 针对于某种赤潮藻类的调控方法无法抑制赤潮期的总生物量。因此, 若投入实际应用还需结合野外水体做进一步研究, 不仅要通过筛选、训化与改造来提高原生动物的摄食、消化和生长速率, 还要考虑投放时间、投放量等问题。综上所述, 利用原生动物控制赤潮是一种全新的思路, 但目前有很多实际应用问题亟待进一步解决。
[1] 李雪丁. 福建沿海近10a赤潮基本特征分析[J]. 环境科学, 2012, 33(7): 2210–2216.
[2] 谢欣, 陶爱峰, 张尧, 等.福建省典型海洋灾害时空分布特性研究[J]. 海洋湖沼通报, 2018, (4): 21–30.
[3] 福建省海洋与渔业局. 福建省赤潮灾害信息(2019年第023期)[EB/OL]. 2019-05-29. http://hyyyj.fujian.gov.cn/ xxgk/tzgg/201905/t20190529_4888810.htm.
[4] GALLARDORODRIGUEZ J J, ASTUYAVILLALON A, LLANOSRIVERA A, et al. A critical review on control methods for harmful algal blooms[J]. Reviews in Aquaculture, 2019, 11(3): 661–684.
[5] 孙晓霞, 张波, 俞志明. 赤潮防治剂对中国对虾的毒性研究[J]. 海洋环境科学, 2000, 19(4): 6–8.
[6] 伍嘉慧. 深圳海域赤潮水样溶藻菌的分离鉴定及Arenibacter sp.6A1溶藻活性物质的研究[D]. 深圳大学, 2018.
[7] MCMANUS G B, EDERINGTONCANTRELL M C. Phytoplankton pigments and growth rates, and microzooplankton grazing in a large temperate estuary[J]. Marine Ecology Progress Series, 1992, 87(1): 77–85.
[8] BRETELER W C, SCHOGT N, BAAS M, et al. Trophic upgrading of food quality by protozoans enhancing copepod growth: role of essential lipids[J]. Marine Biology, 1999, 135(1): 191–198.
[9] STROM S L, MORELLO T A. Comparative growth rates and yields of ciliates and heterotrophic dinoflagellates[J]. Journal of Plankton Research, 1998, 20(3): 571–584.
[10] JEONG H J, LATZ M I. Growth and grazing rates of the heterotrophic dinoflagellatesspp. on red tide dinoflagellates[J]. Marine Ecology Progress Series, 1994,106(1-2) : 173–185.
[11] KAMIYAMA T. Growth and grazing responses of tintinnid ciliates feeding on the toxic dinoflagellate[J]. Marine Biology, 1997, 128(3): 509–515.
[12] JEONG H J, SHIM J H, LEE C W, et al. Growth and Grazing Rates of the Marine Planktonic Ciliatesp. on Red-Tide and Toxic Dinoflagellates[J]. Journal of Eukaryotic Microbiology, 1999, 46(1): 69–76.
[13] 陈瑶, 杨茜露, 何学佳. 三种常见原生动物对褐潮藻种抑食金球藻()的摄食[J]. 热带海洋学报, 2018, 37(6): 120–132.
[14] COLIN S P, DAM H G. Latitudinal differentiation in the effects of the toxic dinoflagellatespp. on the feeding and reproduction of populations of the copepod Acartia hudsonica[J]. Harmful Algae, 2002, 1(1): 113–125.
[15] KAZMI S S U H,Xu Guangjian, Tang Xuexi, et al. Insights into identifying the effect of harmful algae on ecological quality status using periphytic ciliates in marine ecosystems[J]. Ecological Indicators, 2020, 117, doi:10.1016/j.ecolind.2020.106581.
[16] 孙军, 刘东艳, 王宗灵, 等. 浮游动物摄食在赤潮生消过程中的作用[J]. 生态学报, 2004, 24(7): 1514–1522.
[17] 黄姿, 朱白婢, 孙建波, 等. 赤潮的生物防治及其研究进展[J]. 安徽农学通报, 2008, 14(15): 82–84
[18] TURNER J T, ANDERSON D M. Zooplankton grazing during dinoflagellate blooms in a Cape Cod embayment with observations of predation upon tintinnids by copepods[J]. Marine Ecology,1983, 4(4): 359–374.
[19] CANTER H M, HEANEY S I, LUND J W, et al. The Ecological Significance of Grazing on Planktonic Populations of Cyanobacteria by the Ciliate Nassula[J]. New Phytologist, 1990,114(2): 247–263.
[20] 刘光涛. 铜绿微囊藻群体诱导研究[D]. 南京: 南京大学, 2012.
[21] 黄东旭, 张永康, 王洁炜. 噬藻原生动物的分离及噬藻性能的研究[J]. 辽宁化工, 2019, 48(7): 628–631.
[22] 姜小玉, 杨佩昀, 王洁玉, 等. 大型溞和金鱼藻对三种微藻增殖的影响[J]. 淡水渔业, 2018, 48(4): 106–112.
[23] 陈莉婷, 左俊, 陶思依, 等. 利用微生物控制蓝藻研究进展[J]. 武汉大学学报(理学版), 2019, 65(4): 401–410.
[24] 刘新尧, 石苗, 廖永红, 等. 食藻原生动物及其在治理蓝藻水华中的应用前景[J]. 水生生物学报, 2005(4): 456– 461.
The effect ofon the removal of toxic red tide algae
YAN Hao, LIN Yuyun, WANG Lu
Oceanography Institute of Minjiang University, Fuzhou350108, China
Protozoa are considered as major herbivores in marine food webs, which can effectively control the biomass of phytoplankton and have the potential application for controlling harmful algal blooms. A common protozoan,, was collected from the coast of Fujian province. The toxin tolerance, growth rate and the algal inhibition ofto three toxic harmful algae were studied. We evaluated the inhibitory effect ofon common harmful algae and explored its possibility as an algae control organism. In short-term experiments,was incubated with,andat different concentrations, under 25 ℃, illumination of 100 μmol·M–2·s–1and light dark ratio of 12 h:12 h. The results showed thathad a significant inhibitory effect onand. The duration of the growth inhibition could exceed 72 hours, and there was no significant recovery in the number of algae cells. However, its inhibitory effect onwas not obvious. The study results indicated thatcan be an effective algae suppressor under certain conditions, but its inhibitory effect on harmful algae showed species specificity. The feeding pressure of themay help to inhibit or delay the occurrence and development of harmful algae blooms, especially in the early stage ofandblooms. The practical application of red tide control by protozoa needs to be further studied in field water.
Protozoa;; Harmful algal blooms; grazing; suppression
10.14108/j.cnki.1008-8873.2022.04.011
P76
A
1008-8873(2022)04-084-08
2020-08-11;
2020-09-24
福建省中青年教师教育科研项目(JT180386); 中国大洋协会“深海生物资源计划”项目“深海大洋原生生物种质资源库构建及应用潜力评价”(DY135-B2-13);自然资源部东南生态脆弱区监测修复工程技术创新中心自主研究课题(KY-090000-04-2021-002)
闫昊(1999—), 男, 河南许昌人, 本科生在读, 主要从事环境资源多样性, E-mail: yanhao@stu.mju.edu.cn
通信作者:王路, 女, 博士, 副教授, 主要从事浮游植物分子生态学, E-mail: 607wanglu@mju.edu.cn
闫昊, 林玉雲, 王路. 厚游仆虫()对有毒赤潮藻的清除效应研究[J]. 生态科学, 2022, 41(4): 84–91.
YAN Hao, LIN Yuyun, WANG Lu. The effect ofon the removal of toxic red tide algae[J]. Ecological Science, 2022, 41(4): 84–91.
