水溶性聚苯胺的制备及其在肿瘤光热疗法中的应用
2022-07-27李国梁陈克正
李国梁,李 浩,王 玮,陈克正
(青岛科技大学 材料科学与工程学院,山东 青岛266042)
光热治疗(PTT)是在近红外激光照射下,通过光热治疗剂将光能转化为热能,达到一定温度后(一般为48 ℃以上)杀死肿瘤细胞,从而达到治疗肿瘤的目的。光热治疗剂是能够将光能转化为热能的物质,使肿瘤区域急剧升温,达到热消融的目的[1-2]。理想的光热治疗剂应该具备在近红外区有强烈吸收、良好的生物相容性、较高的光热转化效率等特点[3-4]。目前,研究者们已开发出多种光热治疗剂,如贵金属类的金纳米颗粒[5-7]、碳基材料类的碳纳米管[8-9]、半导体类的硫属铜基纳米颗粒[10-12]、有机光热材料[13]等。
另外,研究较多的有机光热治疗剂主要有聚吡咯等共轭高分子聚合物[13]、近红外染料类材料[14]、卟啉脂质体[15]等。然而,大部分的有机光热材料水溶性较差,需要通过聚乙二醇(PEG)等亲水性生物分子的修饰以此增强其在水环境中的分散性,这一过程可能会引入外在的潜在毒性[16-17]。基于以上考虑,本工作通过一种仿酶绿色合成工艺合成了水溶性聚苯胺(PANI)并探究其在肿瘤的光热治疗方面的应用。
1 实验部分
1.1 实验材料及仪器
双氧水,分析纯(30%),莱阳经济开发区精细化工厂;聚苯乙烯磺酸钠,分析纯,上海喜润化学工业有限公司;苯胺单体,分析纯(98%),阿法埃莎(中国)化学有限公司;聚乙烯吡咯烷酮,分析纯,上海埃彼化学试剂有限公司;无水乙醇,分析纯(>99.0%)莱阳经济开发区精细化工厂;氯化亚铁,分析纯,天津市博迪化工有限公司;乙二醇,分析纯,天津市瑞金特化学品有限公司;次亚磷酸钠,分析纯,上海埃比化学试剂有限公司;二甲亚砜(DMSO),分析纯,北京索莱宝科技有限公司;3-(4,5)-双甲基-2-噻唑-(2,5)-二苯基溴化四氮唑蓝,生化试剂,北京索莱宝科技有限公司;DMEM 培养基,生化试剂,赛默飞世尔科技(中国)有限公司;胎牛血清,生化试剂,赛默飞世尔科技(中国)有限公司;L-谷氨酰胺,生化试剂,北京索莱宝科技有限公司;青链霉素,生化试剂,北京索莱宝科技有限公司。
高压釜,50 m L 上海安谱科学仪器有限公司;动物血细胞分析仪,XFA6030型,中国普朗医疗有限公司;活细胞工作站,DMI6000B 型,德国Leica公司;傅里叶红外光谱仪(FTIR),VERTEX70 型,德国Bruker公司;紫外-可见-近红外分光光度计,Cary500型,美国Varian公司;红外功率可调激光发射器,T808D3W 型,西安铭辉广电科技有限公司;酶标仪,Model 680型,美国Bio Rad公司;荧光显微镜,Eclipse TE2000S型,日本Nikon公司。
实验涉及的细胞系:人肝癌细胞系Hep G2(实验室自有),小鼠胚胎成纤维细胞系NIH3T3(实验室自有)。
实验动物:Balb/c裸鼠(雌性,4~6周龄,20 g,北京维通利华实验动物技术有限公司,北京)。相关动物实验操作程序均是在有动物实验资质的实验室完成的,获得相关实验动物伦理委员会的批准。
1.2 磷酸铁模拟酶的制备
分别用电子天平准确称取5 g H2O、50 g乙二醇、1 g聚乙烯吡咯烷酮(PVP),将去离子水和乙二醇缓慢滴加到盛有PVP的洁净烧杯中,同时使用磁力搅拌器搅拌溶解;再准确称取1.689 g FeCl2·H2O和1.317 g的Na H2PO2·H2O 倒入上述搅拌好的溶液中,继续搅拌至溶解;然后将溶液转移到高压反应釜的聚四氟乙烯内衬中密封,置于恒温烘箱中在180 ℃下反应6 h;取出反应釜冷却;打开反应釜对产物进行离心收集并通过去离子水和乙醇洗涤,离心;然后将产物用乙醇分散,置于鼓风干燥箱中60℃干燥,即可得到磷酸铁模拟酶。
1.3 PANI的制备
准确称取0.124g聚苯乙烯磺酸钠(PSS)溶解于20 m L缓冲液,于冰水浴中搅拌30 min后,加入0.056 g苯胺单体,搅拌10 h后加入5 mg自制的磷酸铁模拟酶,再用移液枪准确移取0.6 m L 物质的量浓度为1 mol·L-1的双氧水溶液,在室温下反应24 h后,将反应液离心以去除磷酸铁模拟酶,上清液转移入截留相对分子质量为8 000~14 000的透析袋中,在p H=5的盐酸溶液中透析24 h,更换透析液后再次透析24 h,将透析袋内的溶液于40℃下真空干燥,获得产物PANI。
1.4 MTT法体外细胞相容性评价
MTT 法是一种检测细胞存活和生长的方法。其检测原理是活细胞线粒体内的琥珀酸脱氢酶可以将外源性的噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-Diphenyl-2-H-tetrazolium bromide,MTT)还原为水不溶性的蓝紫色甲臜并沉积在细胞中,而死细胞无此功能。二甲基亚砜(DMSO)能溶解细胞中的甲瓒,用酶联免疫检测仪在490 nm 波长处测定其光吸收值(OD 值),可间接反映活细胞数量。在一定细胞数范围内,MTT 结晶形成的量与细胞数成正比。
将材料与细胞共培养24 h,随后将培养板取出倒掉培养液,在培养板的所有孔上加入20μL 的5 mg·m L-1的噻唑蓝溶液;培养4 h后,倒掉噻唑蓝溶液,用酶标仪测定各孔在490 nm 处的OD 值;向每个孔中加入150μL DMSO,使用恒温振荡器低速振荡10 min,待结晶物质充分溶解后再测定各孔在490 nm 处的OD 值。以两次吸光度的差值作为细胞相对存活量,通过加入材料和未加材料的培养孔的吸光度之比确定各组的相对细胞存活率。
1.5 光热疗法体外效果评价
用细胞培养液(DMEM 培养基中含10%胎牛血清)在培养面积25 cm2的细胞培养瓶中培养Hep G2细胞。待细胞密度达到80%~90%时,将Hep G2细胞转移到96孔培养板上继续培养;将96孔培养板上分为相同的4 个区域,设置为control组,PANI-only组,PTT-only组,PANI-PTT 组。将灭菌后的PANI用新鲜的细胞培养液稀释为100 μg·m L-1,用含有PANI的培养液在37℃,5%CO2的细胞培养箱中与HepG2细胞共培养6 h;去除多余PANI,用磷酸盐缓冲液(PBS)润洗3次。其中PTT-only组和PANI-PTT 组细胞经808 nm 激光(2 W·cm-2)照射5 min;光照结束后,立即给4组加入MTT,进行细胞存活率测定。
VR自诞生以来,总被认为是一款实用性不高的“花瓶”。市面上较多较便宜的VR眼镜是需要借助手机的,将智能手机放入VR眼镜中,在手机中下载相应的APP(application)便可使用。由于手机被置入眼镜中使用者将无法操作手机,所以必须配备一个蓝牙手柄进行操作。市面上还有较贵的VR一体机使用较为方便。但目前的VR设备大都仍处于开发者版本,并不够成熟。
1.6 体内光热抑瘤实验
四周龄Balb/c雌性裸鼠,放入三级无特定病原体动物(SPF)房饲养。DMEM 培养基培养人肝癌细胞HepG2,细胞生长至对数生长期时,胰酶常规消化,离心收集细胞并对细胞进行计数。采用生理盐水溶解细胞团,并稀释细胞浓度至1×108个·m L-1。取200μL即2×107个细胞接种于每只裸鼠的前肢腋下,观察细胞接种后的生长状况。
待肿瘤大小接近200 mm3时,将裸鼠分为PBS对照组、PANI-only组、Laser-only组和PANI-PTT组,每组10只模型动物。隔天原位给药200μL(2 mg·m L-1),给药3次,隔日测量体重、肿瘤体积和死亡情况。
2 结果与讨论
2.1 PANI的成分分析
由图1可知:3 432 cm-1处的峰,是由-NH2非对称伸缩振动引起的;1 600 cm-1处的峰,是NQN伸缩振动引起的;1 496 cm-1处的峰,是苯环伸缩振动引起的;1 411 cm-1处的峰,是QBQ 结构中的C—N 伸缩振动引起的;1 006.29 cm-1和1 034 cm-1处的峰,分别是SO 对称振动和非对称振动引起的;831 cm-1处的峰,是1,4取代C—H面外弯曲振动引起的,同时说明产物中单体的连接方式为头-尾相连;670 cm-1处的峰,是由PSS 上的—SO3引起的。综上所述,实验中所用的磷酸铁模拟酶确实具有催化活性,催化合成的产物为聚苯胺和聚苯乙烯磺酸钠的复合物。
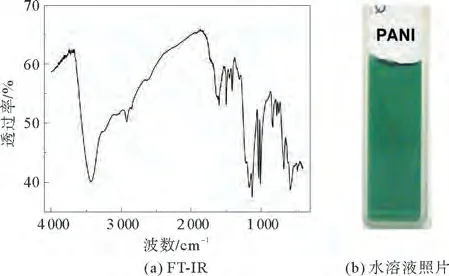
图1 所合成聚苯胺的FT-IR图谱和水溶液照片Fig.1 FT-IR spectrum of PANI and photo of PANI in water solution
在不添加稳定剂和表面修饰剂的前提下,当PANI在水溶液中的浓度高达150 mg·m L-1时,仍然能够在静置1周后保持澄清且无沉淀产生,由此说明其具有优异的水分散性和稳定性。
2.2 PANI的体外光热转换效率测试
为探讨PANI的光热转化能力,使用波长为808 nm 近红外激光对2 m L 不同浓度PANI溶液进行光热转换升温测试,结果见图2。如图2(a)所示,当激光功率为1.0 W 时,去离子水的温度仅升高0.3 ℃,而100~400μg·m L-1的PANI水溶液的温升在3.1~7.4 ℃范围内;当激光功率为1.5 W 时,去离子水的温度仅升高1.0 ℃,而100~400μg·m L-1的PANI水溶液的温升在8.2~18.3 ℃范围内;当激光功率为2.0 W 时,去离子水的温度仅升高1.0 ℃,而100~400μg·m L-1的PANI水溶液的温升在12.2~27.9 ℃范围内。测试结果表明,PANI水溶液在808 nm 激光照射下的升温幅度明显大于去离子水的升温幅度。当PANI水溶液浓度达到300μg·m L-1时,再升高PANI的浓度(400μg·m L-1),PANI升温已经不随浓度发生太大变化,说明PANI的升温已经达到饱和。
比较光热转换材料的光热转换能力,需要通过光热转换效率来比较,本研究利用公式式(1)~(5)对PANI的光热转换效率进行了测试和计算。其中,η为聚吡咯的光热转换效率,Tmax为聚吡咯溶液或水的最大温度,Tsurr为环境温度,A808为聚吡咯溶液在808 nm 处的吸光度,Qdis为环境所散发的热量,C为水的比热容,T为聚吡咯溶液或水在测温时的实时温度,m为溶液质量,t为时间,I为激光功率。
2 m L PANI水溶液在808 nm 激光照射下的升温降温曲线见图2(b),UV-Vis-NIR 的吸收光见图2(c)。可以算出PANI 的光热转换效率达到39.6%,具有良好的光热转换效率。
2.3 PANI的生物相容性评价
PANI的生物相容性评价结果如图3所示,PANI浓度在低于1μg·m L-1时,细胞存活率高于90%,在低于10μg·m L-1时,细胞相对存活率高于80%,当PANI质量浓度为100μg·m L-1时,两种细胞的相对存活率高于75%。从肿瘤细胞和正常细胞的比较来看,PANI对两种细胞的生长抑制没有显著性差异。
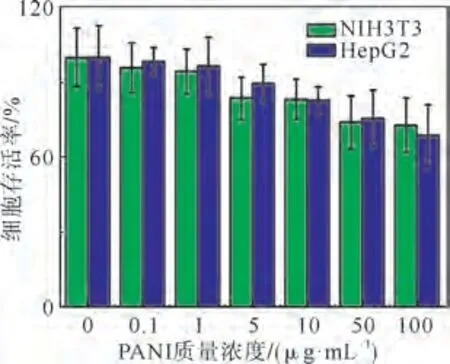
图3 聚苯胺对不同细胞的细胞毒性Fig.3 Cell viability of different kinds of cells after being incubated with various concentrations of PANI
2.4 定量评价PANI的光热细胞毒性
采用MTT 法评价PANI的光热细胞毒性,结果如图4所示。

图4 PANI的光热细胞毒性Fig.4 Photothermal cytotoxicity of PANI
与PANI共培养的细胞经照射后细胞存活率为40%,而未添加材料的细胞存活率近80%。尽管实验使用的PANI浓度只有100μg·m L-1,在激光照射(808 nm,2 W·cm-2)5 min后,能够非常有效地抑制肿瘤细胞的增殖。
2.5 PANI裸鼠肿瘤模型体内抑瘤效果评价
图5 为光热治疗后Balb/c裸鼠的体重监测。从图5可以发现,经过3周的治疗,各组模型小鼠的体重变化波动不明显,没有显著性的差异,说明相关实验没有对小鼠产生明显的刺激,其进食和代谢正常进行。

图5 光热治疗后Balb/c裸鼠的体重监测Fig.5 Body weight change of Balb/c mice after PTT
经常3周多的治疗,抑瘤曲线变化明显,如图6所示。PBS对照组的肿瘤呈现指数增长,3周后肿瘤相当于接种时肿瘤的36倍;PANI-only组和Laser-only组的肿瘤生长也非常迅速,最终的肿瘤大小接近初始肿瘤的32倍,并未抑制住肿瘤的生长。PANI-PTT 组的肿瘤生长较为缓慢,2周时肿瘤体积约为初始体积的4倍,而3周时的肿瘤体积约为初始体积的3.8倍。实验可以发现PANI介导的光热治疗能有效抑制肿瘤生长,体现出良好的光热治疗性能。

图6 肿瘤体积的生长曲线Fig.6 Curves of tumor volume growth
在进行一次完整的激光照射实验后,继续对模型小鼠的存活情况进行2周的记录,结果如图7所示。PBS对照组在第4 周时模型小鼠开始陆续死亡,在第35 d时全部死亡;PANI-only组和Laseronly组的模型小鼠也死亡较快,在第35 d的存活率分别为33%和15%,而PANI-PTT 组在第5周时存活率仍高达83%。以上体内治疗结果证明PANI能作为一种新型的光热治疗剂用于肿瘤的治疗。
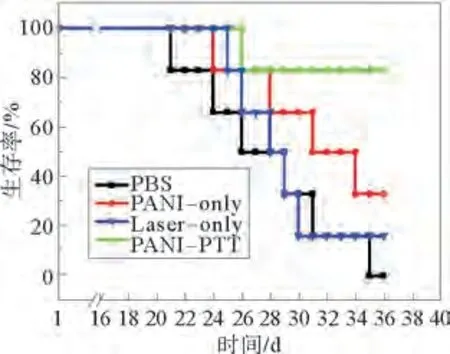
图7 Balb/c裸鼠生存率随时间变化曲线Fig.7 Survival curves of Balb/c nude mice
3 结 论
1)所合成的聚苯胺(PANI)具有良好的水溶性,当其在水溶液中的浓度高达150 mg·m L-1时,在静置1周后仍然保持澄清且无沉淀产生。
2)实验合成的PANI在近红外区域有较强吸收,能将光能高效的转化为热能,具有优秀的光热转换性能。实验结果显示,PANI的光热转换效率高达39.6%。
3)MTT 实验结果显示:PANI具有较低的生物毒性,证明PANI具有优秀的生物相容性。MTT实验和模型小鼠活体实验等体内外抑瘤实验结果均显示PANI具有良好的抑瘤效果,作为光热治疗剂能快速杀灭癌细胞和消融肿瘤,在2周内未见肿瘤复发,PANI-PTT 组的小鼠存活率为83%。
