吡唑醚菌酯的降解代谢及毒理研究进展
2022-07-26罗跃吴小毛胡贤锋姚小龙刘旭东韩磊
罗跃,吴小毛*,胡贤锋,姚小龙,刘旭东,韩磊
(1.贵州大学作物保护研究所,贵阳 550025;2.贵州省山地农业病虫害重点实验室,贵阳 550025)
吡唑醚菌酯(Pyraclostrobin)又名百克敏、唑菌胺酯等,是一种含吡唑结构的甲氧基丙烯酸酯(Strobi⁃lurins)类杀菌剂,为德国巴斯夫公司于1993 年研发,2002 年上市[1]。吡唑醚菌酯防治作物病害具有保护、治疗和内吸作用,兼具广谱、高效等特点,在全球60多个国家150 余种作物上登记使用,其自上市以来被迅速推广,2015年销售额超过10亿美元,是全球使用最广泛的杀菌剂之一[2-3]。吡唑醚菌酯是高效低毒的良好杀菌剂,但随着施用地区、人群、作用对象及用量的不断增加,其带来的毒害和污染问题愈发严重。
吡唑醚菌酯通过农业灌溉和地表径流扩散,在土壤及水生态系统中蓄积并造成严重污染,对环境和生物体的潜在危害较大[4-5]。SMALLING等[6]在加利福尼亚中部的圣玛丽亚河口检测到吡唑醚菌酯在三种沙蟹(箭齿鲽、鹿角杜父鱼、锯缘青蟹)体内的含量高于DDT、联苯菊酯、毒死蜱等农药;在奥克特河流域,吡唑醚菌酯在水样中的检出率为53%,在河床沉积物、鱼体、沙蟹中的检出率均为100%,沉积物样品中的平均含量为0.005 9 mg·kg-1,沙蟹中的平均含量约为鱼类的5 倍。OLIVEIRA 等[7]在巴西圣奥弗朗西斯科河的Prochilodus costatus鱼体中检测出吡唑醚菌酯及其主要代谢物。WIGHTWICK 等[8]在澳大利亚东南部一个园艺集水区的水与河床沉积物中均检出吡唑醚菌酯,其在沉积物中含量达0.001 mg·kg-1。本文对吡唑醚菌酯在环境中的分布及动态、降解代谢、毒理研究、残留分析及有关法规等方面进行综述,旨在为其毒性机理研究、污染修复治理、应用风险评估等提供借鉴,以引导科学合理施用,制定其在相关产品生产中的投放标准和残留限量标准,促进其对农业生产的良好效益,降低其对环境和人体的危害。
1 吡唑醚菌酯的理化性质及其应用
吡唑醚菌酯的化学名为N-[2-[[1-(4-氯苯基)吡唑-3-基]氧甲基]苯基]-N-甲氧基氨基甲酸甲酯(图1a),分子式C19H18N3O4Cl,分子量387.817,CAS 号175013-18-0。纯品为白色至浅米色无味结晶体,中等毒性,熔点63.7~65.2 ℃,沸点(501.1±60.0)℃,蒸气压(20~25 ℃)2.6×10-8Pa,密度(1.27±0.1)g·cm-3,溶于乙腈、甲醇、乙酸乙酯、丙酮等有机溶剂,不溶于水,纯品在水溶液中光解半衰期(t1/2)为0.06 d。其主要代谢产物为甲基-N-[[[1-(4-氯苯基)-吡唑-3-基]氧基]-邻甲苯基]-氨基甲酸酯(BF 500-3,图1b)。目前常见的吡唑醚菌酯商品化制剂有50%吡唑醚菌酯水分散粒剂(WG),250 g·L-1吡唑醚菌酯乳油(EC),40%吡唑醚菌酯悬浮剂(SC),其还可加工成悬乳剂(SE)、水剂(AS)和可湿性粉剂(WP)等。
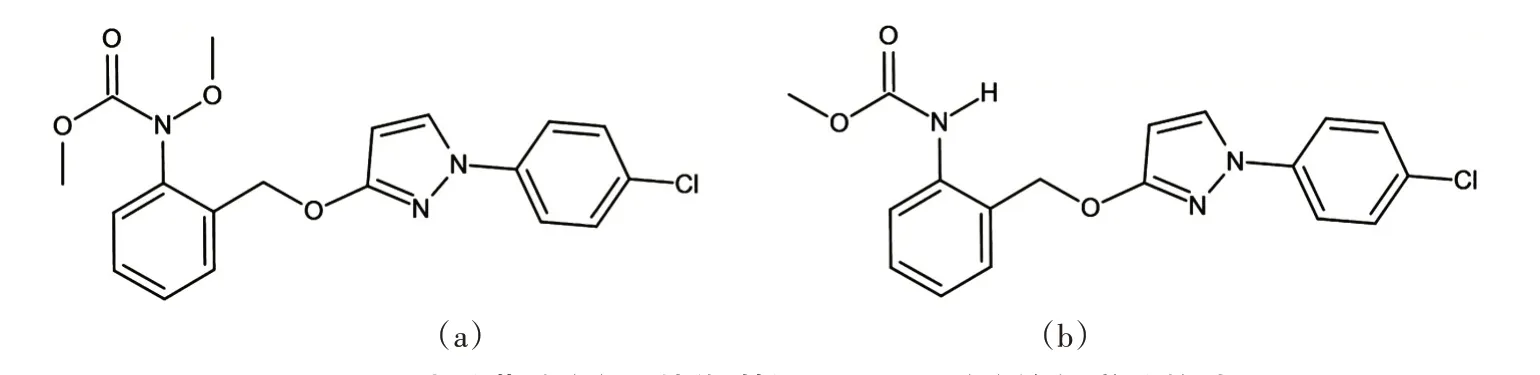
图1 吡唑醚菌酯(a)及其代谢物BF 500-3(b)的化学结构式Figure 1 The chemical structure of pyraclostrobin(a)and its metabolite BF 500-3(b)
吡唑醚菌酯主要通过抑制病原细胞线粒体呼吸作用中的细胞色素b和C1间电子传递,使线粒体不能正常提供细胞代谢所需能量,从而达到杀菌效果[9]。此外,吡唑醚菌酯还是一种激素型杀菌剂,具有诱导作物尤其是谷物生理变化的作用,如增强硝酸盐(硝化)还原酶的活性、提高对氮的吸收、降低乙烯的生物合成、延缓作物衰老,当作物受到病毒袭击时,它还能加速抵抗蛋白的形成,促进作物生长。LI等[10]的研究表明吡唑醚菌酯能刺激大豆植株根茎生长,提高叶绿素水平和根系活性,并降低丙二醛(MDA)水平;研究发现吡唑醚菌酯主要在大豆根部积累,根中吡唑醚菌酯的峰值水平和生物利用度分别是叶片的19.9 倍和33.2倍;吡唑醚菌酯还对根和叶中的类黄酮水平和苯丙氨酸氨解酶(PAL)活性具有促进作用,能起到增强大豆植株防御系统的作用。XIONG 等[11]发现经吡唑醚菌酯处理后,灰葡萄孢菌细胞膜渗透性增强,脂质过氧化膜的完整性被破坏,其菌落变畸形,菌丝膈膜变得模糊。
吡唑醚菌酯能防治由子囊纲、担子菌纲、半知菌类和卵菌纲等多种类型真菌病原引起的植物病害[12],被广泛用于果树、蔬菜及谷物的病害防治。我国当前登记使用吡唑醚菌酯的农作物有水稻、玉米、小麦等谷物,花生等油料作物,黄瓜、辣椒、马铃薯、大葱、蒜薹等蔬菜,西瓜、柑橘、苹果、葡萄、草莓、芒果、香蕉等水果,以及金银花、茶树等其他经济作物[13],诸多药效试验表明其综合防效较好[14-15]。吡唑醚菌酯还可与其他杀菌剂混用,不仅能产生协同灭杀效应、扩大杀菌谱,还能延缓抗药性的产生。如JIANG 等[16]报道喷施吡唑醚菌酯与波尔多液混合液可有效防控果蝇引起的苹果小球藻叶斑病;师勇强等[17]的研究表明40%噻虫嗪·吡唑醚菌酯·萎锈灵悬浮种衣剂高剂量处理对棉花立枯病的防治效果为86.3%~89.9%,极显著高于250 g·L-1吡唑醚菌酯EC。
2 吡唑醚菌酯的检测方法及残留限量标准
2.1 吡唑醚菌酯的检测方法
2.1.1 植物样品
目前已有多种检测方法被用于不同植物基质中的吡唑醚菌酯残留检测,其中应用色谱的检测技术较为普遍,如液相色谱-串联质谱法(LC-MS/MS)被用于柑橘、苹果、莴苣[18]以及葡萄[19]、番茄[20]、生菜[21]等样品检测。气相色谱配电子捕获检测器(GC-ECD)被用于草莓[22]、柑橘[23]、甘蓝及土壤[24]、黄瓜[25]等样品检测。超高效液相色谱-串联质谱(UPLC-MS/MS)被用于检测葡萄酒样品[26]。王思威等[27]结合改进的QuEChERS 方法建立了荔枝花粉和花蜜中吡唑醚菌酯及其代谢物BF 500-3 的分析方法。YOU 等[28]用UPLC-MS/MS 法同时检测玉米、小麦、葡萄、苹果、黄瓜、番茄等农产品中吡唑醚菌酯及BF 500-3,该方法还被用于人参[29]、草莓[30]、花生[31]、香蕉[32]、西瓜[33]、辣椒[34]等检测。气相色谱-串联质谱(GC-MS/MS)可检测葡萄和葡萄酒中吡唑醚菌酯[35]。FILHO 等[36]开发了一种基于固相微萃取(SPME)技术结合GC-MS 选择的离子监测(GC-MS.SIM)方法,用于快速检测吡唑醚菌酯。液相色谱-紫外检测法(LC-UV)被用于分析测定土壤和西瓜样品[37]。高效液相色谱紫外测定法(HPLC-UV)被用于大白菜检测[38]。高效液相色谱(HPLC)被用于测定平菇、榆黄蘑[39]和香蕉[40]的残留。RAO等[41]采用基质固相分散(MSPD)技术,结合HPLC检测番茄果实。
2.1.2 动物样品
相较于植物样品检测方法的成熟程度,关于动物源样品中吡唑醚菌酯的检测方法报道较少。LI 等[42]采用UPLC-MS/MS法测定吡唑醚菌酯在鱼类组织(血液、肝脏、肌肉和鳃)中的分布。MU 等[43]采用改良的QuEChERS 前处理方法结合LC-MS/MS 建立了鸡肉、鸡蛋、牛奶、猪肉、猪肝、猪腰、猪油等7 种动物源食品中吡唑醚菌酯的检测方法,该方法回收率高,检出限为0.04×10-3~1.26×10-3mg·kg-1,适用于动物组织中吡唑醚菌酯的残留检测。今后应加强动物源样品中吡唑醚菌酯残留检测方法的研究。
2.2 吡唑醚菌酯的残留限量标准
我国《食品安全国家标准食品中农药最大残留限量》(GB 2763—2019)规定,吡唑醚菌酯每日允许摄入量(ADI)为0.030 mg·kg-1(以体质量计),许振岚等[44]根据我国人群平均体质量(63 kg)计算吡唑醚菌酯的ADI 值为1.890 mg·kg-1。我国及美国、欧盟等规定吡唑醚菌酯在谷物类、蔬菜类、水果类、肉类及其他食品中的最大残留限量(MRLs)如表1 所示。当前已明确吡唑醚菌酯残留限量标准的农产品还较少,同一类产品的标准应具体区别,且我国的标准与美国、欧盟等存在不对接现象,有必要根据我国农业发展水平和贸易壁垒实时调整。
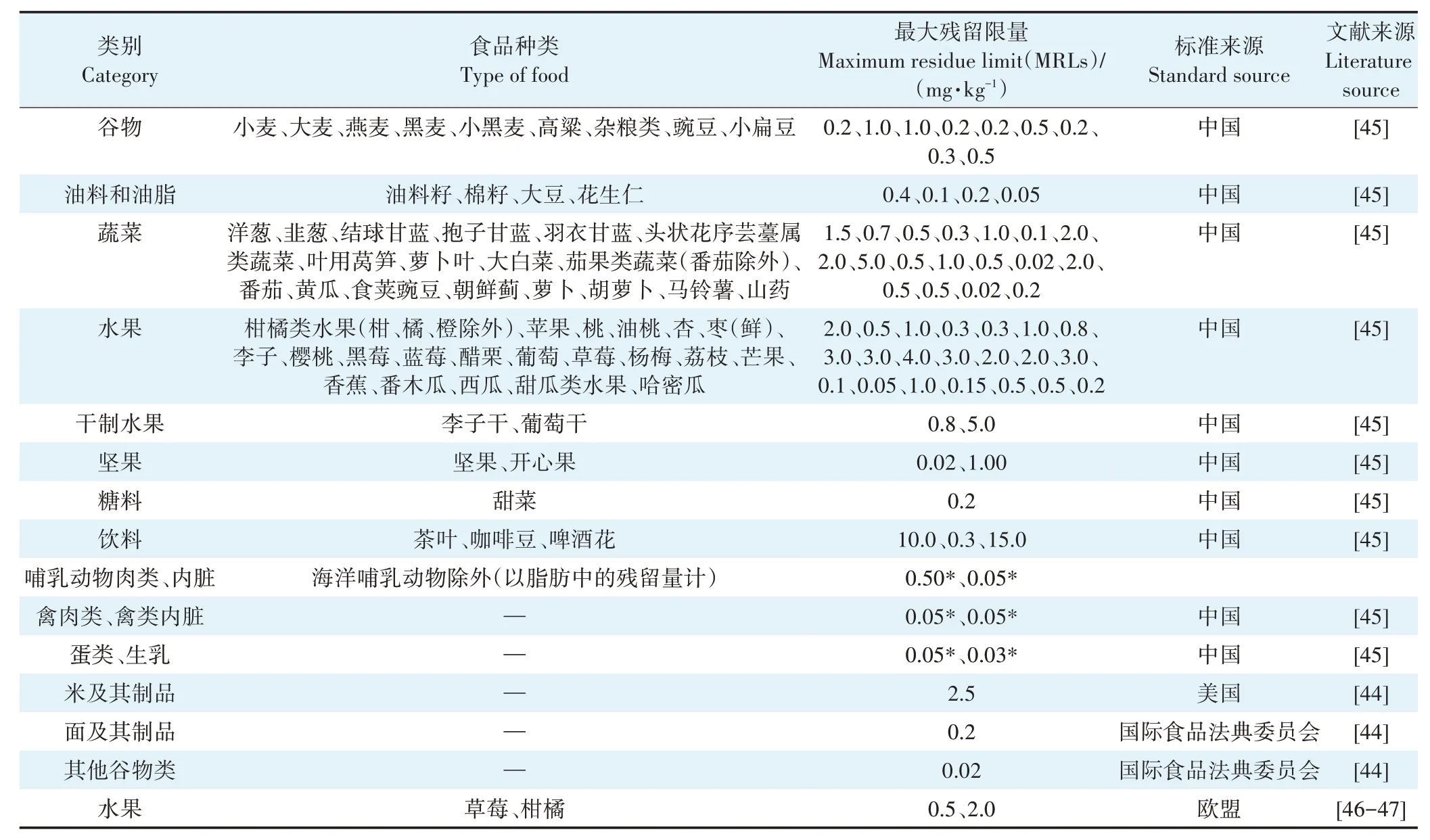
表1 吡唑醚菌酯的残留限量标准Table 1 Residue limit standards of pyraclostrobin
3 吡唑醚菌酯在环境中的降解
3.1 吡唑醚菌酯在土壤和水体中的降解速率
吡唑醚菌酯在土壤中的降解动态已有许多报道,其在不同试验中表现出不同的降解速率。吡唑醚菌酯在种植草莓的土壤中t1/2为3.4~10.0 d,施药剂量(以有效成分计,下同)2.28 g·hm-2,7.0 d 后最高残留量为0.47 mg·kg-1[46];在柑橘园土壤中t1/2为5.5 d,以40%甲基硫菌灵·吡唑醚菌酯SC 533~800 倍液施药,每隔10.0 d 施药2 或3 次,距最后一次施药的14.0~28.0 d 采样,土壤中的残留量为0.02~3.45 mg·kg-1[47];在种植辣椒的土壤中t1/2为8.8~10.7 d[48];在稻田土壤中t1/2为5.0~34.7 d,按100.00~150.00 g·hm-2剂量喷施,30.0 d 和60.0 d 后稻田土壤中的残留量分别为0.001~0.846 mg·kg-1和0~0.002 3 mg·kg-1[49];在施药剂量分别为3.33、6.67 g·hm-2时,施药后60.0 d在种植人参的土壤中残留量分别为0.016 7、0.005 8 mg·kg-1[29];ZHANG 等[31]试验表明,按75.00、112.50 g·hm-2剂量在种植花生的土壤中喷施3 或4 次,t1/2为13.1~16.5 d,28.0 d 后的残留量为0.005~0.120 mg·kg-1;FU 等[40]报道在种植香蕉的土壤中t1/2为10.6~11.6 d。根据以上降解数据可知,吡唑醚菌酯在土壤中的降解速率属中等偏快,残留量总体较低,表明按推荐剂量科学合理施药对土壤环境产生危害的风险较小,而不同研究中吡唑醚菌酯在土壤中的降解速率差异可能是由基质成分和环境条件差异所致。
由于吡唑醚菌酯不溶于水,其广泛应用对水生生态系统构成的潜在风险较大,但有关其在水体中的降解动态研究较少。GUO 等[49]的研究表明吡唑醚菌酯在稻田水中的t1/2为6.9~11.5 d,按100.00~150.00 g·hm-2的剂量施用于稻田,30.0 d 和60.0 d 后稻田水体中的残留量分别为0.040 6×10-3~0.260×10-3mg·L-1和0.003 3×10-3~0.106 0×10-3mg·L-1。
3.2 微生物对吡唑醚菌酯的降解作用
微生物降解是农药在环境中降解的主要途径。甲氧基丙烯酸酯类杀菌剂分子上有许多活性位点,通常容易发生醚键水解和氧化、苯环羟基化、双键氧化、脱羧和异构化等。BIROLLI 等[50]用柑橘园土壤进行吡唑醚菌酯的细菌降解试验,发现芽孢杆菌、肺炎杆菌等对降解具有明显的促进作用,并得到如下结果:①提出了母离子不同位置ESI-质子化前体产生的三种不同的裂解途径(图2A);②鉴定了片段离子结构以推测代谢物(图2B):鉴定出可能来源于酯酶水解反应的羧酸衍生物(图2B-a),观察到与乙醇的酯交换或酯酶催化反应生成乙酯(图2B-b),鉴定出一种初级尿素(图2B-c),提出氯苯环羟基化产生代谢产物(图2B-d),吡唑基团中产生羟基(图2B-e),在1-(4-氯苯基)-1H-吡唑-3-醇部分的两个环上进行两个羟基化反应并发生甲基化(图2B-f),以及一个羟基取代氯原子的反应(图2B-g),提出前体离子的三个生物转化反应——氨基甲酸甲酯基团的水解、氯原子被羟基取代和吡唑环上的一个双键还原(图2Bh),最后鉴定出生物转化产物邻-(N-甲氧基-甲基氨基甲酸酯)-苯基甲醇(图2B-i);③阐述生物降解途径(图2C),鉴定出代谢物1-(4-氯苯基)-1H-吡唑-3-醇(苯基吡唑);④提出土壤原生微生物群对吡唑醚菌酯的降解更为重要。
降解菌株的挖掘是研究微生物降解的主要途径。HOWELL 等[51]分离了用来降解甲氧基丙烯酸酯类杀菌剂的2株降解菌株(Cupriavidussp.和Rhodano⁃bactersp.),16S rRNA 表明这两株降解菌均能降解吡唑醚菌酯,但未发现代谢产物。CHEN 等[52]从夏威夷土壤中获得了两个能够降解吡唑醚菌酯的微生物群落(HI2 和HI6),以吡唑醚菌酯为唯一碳源进行驯化后,只有变形菌门和拟杆菌门能够在HI2 和HI6 微生物群落中存活,HI2 和HI6 菌群中假单胞菌的占比分别为69.3%和59.3%,100 mg·L-1吡唑醚菌酯在5.0 d内降解率超过99%,菌群中还存在金丝杆菌(Chrseo⁃bacterium)、不动杆菌(Acinetobacter)、狭食单胞菌(Ste⁃notrophomonas bacteria)等,表明这些细菌对吡唑醚菌酯具有耐受能力;该研究还提出了氨基甲酸酯水解的代谢途径,即吡唑醚菌酯的羧基官能团脱羧后叔胺基水解为伯胺基,并鉴定出了由酰胺水解反应产生的一种独特的代谢物TPs,TPs 的特征片段和化学结构如图2D 所示,假单胞菌很可能含有表达羧酸酯酶的编码,可能成为氨基甲酸酯降解基因表达和克隆的理想候选菌。LOPES 等[53]从连续种植大豆的土壤中分离获得一株对吡唑醚菌酯具有降解作用的细菌1805,鉴定为克雷伯氏菌(Klebsiellasp.),该菌对吡唑醚菌酯的降解率为31.7%。陈少华等[54]报道了一株可降解吡唑醚菌酯的菌株Burkholderia anthinaBA01,并将其制成菌剂使用。当前对吡唑醚菌酯具有降解作用的菌株仍较少,总体降解能力不足,缺少成熟的降解菌剂供污染修复使用。
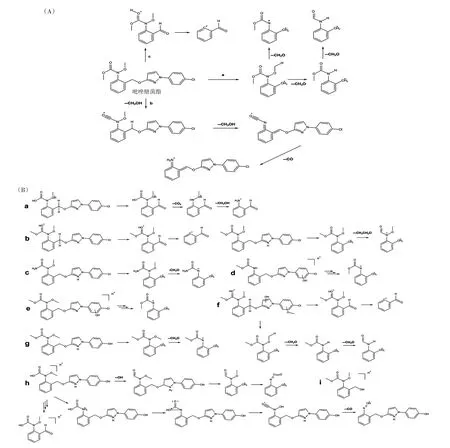
图2 吡唑醚菌酯的微生物降解[50,52]Figure 2 Microbial degradation of pyraclostrobin[50,52]

续图2 吡唑醚菌酯的微生物降解[50,52]Continued figure 2 Microbial degradation of pyraclostrobin[50,52]
4 吡唑醚菌酯在动植物体内的代谢
4.1 在植物体内的代谢
吡唑醚菌酯在不同植物基质或同种基质不同时空的代谢速率均存在差别,但其t1/2多数在10.0 d 以内,表明总体代谢速率较快。BF 500-3 是吡唑醚菌酯的主要代谢物,其毒性与母体相近,美国和加拿大将吡唑醚菌酯的残留量定义为其母体与BF 500-3 含量之和,而联合国粮农组织(FAO)、世界卫生组织(WHO)、农药残留专家联席会议(JMPR)、中国、欧盟及日本均仅定义为吡唑醚菌酯含量[55-56]。当前吡唑醚菌酯及其代谢物BF 500-3 在植物体内的代谢动态已有诸多报道(表2)。许振岚等[44]的研究表明25%吡唑醚菌酯WG 在铁皮石斛茎和叶中消解120.0 d 的消解率分别为80%和94%,t1/2为38.1 d,这是目前其在植物基质中最长t1/2的报道。SADLO 等[57]在采摘前6.0 d 将33%吡唑醚菌酯WG 以120.60 g·hm-2的施用剂量施于树莓,结果表明,树莓果实采后第1.0天吡唑醚菌酯的平均残留量为0.25 mg·kg-1,仅达MRLs 的12.5%,从采果后的第7.0 天开始,吡唑醚菌酯的含量就降至0.10 mg·kg-1以下,但28.0 d后残留量仍在0.01 mg·kg-1以上,该树莓不能用于婴儿食品生产。目前关于植物基质内微生物影响吡唑醚菌酯降解代谢的研究鲜有报道,WOLEJKO 等[21]将有效微生物和酵母与33%吡唑醚菌酯WG 混合在生菜上使用,发现添加有效微生物会显著抑制吡唑醚菌酯分解,添加酵母会促进吡唑醚菌酯在生菜中的分布。

表2 吡唑醚菌酯及其代谢物BF 500-3在植物组织中的残留动态Table 2 Residue dynamics of pyraclostrobin and its metabolite BF 500-3 in plant tissues
吡唑醚菌酯在不同基质中的降解代谢速率存在差异,这可能是由于不同基质组织成分中生长稀释因子、含水量、酸碱度等理化性质不同而导致代谢作用不同,且温度、光照、降雨等环境条件也会影响其代谢速率。总体来看,吡唑醚菌酯在植物基质中的代谢较快,施药至安全间隔期后其残留量多在MRLs 之下,食用风险较小。目前在检测吡唑醚菌酯的同时检测其代谢物BF 500-3的研究较少。
4.2 在动物体内的代谢
相比植物、土壤及水体,吡唑醚菌酯在动物体内的代谢研究报道较少。LI 等[42]测定了LC50条件下罗非鱼组织中吡唑醚菌酯的动态残留,发现吡唑醚菌酯在罗非鱼各组织中的含量均为先增加后减少,这可能是由于鱼体的解毒功能将毒素从体内排出以维持内部环境;但在用药后的120 min和720 min时含量急剧下降,这可能与鱼类在急性毒性下的应激反应有关;以0.058 mg·L-1(LC50)吡唑醚菌酯处理鱼体,2 880 min 后其在鱼鳃、血液、肝脏和肌肉中的最终残留量分别为0.204、0.341、0.052、0.031 mg·kg-1,吡唑醚菌酯在罗非鱼各组织中的积累差异和变化可能与各组织对其母体和代谢物的亲和力以及母体和代谢物对各组织的毒性作用不同有关。
5 吡唑醚菌酯的毒理
5.1 吡唑醚菌酯的毒性评估
在农药注册过程中,欧盟要求对鱼类、啮齿动物和哺乳动物进行风险评估[67]。吡唑醚菌酯原药对大鼠急性经口LD50>5 000 mg·kg-1,急性经皮LD50>2 000 mg·kg-1,急性吸入LC50(4 h)>0.31 mg·m-3;对兔眼睛、皮肤无刺激性[68]。目前未发现吡唑醚菌酯对哺乳动物存在致畸、致癌、致突变作用。吡唑醚菌酯对罗非鱼的LC50为0.058 mg·L-1[42],对蓝鳃鳗和水蚤的96 h LC50分别为0.011 mg·L-1[69]和0.014 mg·L-1[70]。对鹌鹑的急性经口LD50>2 000 mg·kg-1,对虹鳟鱼的96 h LC50为0.006 mg·L-1,对月牙藻72 h ErC50为0.843 mg·L-1、EbC50为0.152 mg·L-1,对蜜蜂经口LD50>73.10 g·只-1、接触LD50>100.00 g·只-1,蚯蚓LC50为566 mg·kg-1(土壤),对梨盲走螨和缢管芽茧蜂风险较低[71]。
MANN 等[72]报道在农药广泛使用的地区出现了许多畸形两栖动物,两栖动物对水生和陆地环境因素都较敏感,因此比其他生物更容易受到环境风险的影响,适用于环境化学污染的评估,热带爪蟾是一种新兴的用于发育毒理学的模式动物[73]。LI 等[74]开展了吡唑醚菌酯对热带爪蟾胚胎的影响研究,发现当吡唑醚菌酯的浓度超过0.005 mg·L-1时热带爪蟾的生存率快速下降,LC50为0.007 mg·L-1,中致畸浓度(TC50)为0.000 6 mg·L-1,吡唑醚菌酯对热带爪蟾胚胎的毒性浓度已接近环境浓度。
5.2 吡唑醚菌酯的毒性机制
5.2.1 吡唑醚菌酯的组织器官毒性
斑马鱼是经济合作与发展组织(OECD)推荐的生态毒理学试验模式生物。HUANG 等[75]对吡唑醚菌酯作用于斑马鱼成鱼的暴露途径和靶器官进行研究,发现水生暴露、头部浸泡、躯干浸泡和口服暴露对吡唑醚菌酯在鱼体内的毒性积累效应不同,暴露后鳃中发生了严重的组织学异常(鳃片弯曲、融合、空泡化、肿胀等)、线粒体功能障碍和呼吸功能障碍,而在心脏和大脑中未观察到明显变化,据此提出吡唑醚菌酯在鱼体积累的主要途径是通过鳃而不是肠道或皮肤,这可能是因为鳃占鱼体的总表面积比例较大且是鱼体的呼吸过滤器官。DOMINGUES等[76]发现吡唑醚菌酯会促使巴西无刺蜜蜂中肠损伤和细胞凋亡,如引起中肠细胞的细胞质空泡化、诱导产生非典型核或固缩核等,且由于中肠受影响,所有暴露后的无刺蜜蜂存活率均下降。
5.2.2 吡唑醚菌酯的内分泌毒性
ZHANG 等[77]的研究表明吡唑醚菌酯对斑马鱼96 h LC50值为0.056 mg·L-1,肝脏中ROS 水平在暴露后显著升高,但随着暴露浓度的增加而降低,可能因为抗氧化酶在一定程度上清除了过量的活性氧;暴露后斑马鱼体内的超氧化物歧化酶(SOD)活性明显下降,可能是过量的ROS 抑制了SOD 活性;过氧化氢酶(CAT)活性随时间延长而增强,但低于对照组,表明CAT 在一定程度上具有清除ROS 的作用;谷胱甘肽S-转移酶(GST)活性随吡唑醚菌酯剂量的增加先降低后升高,通过消除过量的ROS 发挥解毒功能;处理组的MDA 水平均高于对照组,但随着暴露剂量的增加而降低,这表明抗氧化酶降低了脂质过氧化程度;吡唑醚菌酯污染可直接诱导DNA 链断裂,而ROS 依赖过程可间接诱导DNA 链断裂,对DNA 损伤的作用具有剂量依赖性,该研究提出DNA 链断裂可能是由于抗氧化剂和解毒酶无法消除过量ROS。YANG等[78]发现吡唑醚菌酯对斑马鱼胚胎及幼鱼的线粒体和非线粒体呼吸均有抑制作用,亚致死剂量的吡唑醚菌酯会使斑马鱼幼鱼在黑暗周期内活动过度;此外,吡唑醚菌酯会影响斑马鱼膀胱膨胀,并导致膜联蛋白A5(anxa5)mRNA 水平下调,Pre-B 细胞白血病同源框1a(pbx1a)转录水平上调;吡唑醚菌酯更容易与甲状腺激素受体β(TRβ)的拮抗构象相互作用,可能引起斑马鱼内分泌紊乱。
5.2.3 吡唑醚菌酯的发育和免疫毒性
LI 等[79-80]研究了吡唑醚菌酯对斑马鱼胚胎的发育毒性、氧化应激和免疫毒性,得出96 h 急性LC50为61.00 mg·L-1,吡唑醚菌酯的暴露使胚胎心跳受抑制,胚胎的孵化率和幼虫孵化体的长度均显著降低;吡唑醚菌酯对胚胎发育的致畸作用表现为引起形态学异常,如生长迟缓、心包水肿、卵黄囊水肿、卵黄囊畸形和色素沉着缺陷等,浓度达36.00 mg·L-1以上时,使幼鱼产生脑损伤畸形、心脑组织和线粒体结构损伤等,降低心脏功能、抑制谷氨酸受体活动及与斑马鱼幼鱼运动行为相关的蛋白浓度;吡唑醚菌酯抑制了鱼体谷胱甘肽(GSH)含量以及抗氧化相关基因(Mn-sod、Cu/Zn-sod、Cat、Nrf2、Ucp2和Bcl2)的mRNA 表达水平;吡唑醚菌酯的暴露对胚胎基因表达具有多重影响,10.00 mg·L-1可诱导氧化应激相关的Cu/Zn-sod转录,而20.00、40.00 mg·L-1则表现为抑制作用,40.00 mg·L-1时显著降低CatmRNA水平,Nrf2mRNA水平下降,10.00、40.00 mg·L-1时使Ucp2mRNA 水平上升,20.00、40.00 mg·L-1时明显抑制Bcl2的转录;20.00、40.00 mg·L-1时抑制IL-1b的转录,高浓度时导致IFN和CC-chem表达显著上调,40.00 mg·L-1时诱导C1CmRNA 水平提高,说明吡唑醚菌酯对斑马鱼胚胎发育过程具有免疫毒性。
FENG 等[81]研究得出吡唑醚菌酯对新生水蚤及其胚胎的48 hEC50分别为0.021、0.004 mg·L-1,吡唑醚菌酯会引起水蚤早期发育停滞、头部和身体异常发育等;水蚤体内GST活性随着吡唑醚菌酯浓度的增加而升高,最低效应浓度为0.005 mg·L-1;水蚤的育雏数量随着吡唑醚菌酯浓度增加而显著减少,21.0 d 慢性毒性试验表明,其对繁殖的最低效应浓度为0.000 2 mg·L-1,接近其在环境中存在的浓度;蜕皮速率随着吡唑醚菌酯浓度增加而降低,在0.002 4 mg·L-1时显著降低,为对照组的80.2%,浓度超过0.000 3 mg·L-1时水蚤平均体长显著降低。TADEI 等[82]认为,吡唑醚菌酯的活性成分和商品化助剂不会影响成年蜜蜂幼虫的胚后发育和存活,但会使其DNA 片段增加,使HSP70免疫标记模式发生改变。吡唑醚菌酯还会导致幼蜗牛的摄食速率降低,回避行为增加,延长蜗牛的孵化时间,降低孵化成功率,且导致蜗牛体内的脂质含量和碳水化合物降低、蛋白质含量升高[83]。
6 结语与展望
(1)相较于部分半衰期长、毒性强的杀虫剂和除草剂,吡唑醚菌酯对环境和人体的危害不大,但其普遍大量使用,在环境中代谢、迁移、积累,对大气、土壤、水体等生态系统中的非靶标生物构成潜在危害,被评价为对水生生态系统产生不良影响风险最高的10 种杀菌剂之一。有效降低吡唑醚菌酯的危害应具体到农业生产各环节,首先要健全监管机制并加强监管力度,从源头上控制吡唑醚菌酯向环境中的投入量,普及田间用药规范,指导科学合理用药;其次,吡唑醚菌酯施于农业生态系统后,在不同基质内的降解代谢速率不同,应研究其消解动态及毒性作用,以确定安全施用间隔期,为农产品的安全性评价提供依据;最后在农副产品流向市场的关口做好把关工作,制定完善吡唑醚菌酯在农副产品中的残留限量标准,严格进行残留检测,健全产品追溯体系,促进良性循环。
(2)农药污染修复是环境治理的重要部分。当前对吡唑醚菌酯污染土壤和水生态系统修复治理的研究较少,针对性强的高效降解微生物、降解剂和富集植物等开发工作尚不足,降解菌株和降解酶开发、富集植物筛选等对污染修复尤为重要,然而自然界的生物修复更依赖于复杂微生物种群的协同代谢活动,单纯菌株的生物降解难以代表环境微生物在天然污染土壤中的实际行为,在评估菌株降解能力时应综合分析,鉴定和表征具有降解农药能力的基因或酶,以及重组DNA表达研究等是吡唑醚菌酯降解研究的重要方向。一些新兴技术的出现还可能为促进吡唑醚菌酯的降解提供新方法,如通过产生足够的羟基自由基来降解吡唑醚菌酯的高级氧化过程(AOP),其过程包括双氧水、紫外线、臭氧、二氧化钛和芬顿反应等组合。
(3)吡唑醚菌酯对哺乳动物和鸟类是相对安全的,其在经口、接触和注射方面,被归类为微毒、微刺激的Ⅲ类,无论急性毒性、慢性毒性还是长期影响,均无致畸、致癌、致突变作用,也无对繁殖产生不良影响的报道。然而,吡唑醚菌酯对水生生态系统中的鱼类、无脊椎动物以及两栖动物都有剧毒,因此研究其在环境中的归趋以及带来的生态毒性是很有必要的。吡唑醚菌酯在环境和生物体中会降解为一系列代谢产物,如BF 500-3的毒性就与其母体相似,多项研究均有检出且含量不低,代谢物的残留检测、毒理研究及毒性评价是研究吡唑醚菌酯环境行为和毒性评估不可忽略的部分。当前吡唑醚菌酯在动植物体内的代谢研究多以毒性机理、消解动态等为主,为深入探索其在动植物体内的毒性机制,更全面地评估综合效应,应加强其在动植物体内相关代谢途径研究和产物鉴定。
(4)当前吡唑醚菌酯的残留检测仍以色谱分析为主,色谱分析测定技术已趋于成熟,具备快速、灵敏等优点,可满足不同基质的检测要求。吡唑醚菌酯是直接施用于植物的杀菌剂,植物性农产品及其加工的食品是人类摄入农药残留的主要来源,相关检测分析方法以植物性样品居多,而关于其在动物源食品中残留检测的研究较少,但杀菌剂会通过食物链在动物体中蓄积,因而动物源食品中常用杀菌剂的残留检测同样必要。动物组织中的蛋白质、脂肪、纤维素等含量与植物组织差异较大,提取过程与检测方法存在区别,动物源样品的检测方法有待进一步研究。
