新教材DNA片段的扩增及电泳鉴定实验的问题探讨
2022-07-25卢燕梅
卢燕梅
摘 要 探讨2019年人教版高中生物学教材《选择性必修3.生物技术与工程》“DNA片段的扩增及电泳鉴定”探究实验中的引物设计、退火温度估算、延伸时间计算、电泳介质选择、缓冲液作用等内容。
关键词 PCR 电泳 生物学教学
中图分类号Q-49
文献标志码E
2019年人教版高中生物学教材《选择性必修3.生物技术与工程》(以下简称“新教材”)中的“DNA片段的扩增及电泳鉴定”探究实验在老版教材(2007年版)的基础上增加了PCR实验及电泳鉴定的方法等步骤。由于高中一线教师和学生很少能有实际操作的机会,且对实验过程中的具体细节及对应原理了解有限,因此在教学及学习过程中存在各式各样的疑惑。下文将结合文献资料和实验经验,对该实验中常见的问题进行剖析。
1 设计引物的原则
特异性引物的设计理论上应依据目的基因两端的己知碱基序列,遵循碱基互补配对原则进行。但实际应用过程中,DNA的部分区域是不能进行引物设计的。在科研过程中,研究者經常利用亲缘关系较近的生物的保守序列设计引物,扩增未知序列。因此,实际操作中设计的引物不能够与模板完全配对。有效引物的获得应遵循以下原则:
①应与同一基因组中其他核酸序列无明显相似。
②引物长度一般设计在20-25 bp。以引物长度为20 bp为例,420 ≈1.099 5xl0 12,己远大于哺乳动物单倍体基因组3x109 bp,因此可防止引物的随机结合。
③(G+C)碱基含量占比40%-60%为宜。(G+C)碱基含量会影响退火温度,最终影响实验结果。同时,应避免出现相同碱基多次连续排列。
④引物本身避免出现发夹结构(避免4 bp以上的回文序列)以及两条引物间形成较长的互补配对情况。若是引物间3’端反向互补,则会增大引物二聚体的形成概率,降低特异性扩增的效率。
⑤引物3’端的末尾碱基需完全与目标序列配对,否则易导致退火失败。
⑥引物的3’端的碱基最好设计成T或G。因为Taq DNA聚合酶(以下简称Taq酶)对T或G比对C或A的识别度(亲和性)更高。
⑦引物中带有合适的酶切位点。有些扩增出的目的基因后续要进行酶切分析或连接到载体上。
通常实验室的引物设计借助引物设计软件进行,如Primer Premier (6.0版)、Oligo 7、NCBI的primerBlast,可按照实验者需求进行设计。
2 估算退火温度的方式
退火温度的设定是影响PCR是否成功的重要因素之一。新老教材的PCR实验过程将退火温度均设置为55℃,使得众多教师与学生误认为退火温度只能是55℃。由于反应体系中引物浓度远高于模板浓度,且模板DNA远比引物复杂,因此退火过程是由引物驱动的。针对不同的引物,退火温度要依据其长度、碱基组成等条件来设定。一般情况下,可借助以下公式预判退火温度:Tm=4(G+C)+2(A+T)(其中Tm即解链温度,是指在此温度下DNA双螺旋结构解链一半)。为保证引物和模板的有效结合,退火温度需低于计算出的Tm值,一般情况下退火温度为Tm - 5℃因此,若退火温度设置过高,则引物与模板链不易结合,导致实验无法获得特异性产物或特异性产物量过低;若温度过低,则又会增加引物与模板非目的片段随机结合概率,而获得非特异性产物。
3 计算延伸时间的规律
延伸温度取决于使用的Taq酶的最适温度,一般为70-75℃,通常设定为72℃。实际实验的延伸时间需参考设定延伸温度下Taq酶活性和目的片段的长度。目前,众多实验室使用的Taq酶在72C下碱基延伸速率可达到1 kb/min。因此,当扩增大小1 kb及以内的DNA片段时可延伸1 min;当扩增大小2 kb及以内的DNA片段时延伸2 min,以此类推。而当扩增片段小于150 bp,则可省略延伸步骤,因为在退火温度下的Taq酶活性己足以完成目的序列的延伸。通常在最后一轮循环完成后,实验应将反应体系在72C下保温5 min,以保证所有片段的延伸完成。
4 选用琼脂糖的原因
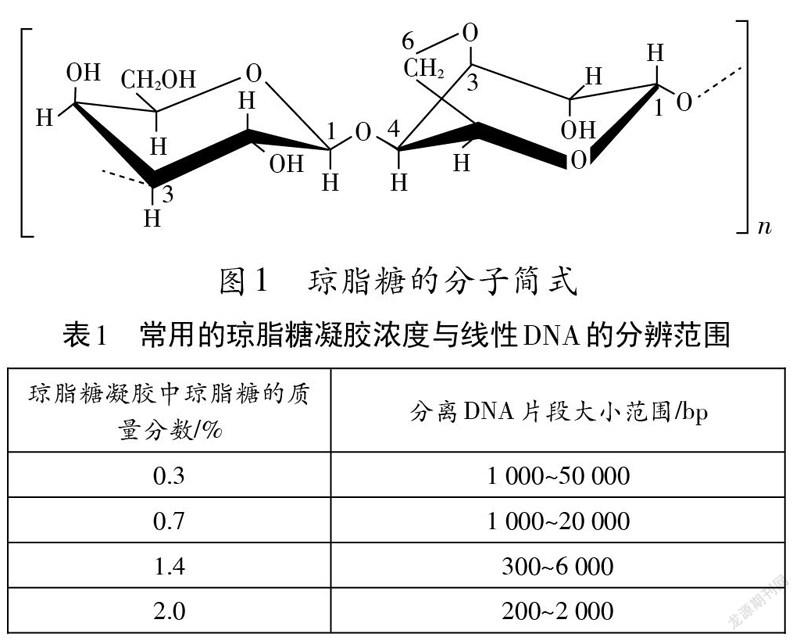
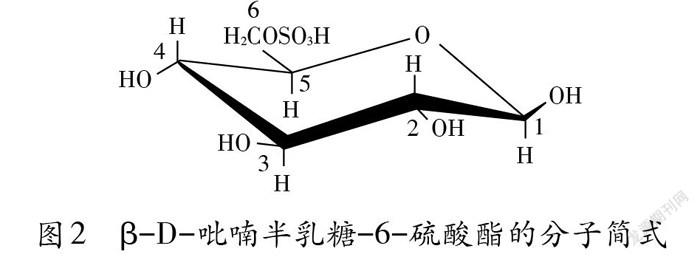
琼脂糖(图1)是由D-吡喃半乳糖和3,6-脱水一L-吡喃半乳糖两个单位交替组成的线性多糖聚合物。D-半乳糖单位以B取向与3,6-脱水-L-半乳糖单位的C4位相连,后一单位以α取向与D-半乳糖单位C3位相连。琼脂糖因不含负电荷的硫酸根和羧基,在电泳过程中不会吸附离子,因此是电泳实验的良好介质。因琼脂糖对DNA片段的分辨能力由其浓度决定,在实际操作中要注意对琼脂糖浓度的选择。琼脂糖凝胶分辨DNA片段的范围为0.2-50 kb,凝胶浓度的高低会影响最终形成胶体的孔隙大小,浓度越低,孔隙越大,其分辨能力就越弱;反之则孔隙减小,分辨力增强(表1)。
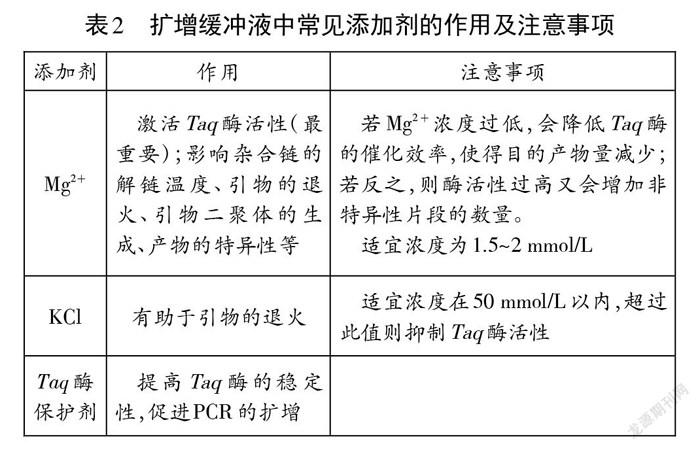
电泳实验使用的琼脂糖与微生物实验中制备培养基的琼脂同样具有凝固作用,二者是否为同一物质在不同实验中的表述?对琼脂进行化学分析,可分离出琼脂糖和琼脂胶两个组分。琼脂糖是琼脂的主要组分,而琼脂胶又是琼脂糖的衍生物,是由丙酮酸基、甲氧基、硫酸基等不同程度地取代琼脂糖上的羟基的产物,如3-D-半乳糖残基C6被硫酸酯化(图2)。因此,二者并不是同一种物质。而正因琼脂带有电荷,不如琼脂糖适合作为电泳介质。
5 添加缓冲液的目的
5.1 扩增缓冲液
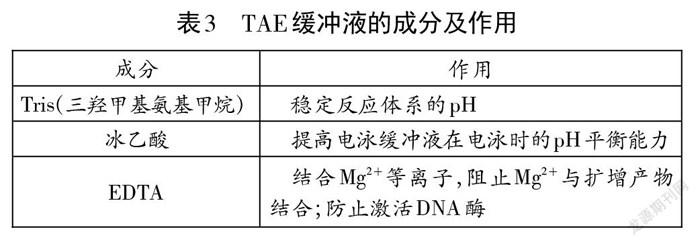
扩增缓冲液为PCR反应体系提供所需的pH环境和添加剂。目前最常用的缓冲液是10-50 mmol/L的Tris-HCl,能够为整个反应体系提供适宜的pH。添加剂包括Mg2+、K+、Cl、Taq酶保护剂等(表2)。扩增缓冲液有不同的浓缩倍数,实际实验中需要进行稀释。以10倍浓缩(10X)的扩增缓冲液为例,若整个反应体系总体积为50 uL,则扩增缓冲液只需添加5 uL。
5.2 电泳缓冲液
电泳缓冲液在维系电泳体系pH的同时,因带有一定的导电能力而影响DNA的迁移速率。实验室中最常见的DNA电泳缓冲液有TAE与TBE,二者各有优势,前者可用于做切胶回收实验,后者可承受更长时间的电泳。实验室通常一次性配制一定量(常以升为单位)的储存液,待到使用时将储存液用超纯水稀释一定倍数即可。以TAE缓冲液为例分析其各成分作用,见表3。
5.3 上样缓冲液
上样缓冲液又称载样缓冲液,实验时需将其与待测产物混合。因缓冲液中含有甘油,使得混合物的密度大于电泳缓冲液,点样时便会沉积在点样孔的底部。此外,上样缓冲液因含有溴酚蓝和二甲苯氰FF而呈深蓝色,可以帮助实验者观察DNA所处的位置,防止因电泳时间过长导致DNA跑出凝胶。
参考文献:
[1]朱圣庚,徐长法.生物化学(下册)[M].北京:高等教育出版社,2016.
[2]朱圣庚,徐长法.生物化学(上册)[M].北京:高等教育出版社,2016.
[3]朱玉贤,李毅,郑晓峰等.现代分子生物学[M].北京:高等教育出版社,2019.
[4]王廷华,刘佳,夏庆杰.PCR理论与技术[M].北京:科学出版社,2013.
