QuEChERS-气相色谱质谱法快速测定水产饲料中地西泮残留
2022-07-23马丽莎尹怡谢文平单奇郑光明李丽春刘书贵戴晓欣赵城魏琳婷林嘉薇
马丽莎,尹怡,谢文平,单奇,郑光明,李丽春,刘书贵,戴晓欣,赵城,魏琳婷,林嘉薇
(中国水产科学研究院珠江水产研究所/农业农村部外来入侵水生生物防控重点实验室/农业农村部水产品质量安全风险评估实验室(广州),广东 广州 510380)
地西泮又名安定,属苯二氮卓类镇静剂,具镇静、抗惊厥等作用[1]。在水产养殖中,地西泮不仅可作为生长促进剂添加到饲料中提高水产品的生长速度,还可在养殖及运输过程中降低水产品对环境的应激反应提高其存活率[2-3],备受养殖户青睐,但其有蓄积毒性,对人体肝脏、脑及运动神经等器官具毒副作用[4-5],已被中国及欧盟各国禁止用于动物饲养及产品生产过程[6-8]。GB 31650—2019《食品安全国家标准 食品中兽药最大残留限量》规定在动物性食品中不得检出地西泮[6];农业部 176 号公告规定严禁在饲料和动物饮用水中使用地西泮等精神类药物[7]。但近年来,中国仍有地西泮违规使用的情况发生,如:云南、河南、上海等地的水产品均有检出地西泮的报道,其在水产品中的残留问题已引起广泛关注[9]。
《农业农村部关于加强水产养殖用投入品监管的通知》中指出饲料等水产养殖用投入品的质量问题可造成养殖水产品的质量安全隐患。水产饲料的质量安全是保障养殖产品安全和食品安全的第一道关口,关系到中国水产养殖业的健康发展,故加强饲料中地西泮含量的检测是从源头控制水产品地西泮残留问题的有效手段之一。但目前针对地西泮的测定主要集中在环境样品、动物源性食品、水产品等[10-13],关于饲料的报道较少[14-16]。李俊玲等[14]、贾涛[15]及现行标准NY/T 934—2005[16]分别采用GC-MS法、LC-MS/MS法及液相色谱法(HPLC)测定饲料中地西泮残留,但上述方法均采用固相萃取柱净化样品,存在操作繁琐、费时的缺点,且HPLC法易受杂质干扰产生假阳性,同时灵敏度也较低,由此可见上述方法均难满足目前食品中残留物快速筛查、精准定量的检测要求。因此为加强水产养殖源头监控,避免贸易壁垒,建立水产饲料中地西泮精准、高效的检测方法尤为重要。
气相色谱质谱法(GC-MS)及液相色谱串联质谱法(LC-MS/MS)因特异性、抗干扰能力强、灵敏度高等优点,成为了目前分析复杂基质中痕量组分的首选方法,但液质属大型质谱,仪器价格昂贵,普通实验室无法普及,而气相色谱质谱仪价格适中,有利于方法的推广。样品前处理技术QuEChERS(Quick, Easy, Cheap, Effective, Rugged, Safe)具有快速、简便、有效、廉价、耐用、安全等优点[17],被广泛用于食品安全检测样品的前处理[18-21]。本研究结合QuEChERS与GC-MS的技术优点,建立了水产饲料(配合饲料、浓缩饲料及饲料预混料)中地西泮残留的快速检测方法,具有操作简单、快速、价廉、灵敏度高等优点,单个样品前处理时间仅需30 min,有利于实现样品的批量化处理,可为建立水产饲料质量安全的有效监管、养殖者的风险控制提供有力的技术支持。
1 实验部分
1.1 仪器与试剂
Agilent 7890A-5975C气相色谱-质谱联用仪:配电子电离源,HP-5MS柱(30 m×0.25 mm×0.25 μm),美国Agilent科技公司;旋涡混匀器,德国IKA公司;离心机,上海飞鸽公司;地西泮、D5-地西泮,质量浓度均为100 mg/L,均购自德国Dr. Ehrenstorfor公司;乙二胺-N-丙基硅烷(PSA 40~60目)、石墨化炭黑(GCB)及中性氧化铝(Alumina-N),美国Agela公司;无水硫酸钠(分析纯),国药集团化学试剂有限公司,500 ℃灼烧4 h,冷却后储存于磨口玻璃瓶中备用;氯化钠(分析纯),广州化学试剂厂;甲醇、乙腈、正己烷、二氯甲烷、乙酸乙酯,色谱纯,美国霍尼韦尔公司;实验用水为Milii-Q去离子水。
1.2 标准溶液的配制
标准储备溶液:移取适量的地西泮标准物质用甲醇溶解,配制成10 mg/L的标准储备液,使用时用甲醇稀释成1 mg/L的标准使用液,现用现配。
内标储备溶液:移取适量的D5-地西泮标准溶液,用甲醇溶解配制成10 mg/L 的内标储备液,使用时用甲醇稀释成1 mg/L的标准使用液,现用现配。
空白基质提取液:样品按照1.3节条件前处理,获得空白基质提取液。
基质标准工作溶液的配制:用空白基质提取液稀释标准使用液配制成质量浓度分别为5、10、50、100、200、500 μg/L的系列标准曲线工作液,内标浓度为50 μg/L。
1.3 样品及样品前处理
1.3.1 样品
水产饲料分为配合饲料、浓缩饲料和预混饲料。预混饲料是饲料生产的核心,是饲料加工生产的基础。预混料添加适量的蛋白质、维生素和矿物质等原料构成浓缩料。浓缩料再添加玉米、麦麸等构成配合饲料。
1.3.2 样品制备
饲料样品经粉碎均匀后制成待测样,于室温下密封保存。
1.3.3 提取
准确称取样品2.00 g(精确到0.01 g),置于50 mL塑料离心管中,加入100 μL地西泮内标(10 mg/L)和8 mL去离子水,涡旋5 min,加入10 mL乙腈,涡旋2 min,加入1 g氯化钠和5 g无水Na2SO4,涡旋1 min,5 000 r/min离心5 min,取上清液于50 mL塑料离心管中,重复提取 1 次,合并上清液并加入3 g无水Na2SO4,涡旋30 s,5 000 r/min离心1 min,移取上清液至20 mL比色管中用乙腈定容至刻度线后混匀,待净化。
1.3.4 净化
移取1 mL上清液于2 mL塑料离心管中,加入200 mg中性氧化铝、200 mg二氧化锆、50 mg PSA及50 mg GCB,涡旋振荡1 min,以10 000 r/min离心5 min,取上清液,供GC-MS检测。
1.4 仪器条件
1.4.1 色谱条件
载气为纯度高于99.999%的氦气,流速为1.0 mL/min;进样口温度290 ℃,采用脉冲不分流进样,脉冲压力207 kPa,持续时间1 min,分流出口开启时间1 min,进样体积为1 μL;升温程序:初始温度为150 ℃,保持1 min,以5 ℃/min升至280 ℃,保持4 min。
1.4.2 质谱条件
电离方式:EI源;电离能量:70 EV;离子源温度:230 ℃;四极杆温度:150 ℃;辅助加热温度:280 ℃;检测方式:选择离子监测模式(SIM),溶剂延迟:10 min,驻留时间为40 s,监测离子(m/z):地西泮为221、241、256、283,其中定量离子为256,D5-地西泮为226、246、261、288,其中定量离子为261。
1.5 基质效应的计算
饲料成分复杂,富含油脂、色素及蛋白等杂质,极易干扰质谱中目标物的离子化对其产生基质效应,导致目标物发生离子增强或抑制,影响结果的准确度。实验采用基质效应(ME)=基质对照溶液的峰面积/溶剂对照溶液的峰面积,评价地西泮的基质效应。若ME>1,表示基质对目标物的响应产生增强效应;若ME<1,表示基质对目标物的响应产生抑制效应;若ME=1,表示不存在基质效应。当ME介于0.8~1.2时,表明基质干扰程度较低;当0.5
2 结果与讨论
2.1 质谱条件的优化
在m/z50~550范围内进行全扫描,确定各组分的保留时间和特征离子。为降低干扰、提高灵敏度,采用选择离子SIM模式,每个化合物选择1个定量离子、3个定性离子。质谱条件优化的重点是目标物的灵敏度,驻留时间是仪器采集目标离子停留的时间,可影响目标物的峰形及灵敏度。驻留时间过长可导致色谱峰失真、峰形变矮变宽,过短可导致目标物灵敏度下降。通过实验,发现驻留时间为40 ms时,目标物的响应值最大,灵敏度最高,30 ms及50 ms时目标物的响应值均低于40 ms时的响应值。因此,实验确定各监测离子的驻留时间为40 ms。地西泮及D5-地西泮的定性与定量离子见1.4.2,地西泮保留时间为21.211,D5-地西泮保留时间为21.158。
2.2 仪器条件的优化
进样口温度及进样方式可影响目标物的灵敏度。进样口是样品完成气化的地方,合适的进样口温度能保证目标物瞬间完全气化,提高目标物的灵敏度、重现性,但温度过高,可导致目标物分解,重现性变差。实验发现目标物的响应值随进样口温度的升高而变大,当进样口温度为290 ℃时,目标物的响应值最大,灵敏度最高,300 ℃时目标物响应值略有下降,310 ℃时TIC色谱图碎片峰明显增多,显示目标物发生裂解。因此,本研究确定最佳进样口温度为290 ℃。
本研究还比较了普通进样及脉冲不分流进样两种方式对目标物灵敏度的影响。研究发现,脉冲不分流进样时目标物的灵敏度高于普通进样时的灵敏度,且目标峰拖尾情况有所改善,峰形变得尖锐、对称。这可能是由于脉冲不分流进样通过瞬间提高进样口压力的方式,减少了样品在进样口分解及扩散的机会,使样品更集中地进入色谱柱从而改善了峰形、提高了检测灵敏度。因此,本研究选用脉冲不分流进样分析地西泮,并通过优化,确定脉冲压力为207 kPa。
2.3 光照对灵敏度的影响
用乙腈配制6份质量浓度为5 ng/mL的地西泮溶液,其中1份为标样,另外5份用于光照实验以考察光照对地西泮灵敏度的影响,结果显示光照对地西泮的灵敏度影响显著,其灵敏度随光照时间的延长下降明显(图1),因此前处理时应避光操作。
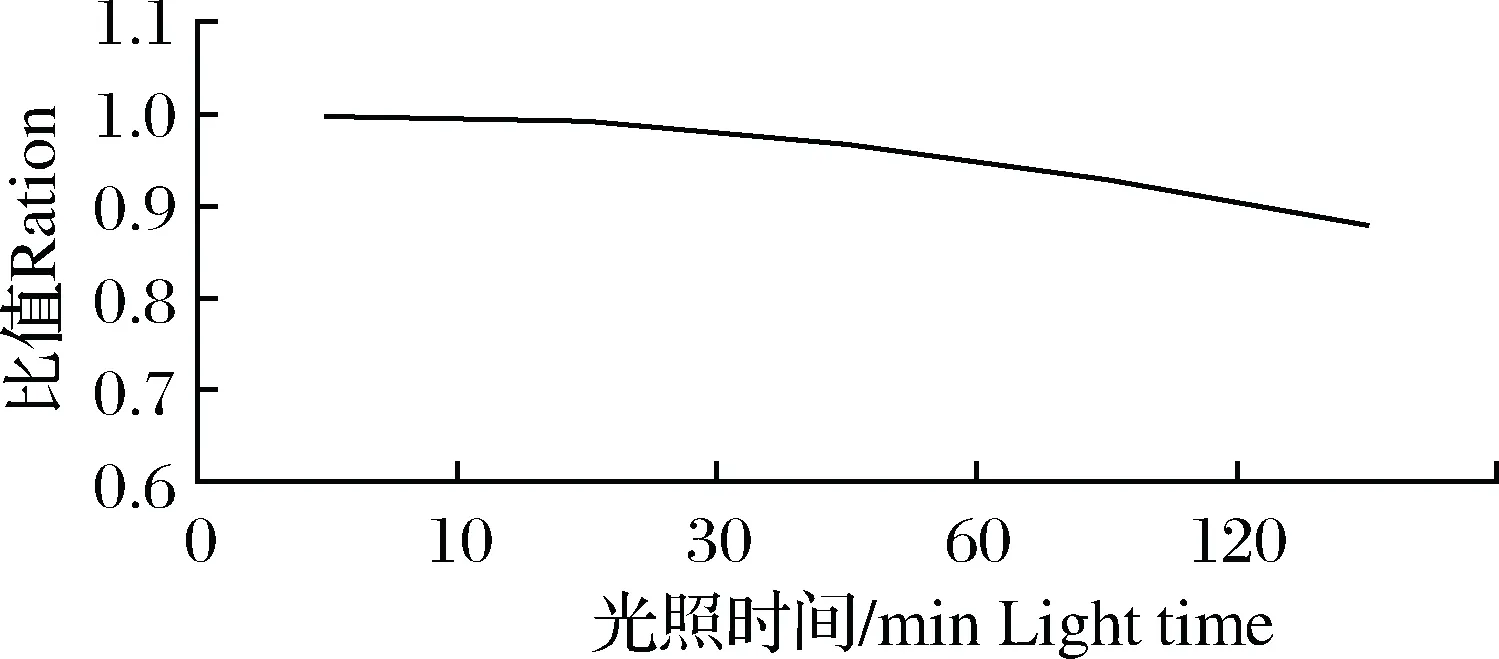
图1 不同光照时间对地西泮响应值的影响注:比值=实验样品峰面积/对应浓度标样峰面积。Fig.1 The effect of different light time on the response value of diazepamNote: ratio=experimental sample peak area/corresponding concentration standard sample peak area.
2.4 提取溶剂的选择
考察了常用的正己烷/二氯甲烷(v/v=7∶3)、乙腈、乙酸乙酯及甲醇4种提取溶剂。通过基质空白实验发现,甲醇的极性较强,提取杂质多,而正己烷/二氯甲烷(v/v=7∶3)脂溶性强,提取出的油脂较多,提取液静置后离心管底部出现一层油脂,TIC色谱图显示,上述两种提取液基线干扰均较严重,而乙腈及乙酸乙酯提取后得到的图谱干扰较少(见图2)。实验进一步比较了乙腈及乙酸乙酯对饲料中地西泮的提取效率,结果显示:乙腈及乙酸乙酯的回收率均较低,在50%左右,可能与样品的状态有关,饲料为固态,水分含量极低,有机溶剂难渗透入饲料中,导致溶剂的提取效率低。水产饲料前处理过程中加入纯水可使饲料溶解于水中,有助于目标物从饲料中释放出来并溶解于有机溶剂中,增大萃取效率。然而实验时发现,乙酸乙酯萃取水溶解的饲料样品时易乳化,不利于样品的萃取,乙腈萃取时无乳化现象,涡旋振荡后加入盐析剂促使有机相与水相分层,溶于水中的目标物转溶于乙腈中,有效提高了目标物回收率(93.8%)。因此本试验选用乙腈为提取溶剂,并在前处理过程中加入纯水以提高乙腈的萃取效率。
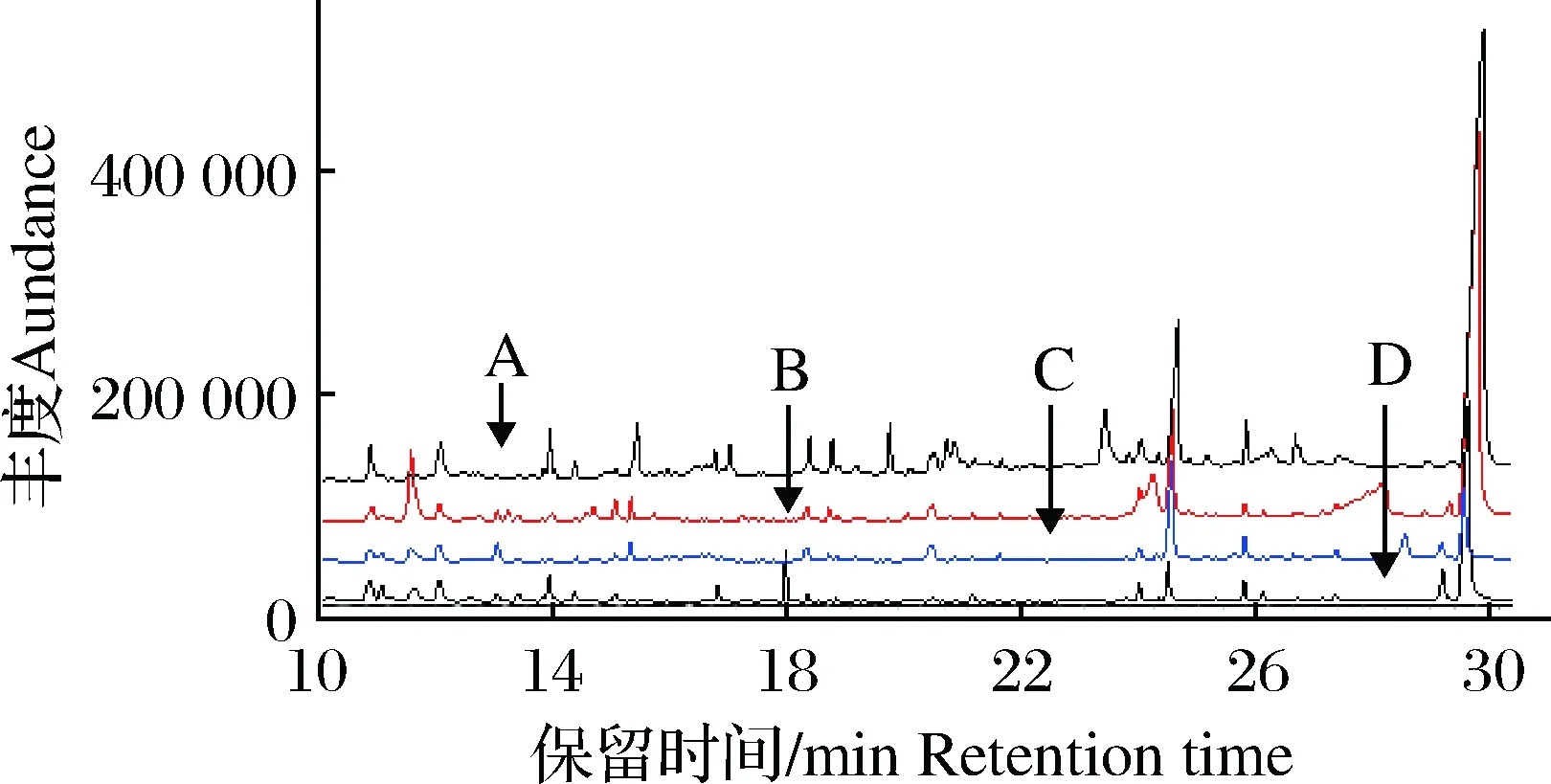
图2 不同溶剂对饲料中杂质提取效果的比较注:A为甲醇;B为乙酸乙酯;C为乙腈;D为正已烷/二氯甲烷(v∶v=7∶3)Fig.2 Comparison for extraction effects of different solvents on impurities in feedNote: A was methanol; B was ethyl acetate; C was acetonitrile; D was n-hexane/dichloromethane (v/v=7∶3)
2.5 净化条件的优化
QuEChERS方法的核心是寻找能够吸附杂质的吸附剂。水产饲料由玉米、鱼粉、维生素、氨基酸等微量元素组成,基质成分复杂,富含蛋白质、脂肪、有机酸、色素等杂质,为达最佳净化效果,吸附剂的选择至关重要。常用吸附剂有C18粉、中性氧化铝、佛罗里硅土、PSA、石墨化碳(GCB)等,其中C18粉、中性氧化铝及佛罗里硅土能去除脂肪、油脂等干扰物,石墨化碳(GCB)可去除色素、固醇类等,PSA可去除提取液中的有机酸、脂肪酸和极性色素等水溶性杂质。
考虑到饲料基质复杂,仅使用一种吸附剂难达到理想的净化效果,因此本研究采用复合吸附剂净化样品。首先以配合饲料为切入点筛选适用的吸附剂,再优化吸附剂的配比。结果显示:中性氧化铝粉、PSA、GCB对配合饲料基质的净化效果均较好,净化效果也各有不同,且200 mg中性氧化铝粉、200 mg PSA及50 mg GCB对地西泮均无吸附。之后实验在PSA(50~200 mg)、中性氧化铝粉(50~200 mg)、GCB(20~50 mg)范围内优化各吸附剂的用量,发现50 mg与200 mg PSA的净化效果相当;中性氧化铝为200 mg时净化效果最佳;而提取液的颜色随GCB含量的增加变浅,加入量为50 mg时,提取液中色素可被完全吸附,本实验暂定吸附剂组合为中性氧化铝200 mg+PSA 50 mg+GCB 50 mg,并将其用于净化配合饲料、浓缩饲料和预混饲料,但色谱图显示地西泮定量离子256处有干扰峰,回收率偏低(小于60%),调研时发现饲料生产过程中需加入磷脂提高其抗氧化性并延长保质期,但方法采用的吸附剂均不吸附磷脂。二氧化锆颗粒能吸附磷脂降低基质干扰[23],本研究将其加入复合吸附剂中并重新考察了复合吸附剂的净化效果(表1)。
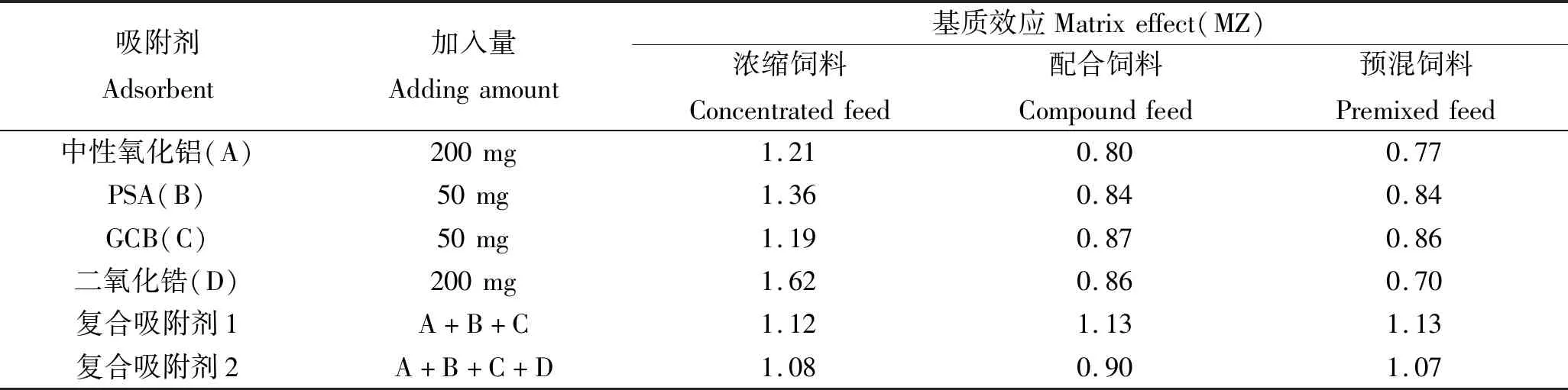
表1 不同吸附剂对不同基质的净化效果Tab.1 Purification effects of different adsorbents on different substrates
由表1可见,复合吸附剂对饲料基质的净化能力优于单一吸附剂,其中复合吸附剂2的净化效果最佳,基质效应最小,提取液经复合吸附剂2净化后,溶液变得清澈透明,色谱图基线噪音变小,地西泮定量离子256处干扰峰消除(图3),回收率在86.3%~104.5%之间。最终确定吸附剂的组合为中性氧化铝200 mg+二氧化锆 200 mg+PSA 50mg+GCB 50 mg。
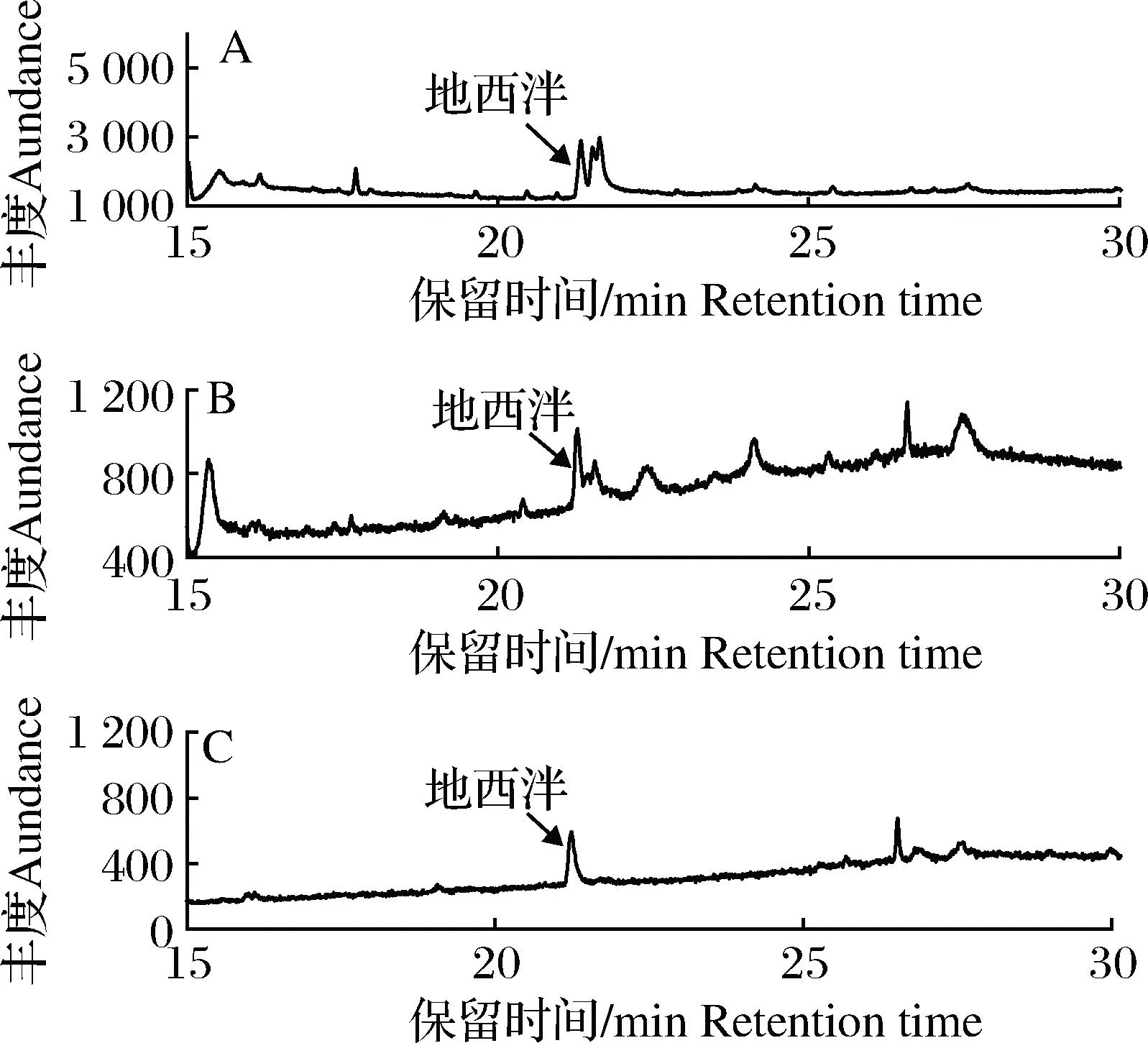
图3 不同吸附剂对饲料基质的净化效果比较注:A为未净化提取液;B为复合吸附剂1净化后提取液;C为复合吸附剂2净化后提取液。Fig.3 Comparison for purification effects of different adsorbents on feed matrixNote: A was the unpurified extracting solution; B was the purified extracting solution by composite adsorbent 1; C was the purified extracting solution by composite adsorbent 2.
2.6 方法验证
2.6.1 基质效应(ME)
研究采用1.5节描述对配合饲料、浓缩饲料和预混饲料的基质效应进行评价。结果显示:地西泮在3种饲料中的基质效应在0.90~1.08 之间,表明方法对饲料的净化效果较好,基质干扰程度较低,但为提高定量准确性,需对其基质效应进行校正。校正基质效应的方法有标准加入法、基质匹配标准曲线法、同位素内标法、稀释上机液法及基质匹配内标法等[22,24 ],其中基质匹配内标法可同时校正基质效应及回收率,具有操作简便、定量准确的优点,因此本研究采用基质匹配内标法消除基质效应的影响。
2.6.2 线性范围、检出限与定量限
按1.2节配制标准曲线,在选定的色谱条件和质谱参数下测定分析,以目标物定量离子峰面积和相应内标物定量离子峰面积之比(y)为纵坐标,以目标物浓度(x)为横坐标,绘制标准曲线,分别以3倍和10倍信噪比确定方法检出限(LOD)和定量限(LOQ)。结果显示地西泮在5~500 μg/L线性范围内,线性良好,线性方程为y=0.019 6x-0.116 4,线性相关系数(r2)为0.999 2,检出限为0.05 mg/kg,定量限为0.2 mg/kg, 方法检出限远低于标准NY/T 934—2005《中华人民共和国农业行业标准 饲料中地西泮的测定 高效液相色谱法》的方法检出限1 mg/kg[16]。
2.6.3 精密度与回收率
选择空白配合饲料、浓缩饲料及饲料添加剂开展加标回收实验,分别向实验样品中添加低、中、高(0.15、0.25、0.50 mg/kg)3个水平的地西泮标准溶液,每个添加浓度设6个平行,并做空白实验,计算回收率和相对标准偏差。结果见表2,方法加标回收率为86.3%~104.5%,相对标准偏差为1.4%~7.8%,说明方法的准确度与精密度较好,能满足国家标准GB/T 27404—2008《中华人民共和国国家标准 实验室质量控制规范 食品理化检测》[25]中实验室质量控制规范,加标量为0.50 mg/kg的预混饲料加标色谱图见图4。
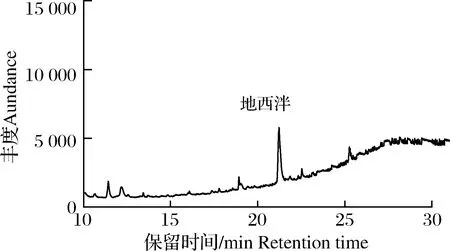
图4 预混饲料加标TIC图Fig.4 TIC diagram of spiked premixed feed
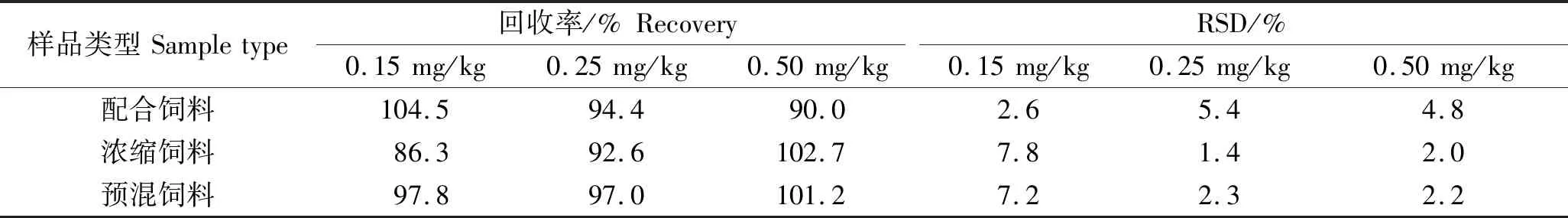
表2 水产饲料中地西泮的加标回收率和相对标准偏差Table.2 Spiked recoveries and relative standard deviations (RSDs) of diazepam in aquatic feed n=6
2.7 实际样品分析
采用本研究建立的分析方法对20批次配合饲料样品、5批次浓缩饲料样品及5批次预混饲料样品进行检测,以上样品主要采集于市场、饲料厂及水产养殖基地,其中1批次配合饲料样品检出地西泮,含量为273 μg/kg(图5),表明水产饲料中存在违规添加地西泮的问题。

图5 配合饲料TIC图Fig.5 TIC diagram of compound feed
3 结论
本研究建立了QuEChERS-气相色谱质谱法测定饲料中地西泮残留。该方法具有灵敏度高、净化效果好、操作简单、精密度和准确度高等优点,与国标法NY/T 934—2005相比,极大提高了检测效率,完成一次前处理仅需30 min,适用于批量样品中地西泮残留的测定,且方法所需仪器设备价格适中,便于该方法在基层检测机构推广,可为政府加强水产养殖用投入品监管提供技术支撑,以应对日益突出的药物残留安全风险的监控与监管工作需求。
