同位素异位体溯源土壤N2O的方法、技术和展望①
2022-07-22曹亚澄张珮仪张金波蔡祖聪
徐 锦,曹亚澄,2*,温 腾,3,4,5*,张珮仪,张金波,3,4,5,蔡祖聪,3,4,5
同位素异位体溯源土壤N2O的方法、技术和展望①
徐 锦1,曹亚澄1,2*,温 腾1,3,4,5*,张珮仪1,张金波1,3,4,5,蔡祖聪1,3,4,5
(1 南京师范大学地理科学学院,南京 210023;2 中国科学院南京土壤研究所,南京 210008;3 江苏省地理信息资源开发与利用协同创新中心,南京 210023;4 虚拟地理环境教育部重点实验室(南京师范大学),南京 210023;5 江苏省地理环境演化国家重点实验室培育建设点,南京 210023)
土壤是N2O的重要排放来源之一。土壤中N2O产生途径众多、受多种因素调控,深入分析土壤N2O产生途径才能采取针对性的减排策略。稳定同位素技术已广泛用于研究土壤N2O排放,N2O同位素异位体法是近年来新兴的研究方法。该研究方法通过测定土壤N2O的同位素组成(15NSPN2O、18ON2O和15NbulkN2O)分析N2O排放贡献,因无需添加标记物、对土壤系统干扰小、成本低,适合在野外田间研究N2O排放,是15N标记方法的有力补充。本文详细介绍了N2O同位素异位体法的原理、质谱测定方法、定量分析方法、影响该方法的因素及其应用前景。
N2O同位素异位体;位点优势值;N2O排放贡献;同位素比值质谱
鉴于对全球气候变化的关注日益增加,促进温室气体减排已成为热点研究问题。氧化亚氮(N2O)作为《京都协定书》规定的6种温室气体之一,不但会进入平流层破坏臭氧层[1],还会吸收红外线造成温室效应[2],等摩尔浓度N2O的增温潜势是二氧化碳的298倍[3],且以每年0.73 nmol/mol的速率增加[4]。N2O在大气中的存在寿命约为118 ~ 131 a[5],对全球增温具有长期潜在深远的影响。据报道,目前全球的总N2O排放量为17.9 Tg/a,在众多N2O排放源中,农业管理以及自然植被下的土壤构成了全球最主要的N2O来源,其中自然植被土壤N2O 排放量为6 ~ 7 Tg/a,占自然来源的60%,农田土壤N2O排放量为4.3 ~ 5.8 Tg/a,占人为来源的69%[5]。因此,准确估算土壤N2O排放量对于实现全球范围内N2O的减排具有重要意义。但是土壤N2O排放受多种微生物和非微生物途径的影响,时空异质性显著,土壤氮转化过程极其复杂并具有多种N2O产生途径[6],只有深入溯源分析土壤N2O产生途径才能采取针对性的减排策略,减少大尺度N2O排放量估算的不确定性[7]。
N2O的主要产生过程有反硝化、羟胺氧化、硝化细菌反硝化等[7]。反硝化过程是在无氧或者微氧的条件下,微生物将NO3–、NO2–或者N2O还原为、NO2–、NO、N2O或N2,N2O是反硝化过程的中间产物,在某些条件下是主要最终产物(如:真菌反硝化过程)[8]。羟胺氧化过程中N2O是不同形态氮氧化形成NO3–的副产物,包括自养硝化和异养硝化,其中自养硝化主要由氨氧化细菌、亚硝态氮氧化细菌驱动[9],将NH4+或NH3经过NO2–氧化为NO3–的过程;异养硝化主要是由一些具有异养硝化能力的真菌和细菌,将有机氮或者NH4+氧化为NO3–的过程。硝化细菌反硝化也是由氨氧化细菌驱动,但有别于自养硝化,是NH4+氧化产生的NO2–进一步还原为N2O和N2[7]。此外,硝酸盐异化还原为铵过程(DNRA)、化学反硝化过程也产生N2O[10],但一般认为这些过程对于全球N2O排放的贡献较小[6]。
迄今为止,不少科学方法已广泛应用于土壤N2O产生途径的区分和溯源研究中,主要包括15N通量法[11]、抑制剂法以及稳定同位素法。其中通量法和抑制剂法最早用于区分N2O产生来源,但通量法无法明确N2O产生的过程[2],抑制剂法常常因为微生物所处生长阶段不同而无法完全抑制。近年来稳定同位素技术发展迅速,同位素标记技术(15N标记)和自然丰度技术(18ON2O、15ObulkN2O)开始被广泛用于区分土壤N2O产生途径[12-14]。15N标记与数值模型的结合实现了对于土壤N2O产生途径的量化研究,它能同时结合土壤氮转化过程初级转化速率和含氮气体排放的计量变化,全面研究土壤氮转化和N2O产生途径。近期开发的土壤–植物15N示踪模型,更能为量化土壤–植物系统的氮转化过程和氮转化率问题提供可靠方法。与同位素标记技术相比,自然丰度技术也早已用于土壤氮素转化过程的研究[15],但在复杂的生态系统中应用15N自然丰度法,易受到氮在库与库之间转化过程中的同位素分馏作用的限制,其定量程度处于较低水平[2]。近年来,一种通过测定N2O同位素异位体及两个N原子间15N位点优势值(SP: site preference,15OSPN2O)的新方法[16],已被广泛应用于土壤、海洋的N2O溯源分析。与15N标记法和抑制剂法相比,它对原有系统的干扰小,更适合用于野外大尺度研究;与传统自然丰度技术相比,它在N2O产生过程中不受底物的同位素组成影响。而且不同的N2O产生过程,15OSPN2O具有一定的差异性[16-17];15OSPN2O与18ON2O、15ObulkN2O值结合,还能为N2O产生途径的溯源分析提供更多信息,在适合的同位素数值模型辅助下,可实现大田和区域尺度上量化土壤N2O各产生途径的排放贡献。
1 N2O的同位素异位体和位点优势值
国际纯粹应用化学联合会(The International Union of Pure and Applied Chemistry, IUPAC)于2011年将一组被重同位素取代的数量不同或者被重同位素取代的位置不同的分子,定义为同位素异位体(isotopocule),它是“isotopically substituted molecules”的缩写。因为每种元素往往有不止一种稳定同位素,所以一种化合物通常具有多种不同的同位素异位体[18]。N2O分子是一个由一个O原子和两个N原子形成的三原子非对称直线型结构,其中N元素有14N、15N两种稳定同位素;O元素有16O、17O、18O三种稳定同位素,理论上,N2O分子有12种同位素,但实际上自然丰度表现出明显差异的同位素异位体仅5种[19]。
由于N2O是一个不对称分子,位于中心和末端的N原子被称为α-N和β-N[18]或者1-N和2-N[20],也有用456和546来表示N2O的两个重要的同位素异位体14N15N16O和15N14N16O[21]。在N2O形成过程中,两个NO–会结合形成次硝酸盐状中间体(–O–N=N–O–)[17],随后一侧的N–O键断裂形成N2O分子,断键侧的N原子位于β位,未断键侧的N原子位于α位;而在N2O还原为N2的过程中另一侧的N–O键也断裂形成N2。由于较重的同位素原子移动性较弱具有较高的结合能(如15N–16O键相较于14N–16O键结合能更高,所以14N–16O键更易断裂),且土壤微生物和酶对于N–O键的断裂也有影响,所以在N2O的产生和还原过程中两次断键的差异,可能会导致15N在两个N原子上的分布差异[22],这个差异就称为位点优势值。在N2O分子中15Nα、15Nβ、15Nbulk和15OSPN2O值之间的换算关系如下[18]:

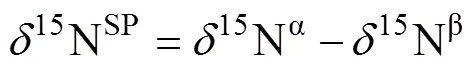
式中:15Nbulk表示两个N原子上的15N丰度的平均值;15Nα和15Nβ分别表示中心和末端N原子上的15N丰度。
在生成N2O的过程中,由于各个途径受到不同微生物和酶调控的影响,产生的15OSPN2O值也会存在差异,这些差异可为溯源分析土壤N2O产生途径提供理论基础。
2 同位素异位体方法溯源N2O产生途径的基本原理
稳定同位素方法进行溯源研究的主要依据是,任何一种元素的同位素组成都可以提供来源和形成过程信息。有关来源的信息往往依赖于元素本身独特的同位素组成,所以在传递过程中具有特征性,而包含形成过程的信息往往受同位素分馏作用的影响在传递过程中容易丢失而丧失过程特征性[22]。但是,体现N2O分子中15N在两个N原子上分布差异的15OSPN2O不受基质同位素组成的影响,且在N2O产生过程中15OSPN2O可以保持不变,这一特点使得15OSPN2O成为溯源N2O产生途径的一个重要指标[23]。
Sutka等[24]率先通过纯培养试验发现,自养硝化过程和细菌反硝化过程产生N2O的15OSPN2O存在特征性且差异明显,这一发现在野外和土壤培养试验中多次被证实。之后,又发现真菌反硝化和细菌反硝化的15OSPN2O也存在明显差异[25]。表1是目前基于纯培养试验得到的不同产生途径N2O的15NbulkN2O、18ON2O和15OSPN2O值,可以发现不同N2O产生途径的15OSPN2O值大致可以分为两大类:第一类是硝化细菌反硝化和反硝化途径(简称N2OD),数值较小,一般在–5.4‰ ~ 2.2‰;第二类是自养硝化、真菌反硝化、化学反硝化和AOA等途径(简称N2ON),数值较大,一般在28.8‰ ~ 36.8‰[16]。15OSPN2O值的这种差异与N2O产生过程的酶调控机制有关。以NH2OH氧化还原酶(HAO)和NO还原酶(NOR)为例,二者都包含血红素或非血红素铁(Fe)原子的催化中心。HAO酶具有一个中心Fe原子[36],在N2O形成过程中NH2OH分子顺序与同一个Fe原子中心结合,最终产物N2O中的中心(α)和末端(β)N原子分别来自第二个和第一个结合的NH2OH分子,因同位素分馏效应,第二个结合的NH2OH分子中15N较第一个结合的NH2OH分子富集,因此该过程产生N2O的15OSPN2O值较大。然而细菌NOR酶具有两个Fe原子(双核中心)且酶之间具有相似性[37],两个NO分子可同时与之结合形成次硝酸盐状中间体(–O–N=N–O–),因产生N2O分子的两个N原子几乎同时形成,15OSPN2O值接近于零。真菌NOR酶(P405)的催化中心仅具有单个Fe原子[37],两个NO分子只能顺序与催化中心结合,因此存在与HAO酶类似的现象,N2O的两个N原子上的15N差异明显,15OSPN2O值较大[17]。

表1 不同N2O产生途径的δ15NbulkN2O、δ18ON2O和δ15OSPN2O值
注:异养硝化的数值来源为本课题组纯培养试验未发表数据。
3 N2O同位素异位体的δ15NSPN2O、δ18ON2O和δ15NbulkN2O值的质谱测定方法
N2O同位素异位体的测定方法早在1974年就有研究涉及,随后Yoshida[6]首次全面描述了质谱测定N2O同位素异位体的方法。质谱分析法是运用质谱仪器分析某种元素稳定同位素比值特征的方法,广泛应用于农业、环境和生态等领域的研究中。质谱仪由进样系统、离子源、质量分析器、离子接收器、真空系统和计算机系统组成。样品气体在离子源中被灯丝发射的慢电子轰击后,电离形成具有一定能量的离子束,在加速电压作用下,带电离子(带电的原子、分子或分子碎片)以一定速度进入质量分析器的磁场,根据洛伦兹定律,在电场和磁场的共同作用下,带电离子因质量数和所带电荷数之比()不同而分离,被对应法拉第杯接收后,根据检测到的离子类型和束流强度,实现对样品气体某种元素的同位素比值及其组成的测定。
N2O同位素异位体的测定,可通过在质谱仪上配备能同时接收为44的[14N14N16O]+,为45的 [14N15N16O]+、[15N14N16O]+、[14N14N17O]+和为46 的[14N14N18O]+等分子离子,以及为30的 [14N16O]+和为31的[14N17O]+、[15N16O]+等碎片离子的接收杯(图1),实现一次进样在NO和N2O两种模式得到15N、18O和31NO的值,再经一系列换算,计算得到15Nα、15Nβ和15OSPN2O[17-18]。
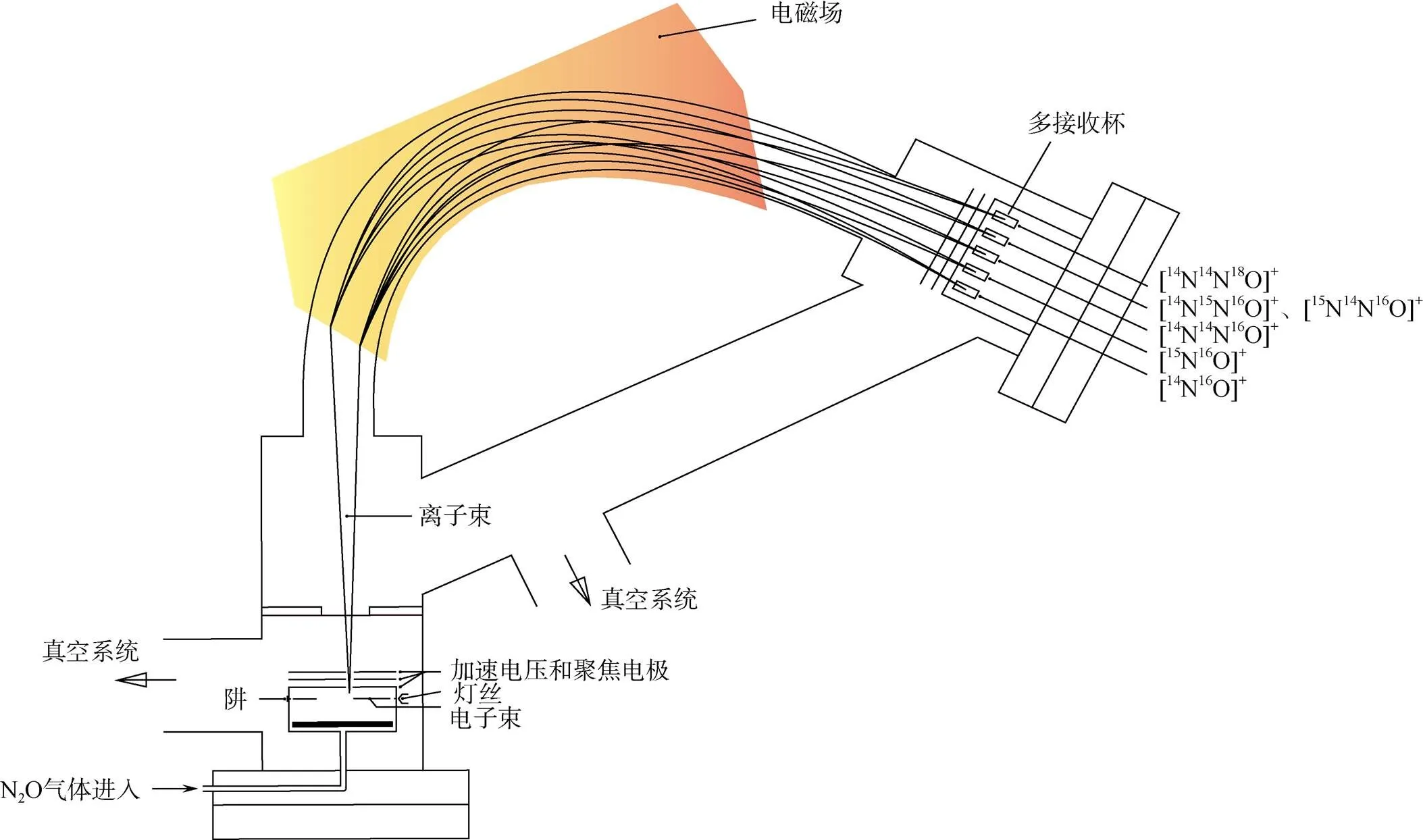
图 1 五杯模式的稳定同位素比值质谱仪示意图
3.1 质谱离子源工作条件优化
N2O气体在离子源中,经慢电子轰击后,主要形成[N2O]+分子离子和少量以NO+为主的碎片离子。由于这两类离子所需的最优离子源条件可能不同,NO+的产率不高([NO]+/[N2O]+=1/3),为保证测定结果的稳定性和精密度,需优化离子源条件,来适当提高NO+的产率,保证测定结果的稳定性和精密度。改变质谱仪器的聚焦参数、离子源的电子能量和电离室内的气压强等可以调整离子源的工作条件。质谱仪器的聚焦参数可通过仪器的自动聚焦(autofocus)功能实现,也可手动调节离子源的emission、trap等参数。电子能量变化对[N2O]+分子离子和NO+碎片离子的产率均有显著影响(表2),而且不同质谱仪器上电子能量的高低对N2O气体的离子谱影响并不一致:Toyoda和Yoshida[18]发现MAT-252质谱仪上,测定NO+离子的最优电子能量为70 ~ 86 eV,而本课题组使用的是Delta V Plus质谱仪,当电子能量低于100 eV会导致NO+的产率过低(表2),造成测定结果不准确(表3)。
3.2 重排因子测定
N2O在离子源中会发生重排,所形成的[NO]+离子的N原子主要来自α-N,部分来自β-N[18],引起这种重排效应的原因目前尚不明确,推测与N2O+受电子轰击后形成NO+的途径有关。准确测定N2O的同位素异位体,需要确定重排因子,它通常不受样品浓度和丰度影响,取决于所使用的质谱仪器和离子源条件,同一台质谱仪器在离子源条件发生变化后(如:更换灯丝)需要重新测定重排因子。Toyoda和Yoshida[18]、Westley等[38]发现在MAT-252、253质谱仪上重排因子大约为0.07 ~ 0.09,即[NO]+离子中有7% ~ 9% 是来自β-N;而Sutka等[24,26]发现IsoPrime质谱仪的重排因子可达19.5%。
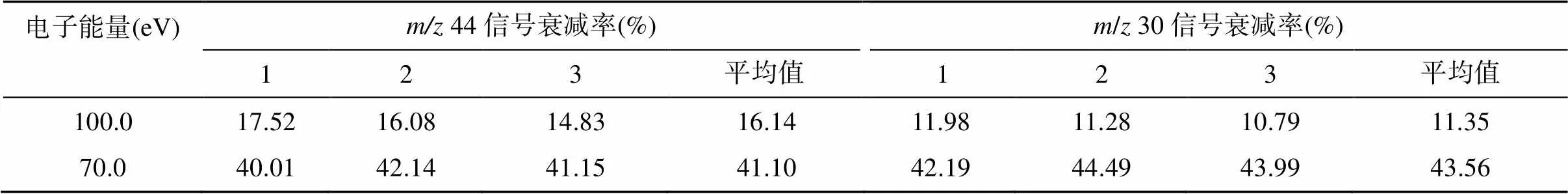
表2 电子能量变化对离子流强度的影响
注:信号衰减率均以124 eV的离子流强度为基准计算。
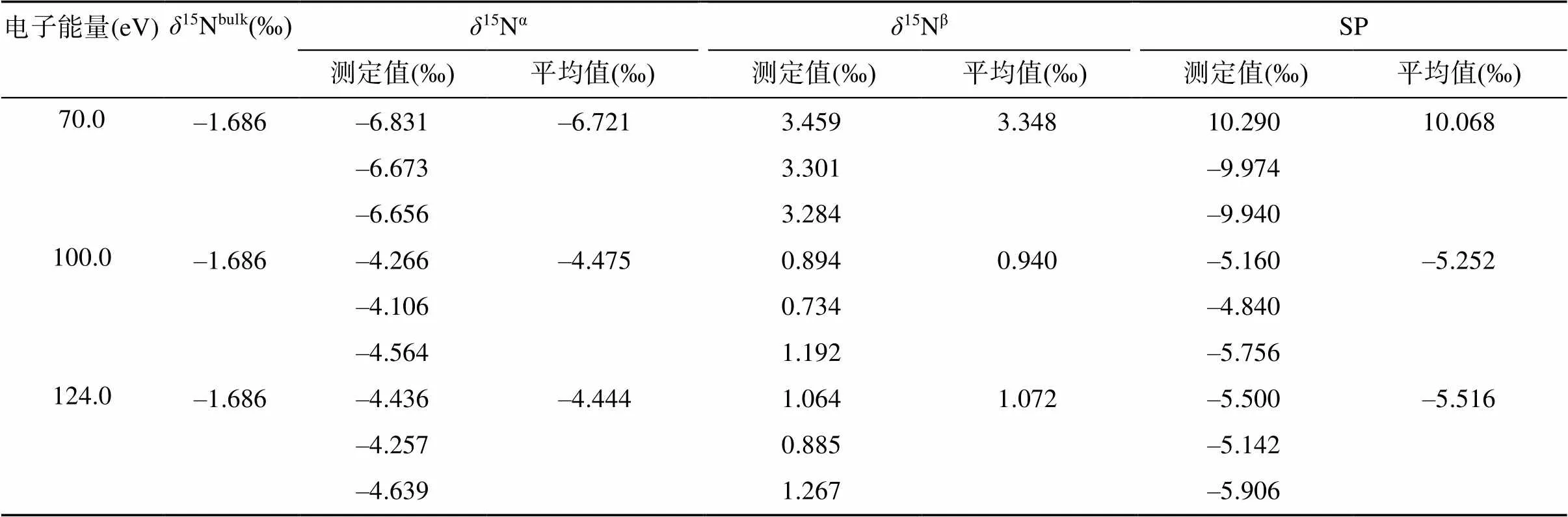
表3 电子能量变化对N2O同位素异位体测定值的影响
质谱仪器重排因子的测定一般可通过NH4NO3热解法和标记气体混合法实现[18]。NH4NO3热解法是将不同丰度的NH415NO3和15NH4NO3加热分解生成不同丰度的N2O气体,由于分解形成的N2O中α-N都来自NO3-N,β-N都来自NH4-N,因此可制得一系列已知丰度的15NNO和N15NO气体。将这些气体在质谱仪上的测定值与其理论值绘制成一条直线,直线的斜率即为重排因子。标记气体混合法是通过购买市售的高丰度高纯15NNO和N15NO气体(>99 atom%),将其与自然丰度的工作标准N2O气体(0.3663 atom%)混合,即可制得一系列已知丰度的15NNO和N15NO气体,再将测定得到31R值与45R值绘制成一条直线,斜率即为重排因子。这两种方法中,NH4NO3热解法得到的重排因子更为准确,但操作非常繁琐,需使用特制的热解装置,而标准气体混合法操作相对简单,目前大部分研究人员仍然选择使用标准气体混合法测定重排因子[39–41]。本课题组使用的Delta V Plus质谱仪,通过标记气体混合法测定的重排因子为0.085,这一结果与Toyoda和Yoshida[18]、Well等[40]、 Mohn等[42]报道过的结果(0.08 ~ 0.09)一致。
3.3 N2O工作标准气体的校准
由于长期缺乏N2O国际标准气体,如何在不同实验室内准确校准N2O工作标准气体,一直是困扰研究人员的难题。虽然NH4NO3热解生成的已知丰度的N2O气体能够实现工作标准气体的校准,但这一方法操作较繁琐,还需要特殊的热解装置,很难在每个实验室内单独实现。在国外学者的努力下,美国地质勘探局2016年开始提供USGS51和USGS52两种国际标准品(表4),研究者可直接购买标准品完成工作标准气体的校准。需要注意的是,不同实验室对USGS51和USGS52的比对测定结果显示,15OSPN2O值的测定误差较大,因此在日常测定工作中应采用两点校正,减少测定误差[42]。可以直接使用USGS51和USGS52进行两点校正,也可以使用能覆盖样品15OSPN2O值范围的实验室自制标准气体进行两点校正。

表4 N2O国际标准品USGS51和USGS52(‰)
注:表中数据来源于https://isotopes.usgs.gov/lab/referencematerials.htm。
3.4 其他测定问题
N2O同位素异位体的准确测定对质谱仪器的稳定性要求较高。在实际工作中发现,极少量溶于水的CO2会生成[CO]+,干扰[NO]+的准确测定,因此需经常更换微量预浓缩装置中的除水和CO2的化学阱,也可将化学阱分成除水、除CO2两部分,分别单独更换,既节约试剂又提高效率。样品气体中如果杂质太多,会在色谱柱中逐渐累积,干扰测定结果,加大烘烤色谱柱的频率,或在样品测定完成后反吹色谱柱,有助于去除杂质。对于和N2O信号过于靠近的杂质峰,可通过降低流速和色谱柱温度,实现有效分离。使用稳定同位素比值质谱仪测定N2O同位素异位体时,N2O样品的信号高低,直接影响NO+碎片离子的产率,非线性问题会显著影响测定结果,常规的线性测试是通过一系列不同信号的矩形信号峰完成,而样品峰是瞬时信号,要准确实现对样品峰的线性校正,需要用同样峰形的标准气体,可通过在每一天运行样品N2O的前后,分别运行一组接近样品最高和最低浓度的N2O标准气体,标准气体尽量使用与样品同一体积的样品瓶,完成线性校正。
4.1 同位素指标的选择
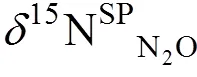
4.2 二源同位素混合模型
N2O的同位素组成指标结合同位素混合模型,可分析不同来源途径N2O的排放贡献。线性同位素混合模型,尤其是二源线性同位素混合模型(two- endmember isotope mixing model)是最常用的方法,它可用线性方程= a+ b表示,其中=15NSPN2O,=18ON2O。在二源同位素混合模型中,两个途径对N2O的排放贡献可通过同位素混合方程sample途径1×途径1途径2×途径2计算,途径1和途径2的值根据文献中不同N2O产生途径的纯培养试验数据得到相应范围,途径1和途径2表示两个途径对N2O的贡献率,途径1+途径2=1[44,46](图2)。二源同位素混合模型一次只能考虑两个来源[47],无法将所有N2O产生途径放入模型同时运行,需要对各途径两两进行场景假设分别定量分析。因为各产生途径的15NSPN2O可分为N2OD和N2ON两大类,可分别从两类中选择一个途径进行两两分析。
但是,在反硝化过程中,N2O会消耗还原为N2,随着还原进程的进行,15NSPN2O因分馏效应发生变化,需对这一过程进行校正,才能准确计算排放贡献[16]。N2O还原过程中15NSPN2O、18ON2O和15NbulkN2O的同位素效应变化较一致,分馏系数比率(red15Nsp/red18O或red15Nsp/red15N)十分稳定,可作为校正N2O还原过程影响的指标[40, 43-44]。首先,根据需要分析的两种N2O产生途径的15NSPN2O和18ON2O值,在样品值散点图上绘制出相应的端元值范围,运用Monte Carlo采样方法在取值范围内各取一个点连接得到混合曲线;其次以N2O还原为N2过程中15N和18O分馏因子的稳定比值(red15Nsp/red18O)为斜率,经过样品值点绘制出还原曲线的取值范围,再用Monte Carlo采样方法在范围内取一条曲线即为该样品点对应的还原曲线,还原曲线与混合曲线的交点即可区分两个途径对样品N2O的排放贡献[39-40,43](图2)。Lewicka-Szczebak等[41]和Wu等[48]发现,在实际土壤中N2O还原为N2过程还存在两种可能(图3):一是还原–混合过程(R-M),即N2O先还原后混合的过程,首先细菌反硝化途径产生的N2O部分还原为N2,剩余未还原的N2O与硝化、真菌反硝化途径产生的N2O混合;二是混合–还原过程(M-R),即N2O先混合后还原的过程,各个途径产生的N2O先混合,接着部分N2O还原为N2。他们进一步提出了Mapping approach校正N2O还原为N2过程的方法,假设该体系为封闭体系,根据Rayleigh分馏方程进行校正(公式(10))。以第一种情况为例,在线性混合模型中还原曲线和混合曲线可分别用公式(3)、(4)表示,根据公式(5) ~ (7)代入两个途径的15NSPN2O和18O值后,可得还原曲线的截距bred、混合曲线的斜率amix和截距bmix。整合还原曲线和混合曲线的方程(公式(3)、(4)),可得到二者交点的15NSPN2O和18ON2O值(公式(8)、(9))。
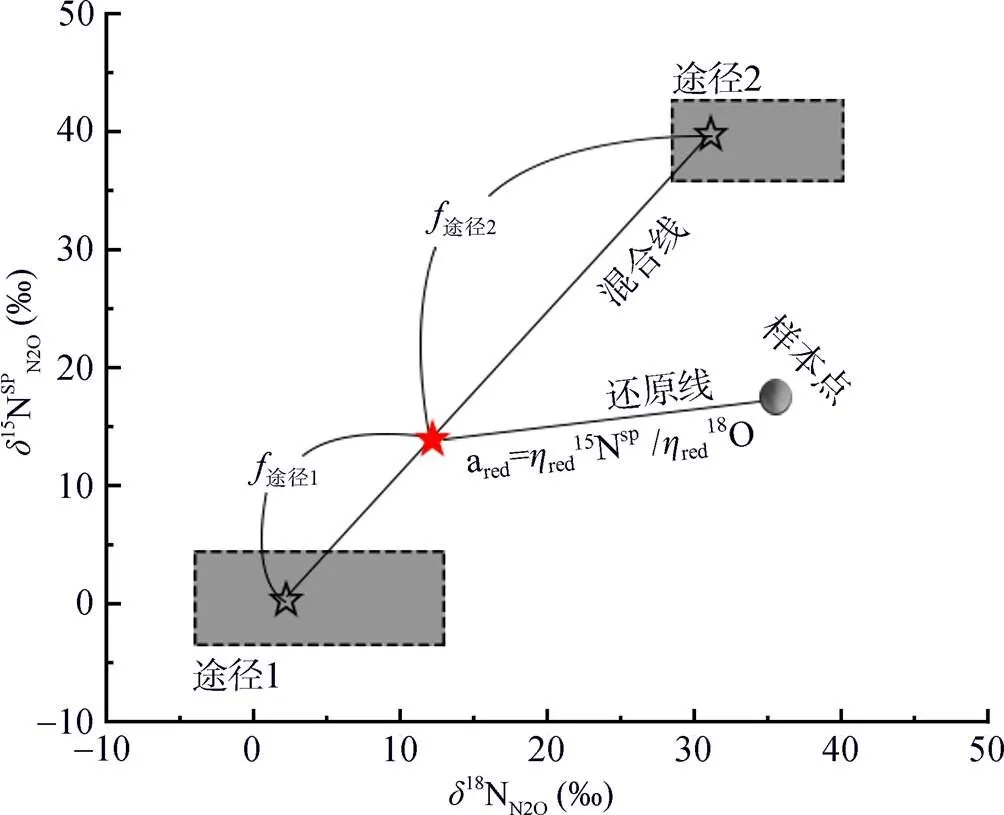
图 2 二源同位素混合模型概念图
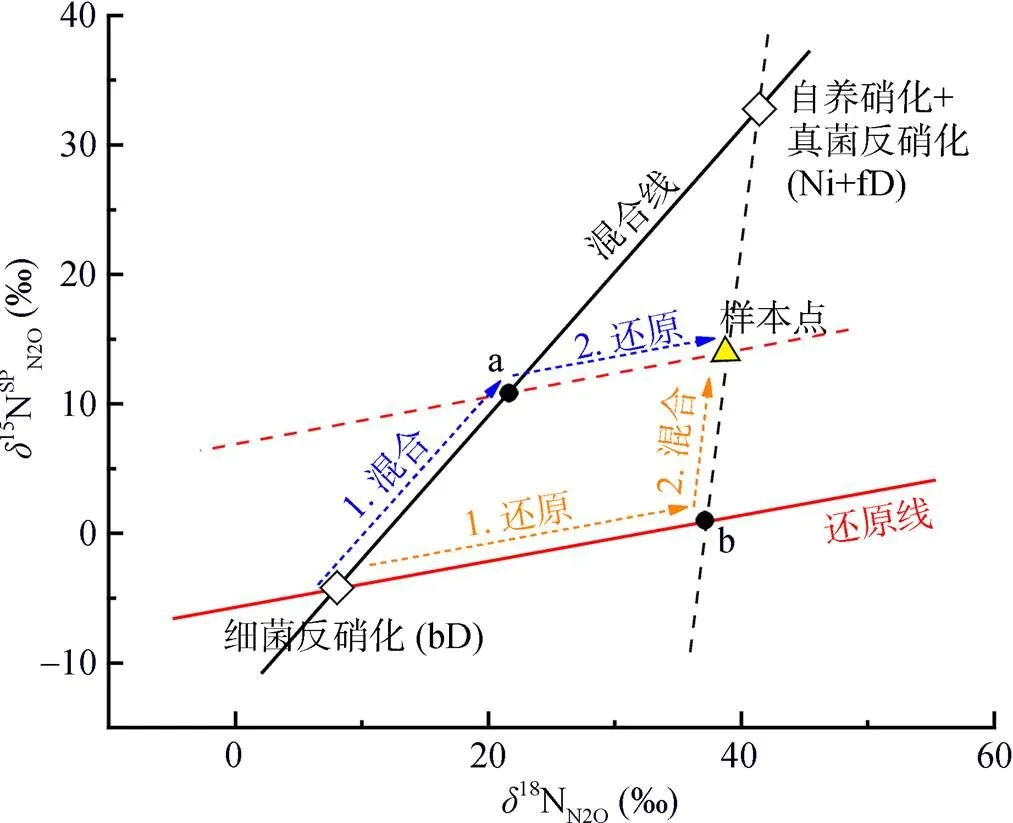
(场景1(蓝色虚线):混合–还原过程(M-R);场景2(黄色虚线):还原–混合过程(R-M);a点截距:还原前各个途径产生的混合N2O;b点截距:细菌反硝化途径产生的N2O部分还原为N2后残余的部分)

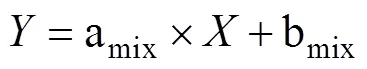

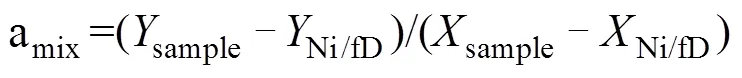
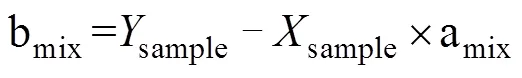


式中:ared是15NSPN2O值和18O的分馏系数之比(red15Nsp/red18O),该比值稳定在2.4 ~ 2.6;=15NSPN2O,=18ON2O;对于细菌反硝化过程,bD是细菌反硝化过程的15NSPN2O值,bD是细菌反硝化过程的18ON2O值,同理Ni/fD和Ni/fD分别是硝化或真菌反硝化过程的15NSPN2O和18ON2O值;int、int分别为还原曲线和混合曲线交点的18ON2O和15NSPN2O值。
最后,依据Rayleigh分馏方程,未还原的N2O比例(N2O)和细菌反硝化过程的贡献(bD)可以通过公式(10)~(11)计算得出。
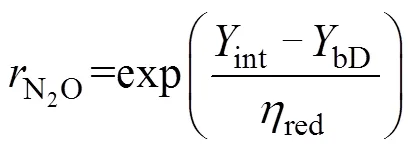
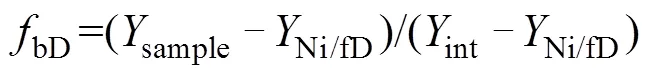
同理,第二种场景假设的计算方法与此类似,具体可参照Wu等[48]文章的附录。对比预测结果和实测结果发现,一般来说还原–混合过程的场景假设其估计值和观测值之间更加契合[39,48–50],但也有研究对比标记试验结果发现,部分土壤类型中混合–还原过程场景假设的结果与观测值之间更加吻合[41,51]。
总之,二源同位素混合模型可针对场景假设中两种N2O产生途径计算相对贡献,自此基于N2O同位素异位体同位素特征值的溯源分析方法开始向半定量化推进。但是,简单的二源同位素线性混合模型一次所能区分的N2O产生途径有限,只能进行多次场景假设,在样本量和产生途径较多的情况下难以兼顾数据源的不确定性,可能产生较大误差。由于样本的同位素特征值来自于试验测定,存在一定的实验误差和系统误差。各N2O产生途径的源数据整理自文献中不同条件下的纯培养试验结果,变化范围较大,如果将整个范围代入,与特定试验条件下的实际范围相比也存在一定偏差。Buchen等[39]尝试将源数据范围全部代入计算,均发现结果的不确定性较大。这种情况下,使用二源同位素线性混合模型难以准确量化N2O排放贡献。
4.3 贝叶斯同位素混合模型
同位素混合模型不仅包括线性混合模型,也有近年来发展迅速的基于贝叶斯统计的同位素混合模型(如:SIAR、MixSIR等),在R语言的辅助下,已逐渐应用于生态、地质等领域中食物贡献率、水分贡献率溯源分析。其中,SIAR发展最早,它能考虑多种来源数据的不确定性和先验信息,而MixSIR在样品混合物取值非常稳定时结果更可靠,但是样品值的微小变动容易引起贡献率结果波动[52]。2018年Stock等[47]综合SIAR模型和MixSIR模型二者优势,在考虑多种源不确定性和先验信息基础上,加入了随机效应分类变量、残差和过程误差等开发出了MixSIAR模型,已被认为是最优的贝叶斯混合模型。虽然目前应用该模型的研究对象都不同,但均是用于量化不同源对于混合物(最终产物)的贡献,该模型基于R语言实现,通过为每个源和混合物定义均值和方差参数,从而将源同位素值的不确定性纳入模型[53]。2020年Lewicka-Szczebak等[51]首次提出基于贝叶斯的三源同位素值混合模型(3DI模型),同时使用15NSPN2O、18ON2O和15NbulkN2O三种同位素特征值,虽然15NbulkN2O值变异性很大但依然包含了重要信息,在同位素特征值个数不受限制的情况下,将其纳入模型的同位素特征值数据中,可为N2O的溯源分析提供更多科学依据,有助于提高分析方法的定量化水平。该模型的核心基于Moore和Semmens等[53]的工作并进行了进一步扩展,允许将输入数据的不确定性包括到模型中,即假设来自4个N2O产生途径(bD、nD、fD、和Ni)的源数据集(15NSPN2O、18ON2O和15NbulkN2O值)正态分布,多次测量构成单个样本后对其进行Monte Carlo积分,源数据的不确定性通过非归一化似然计算中的方差输入模型。3DI模型允许同时考虑N2O的4种产生途径,使用基于贝叶斯框架的稳定同位素混合模型确定最终贡献比例的概率分布。Lewicka-Szczebak等[51]比较了3DI模型、SP/O图(15NSPN2O–18ON2O)、SP/N图(15NSPN2O–15NbulkN2O)以及N/O图(15NbulkN2O–18ON2O)的分析结果,发现SP/O图和3DI模型的结果较一致,且与15N标记的试验结果较吻合,且在N2O还原作用的估算上更优于15N标记法;与SP/O图相比,3DI模型结果中的相关性分析更能保证贡献率结果的准确性;SP/N图则问题较大,输出结果难以解释。本课题在现有4个N2O产生途径基础上增加了异养硝化途径,使用3DI模型分析得到的 N2O排放贡献与15N标记方法基本吻合(未发表数据)。因此,3DI模型能够更加全面地估算各N2O产生途径的贡献和N2O残余比例N2O[41],可大幅提高基于自然丰度的土壤N2O溯源研究定量程度。
4.4 不同模型方法的优势与不足
在N2O同位素异位体方法的发展过程中,最初关注不同实验室间如何准确测定N2O的一系列同位素特征值15NSPN2O、18ON2O和15NbulkN2O,国际标准品USGS51和USGS52的出现解决了这一问题。随着更多N2O产生途径的同位素特征值的发现,研究人员重点关注如何定量不同N2O产生途径的排放贡献。从最初的仅根据N2O产生途径端元值简单划分,发展到二源同位素混合模型(SP/O或SP/N同位素混合模型)以及最新的贝叶斯同位素混合模型(3DI模型)等研究方法。
二源同位素混合模型,解决了只能通过15NbulkN2O端元值定性判断N2O排放来源问题,能半定量分析两种N2O产生途径的贡献比例。因其核心是线性方程,仅考虑两个N2O来源,在一定程度上限制了模型结果的准确性。但基于SP/N的二源同位素混合模型仍然广泛应用于水生生态系统的N2O排放研究,基于SP/O的二源同位素混合模型则主要应用在土壤生态系统中。不少研究人员开展了15N标记试验作为对比,证明二源同位素混合模型可以准确估算主要的N2O产生途径,还能准确量化N2O的还原比例[39, 48, 51]。
基于Python实现的3DI模型摆脱了N2O来源个数的限制,能同时对多个N2O产生途径进行定量分析,还提供了定量结果的不确定性分析,这也是运用同位素异位体方法研究N2O排放贡献的一大突破进展。但是这一方法仍处于起步阶段,还存在不足:①N2O产生途径源数据的不确定性。目前异养硝化、协同反硝化、DNRA等N2O产生途径的15NSPN2O、18ON2O和15NbulkN2O值尚不明确,尤其是与有机氮库有关的异养硝化途径对土壤N2O的排放贡献不可忽略,其在林地、草地和农田土壤中贡献率可达25% ~ 85%,已被证明是亚热带酸性森林土壤的主要N2O产生途径[54],亟需将其纳入源数据中,才能准确定量土壤N2O排放贡献。而且现有的各N2O产生途径源数据主要基于某几类典型微生物纯培养,在土壤微生物中所属功能群的比例小,源数据的准确性需要在不同类型土壤中反复验证。需要开展大量纯培养和土壤培养试验,建立源数据库,才能有助于评估不同生态系统、不同土壤类型中源数据的特点和差异。②定量方法的不确定性。土壤中N2O的各产生过程和N2O还原过程同时发生,二者之间存在复杂的相互作用[41,49]。在现有的同位素混合模型中,当N2O潜在来源增加时,任何一个来源贡献的不确定性也会增加[55]。不同类型土壤特点各异,土壤微生物群落结构差异大,15NbulkN2O和18ON2O值对不同反应底物同位素特征的依赖性大[44],3DI模型亟需在不同类型土壤中开展大量对比试验,通过15N标记结合数值模型的方法检验定量结果的准确性,调整模型中的参数计算方法和假设条件,如:针对实际研究体系的18ON2O计算方法,以及N2O还原为N2过程的假设条件。
5 同位素异位体方法溯源土壤N2O的应用和展望
基于N2O同位素异位体组成特征溯源土壤N2O排放贡献,主要依据对N2O产生和还原过程的同位素效应的理解[45]。从1999年Toyoda和Yoshida[18]建立质谱测定N2O同位素异位体的方法后,该方法的技术已发展成熟。近年来,激光光谱仪测定N2O同位素异位体的方法发展迅速,虽然质谱仪在18ON2O和15NbulkN2O的测定上有明显优势,但光谱仪对15NSPN2O值的测定更为稳定,且因其测定成本较低,适合野外实地工作,备受研究人员的青睐。但是,质谱仪所需气体量较小,可精确区分其他痕量气体的影响,能准确校正N2O浓度变化引起的非线性问题,所以目前仍然是主流测定方法。
许多学者已将同位素异位体方法应用到不同领域的研究中,Koba等[44]首次使用15NSPN2O、15NbulkN2O值,结合二源同位素混合模型,分析温带针叶林地区地下水的N2O排放贡献;Toyoda等[43]、Well等[40]在此基础上提出利用分馏系数比率(red15NSP/red18O或red15NSP/red15N)校正N2O还原过程的影响,分析了不同施肥处理下各作物种植土壤的N2O排放贡献;Zou等[46]运用这一方法,研究了茶园土壤的N2O排放贡献;Lewicka-Szczebak等[41]提出Mapping approach方法区分还原混合的先后过程,考察对N2O还原作用校正结果的影响;Buchen等[39]首次选择15NSPN2O和18ON2O两个指标来区分不同来源N2O排放贡献,指出土壤类型、处理条件等都会显著影响N2O排放产生途径的贡献,在研究涉及的两种土壤类型中,N2O还原为N2对同位素组成有不同影响,并据此对各个场景进行分析,得到其计算方法存在不确定性的结论[39]。
综上,N2O同位素异位体法可实现野外原位采集气体样品,经质谱仪或光谱仪分析得到数据,结合模型即能得到土壤N2O排放贡献,与15N标记方法相比受时空限制小,易于在大尺度的野外试验中推行,是极具潜力的新方法和新技术。虽然在定量分析上仍有不足,但经过不断完善发展,其已开始广泛应用于不同地区、不同土壤类型、不同处理条件下的N2O排放贡献分析,所以这一新兴的土壤N2O溯源分析方法的应用前景十分广阔。
1) 可与15N标记方法互为补充。N2O的同位素异位体方法能在较大的时空尺度上半定量或定量评估N2O的排放贡献,能区分细菌、真菌反硝化过程产生的N2O,还能定量N2O还原为N2的过程,有效弥补了15N标记方法的不足之处。
2) 可与DNDC等模型相结合。基于过程机理开发的DNDC生物地球化学模型被广泛用于估算区域尺度的N2O排放,将N2O的15NSPN2O、18ON2O和15NbulkN2O值引入DNDC模型,比较实际测定值和模型估算值,能有效率定模型参数、验证模型结果,量化区域尺度的N2O排放,为制定合理、有效的N2O减排措施提供科学依据[56]。
3) 可为解析N2O产生途径的生化机制提供信息。N2O的N、O同位素组成受其产生途径的生化机制调控,15NSPN2O值体现N2O两个N原子上的同位素组成差异,可作为N2O产生过程的分子机理的有力佐证。在细菌反硝化过程中,NOR酶如何催化产生N2O,曾有顺式(cis)和反式(trans)两种可能机制的争论,其较低的15NSPN2O值(–10‰ ~ 0‰)表明两个N原子上的15N组成差异不大,证明了反式机制的正确性[57-58]。这一发现推动了将N2O的同位素异位体(如:15N14N18O和14N15N18O)作为新型示踪剂,深度解析并量化N2O产生途径。
4)可尝试进一步建立更高精度的数值定量模型。目前的二源同位素混合模型在计算不同来源排放贡献的过程中存在明显局限性,如对源个数的限制等。而基于贝叶斯的数值模型能同时考虑N2O的不同产生和消耗途径,兼顾土壤异质性、土壤反应过程速率差异性和底物同位素组成差异性,但模型结果的精度还有待进一步提高,所以进一步完善以及尝试建立更高精度的数值模型将是该领域未来的研究重点之一。
[1] Solomon S D, Qin D, Manning M, et al. Climate change 2007: The physical science basis. Working group I contribution to the fourth assessment report of the IPCC[J]. Intergovernmental panel on climate change climate change, 2007.
[2] Baggs E M. A review of stable isotope techniques for N2O source partitioning in soils: Recent progress, remaining challenges and future considerations[J]. Rapid Communications in Mass Spectrometry, 2008, 22(11): 1664–1672.
[3] Ofipcc W. Climate Change 2013: The Physical Science Basis[J]. Contribution of Working, 2013, 43(22): 866–871.
[4] Sigman D M, Casciotti K L, Andreani M, et al. A bacterial method for the nitrogen isotopic analysis of nitrate in seawater and freshwater[J]. Analytical Chemistry, 2001, 73(17): 4145–4153.
[5] Clough T J, Müller C, Laughlin R J. Using stable isotopes to follow excreta N dynamics and N2O emissions in animal production systems[J]. Animal, 2013, 7: 418–426.
[6] Yoshinari T. Emissions of N2O from various environments-the use of stable isotope composition of N2O as tracer for the studies of N2O biogeochemical cycling[J]. Denitrification in Soil and Sediment. Federation of European Microbiological Societies Symposium Series, 1990, 56: 129–150.
[7] Wrage-Mönnig N, Horn M A, Well R, et al. The role of nitrifier denitrification in the production of nitrous oxide revisited[J]. Soil Biology and Biochemistry, 2018, 123: A3–A16.
[8] Zhang J B, Cai Z C, Cheng Y, et al. Denitrification and total nitrogen gas production from forest soils of Eastern China[J]. Soil Biology and Biochemistry, 2009, 41(12): 2551–2557.
[9] Zumft W G. Cell biology and molecular basis of denitrification[J]. Microbiology and Molecular Biology Reviews: MMBR, 1997, 61(4): 533–616.
[10] Smith M S. Dissimilatory reduction of 、NO2–to NH4+and N2O by a soilsp[J]. Applied and Environmental Microbiology, 1982, 43(4): 854–860.
[11] Baily A, Watson C J, Laughlin R, et al. Use of the15N gas flux method to measure the source and level of N2O and N2emissions from grazed grassland[J]. Nutrient Cycling in Agroecosystems, 2012, 94(2/3): 287–298.
[12] Müller C, Laughlin R J, Spott O, et al. Quantification of N2O emission pathways via a15N tracing model[J]. Soil Biology and Biochemistry, 2014, 72: 44–54.
[13] Stevens R J, Laughlin R J, Burns L C, et al. Measuring the contributions of nitrification and denitrification to the flux of nitrous oxide from soil[J]. Soil Biology and Biochemistry, 1997, 29(2): 139–151.
[14] Ambus P, Zechmeister-Boltenstern S, Butterbach-Bahl K. Sources of nitrous oxide emitted from European forest soils[J]. Biogeosciences, 2006, 3(2): 135–145.
[15] 苏波, 韩兴国, 黄建辉.15N自然丰度法在生态系统氮素循环研究中的应用[J]. 生态学报, 1999, 19(3): 408–416.
[16] Decock C, Six J. How reliable is the intramolecular distribution of15N in N2O to source partition N2O emitted from soil? [J]. Soil Biology and Biochemistry, 2013, 65: 114–127.
[17] Toyoda S, Yoshida N, Koba K. Isotopocule analysis of biologically produced nitrous oxide in various environments[J]. Mass Spectrometry Reviews, 2017, 36(2): 135–160.
[18] Toyoda S, Yoshida N. Determination of nitrogen isotopomers of nitrous oxide on a modified isotope ratio mass spectrometer[J]. Analytical Chemistry, 1999, 71(20): 4711–4718.
[19] 曹亚澄. 稳定同位素示踪技术与质谱分析——在土壤、生态、环境研究中的应用[M]. 北京: 科学出版社, 2018.
[20] Brenninkmeijer C A M, Röckmann T. Mass spectrometry of the intramolecular nitrogen isotope distribution of environmental nitrous oxide using fragment-ion analysis[J]. Rapid Communications in Mass Spectrometry, 1999, 13(20): 2028–2033.
[21] Stein L Y, Yung Y L. Production, isotopic composition, and atmospheric fate of biologically produced nitrous oxide[J]. Annual Review of Earth and Planetary Sciences, 2003, 31: 329–356.
[22] Ostrom N E, Ostrom P H. The Isotopomers of Nitrous Oxide: Analytical Considerations and Application to Resolution of Microbial Production PathwaysHandbook of Environmental Isotope Geochemistry, 2012: 453–476.
[23] Toyoda S, Mutobe H, Yamagishi H, et al. Fractionation of N2O isotopomers during production by denitrifier[J]. Soil Biology and Biochemistry, 2005, 37(8): 1535–1545.
[24] Sutka R L, Ostrom N E, Ostrom P H, et al. Nitrogen isotopomer site preference of N2O produced byandBath[J]. Rapid Communications in Mass Spectrometry: RCM, 2003, 17(7): 738–745.
[25] Rohe L, Well R, Lewicka-Szczebak D. Use of oxygen isotopes to differentiate between nitrous oxide produced by fungi or bacteria during denitrification[J]. Rapid Communications in Mass Spectrometry, 2017, 31(16): 1297–1312.
[26] Sutka R L, Ostrom N E, Ostrom P H, et al. Distinguishing nitrous oxide production from nitrification and denitrification on the basis of isotopomer abundances[J]. Applied and Environmental Microbiology, 2006, 72(1): 638–644.
[27] Lewicka-Szczebak D, Well R, Köster J R, et al. Experimental determinations of isotopic fractionation factors associated with N2O production and reduction during denitrification in soils[J]. Geochimica et Cosmochimica Acta, 2014, 134: 55–73.
[28] Jung M Y, Well R, Min D, et al. Isotopic signatures of N2O produced by ammonia-oxidizing Archaea from soils [J]. The ISME Journal, 2014, 8(5): 1115–1125.
[29] Rohe L, Anderson T H, Braker G, et al. Dual isotope and isotopomer signatures of nitrous oxide from fungal denitrification-a pure culture study[J]. Rapid Communications in Mass Spectrometry, 2014, 28(17): 1893–1903.
[30] Maeda K, Spor A, Edel-Hermann V, et al. N2O production, a widespread trait in fungi [J]. Scientific Reports, 2015, 5: 9697.
[31] Sutka R L, Adams G C, Ostrom N E, et al. Isotopologue fractionation during N2O production by fungal denitrification[J]. Rapid Communications in Mass Spectrometry, 2008, 22(24): 3989–3996.
[32] Frame C H, Casciotti K L. Biogeochemical controls and isotopic signatures of nitrous oxide production by a marine ammonia-oxidizing bacterium[J]. Biogeosciences, 2010, 7(9): 2695–2709.
[33] Heil J, Wolf B, Brüggemann N, et al. Site-specific15N isotopic signatures of abiotically produced N2O[J]. Geochimica et Cosmochimica Acta, 2014, 139: 72–82.
[34] Yamazaki T, Hozuki T, Arai K, et al. Isotopomeric characterization of nitrous oxide produced by reaction of enzymes extracted from nitrifying and denitrifying bacteria[J]. Biogeosciences, 2014, 11(10): 2679–2689.
[35] Santoro A E, Buchwald C, McIlvin M R, et al. Isotopic signature of N2O produced by marine ammonia-oxidizing Archaea[J]. Science, 2011, 333(6047): 1282–1285.
[36] Igarashi N, Moriyama H, Fujiwara T, et al. The 2.8 A structure of hydroxylamine oxidoreductase from a nitrifying chemoautotrophic bacterium,[J]. Nature Structural Biology, 1997, 4(4): 276–284.
[37] Zumft W G. Nitric oxide reductases of prokaryotes with emphasis on the respiratory, heme-copper oxidase type[J]. Journal of Inorganic Biochemistry, 2005, 99(1): 194–215.
[38] Westley M B, Popp B N, Rust T M. The calibration of the intramolecular nitrogen isotope distribution in nitrous oxide measured by isotope ratio mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2007, 21(3): 391–405.
[39] Buchen C, Lewicka-Szczebak D, Flessa H, et al. Estimating N2O processes during grassland renewal and grassland conversion to maize cropping using N2O isotopocules[J]. Rapid Communications in Mass Spectrometry, 2018, 32(13): 1053–1067.
[40] Well R, Eschenbach W, Flessa H, et al. Are dual isotope and isotopomer ratios of N2O useful indicators for N2O turnover during denitrification in nitrate-contaminated aquifers? [J]. Geochimica et Cosmochimica Acta, 2012, 90: 265–282.
[41] Lewicka-Szczebak D, Augustin J, Giesemann A, et al. Quantifying N2O reduction to N2based on N2O isotopocules–validation with independent methods (helium incubation and15N gas flux method)[J]. Biogeosciences, 2017, 14(3): 711–732.
[42] Mohn J, Wolf B, Toyoda S, et al. Interlaboratory assessment of nitrous oxide isotopomer analysis by isotope ratio mass spectrometry and laser spectroscopy: Current status and perspectives[J]. Rapid Communications in Mass Spectrometry, 2014, 28(18): 1995–2007.
[43] Toyoda S, Suzuki Y, Hattori S, et al. Isotopomer analysis of production and consumption mechanisms of N2O and CH4in an advanced wastewater treatment system[J]. Environmental Science & Technology, 2011, 45(3): 917–922.
[44] Koba K, Osaka K, Tobari Y, et al. Biogeochemistry of nitrous oxide in groundwater in a forested ecosystem elucidated by nitrous oxide isotopomer measurements[J]. Geochimica et Cosmochimica Acta, 2009, 73(11): 3115–3133.
[45] Yu L F, Harris E, Lewicka-Szczebak D, et al. What can we learn from N2O isotope data? - Analytics, processes and modelling[J]. Rapid Communications in Mass Spectrometry, 2020, 34(20): e8858.
[46] Zou Y, Hirono Y, Yanai Y, et al. Isotopomer analysis of nitrous oxide accumulated in soil cultivated with tea () in Shizuoka, central Japan[J]. Soil Biology and Biochemistry, 2014, 77: 276–291.
[47] Stock B C, Jackson A L, Ward E J, et al. Analyzing mixing systems using a new generation of Bayesian tracer mixing models[J]. PeerJ, 2018, 6: e5096.
[48] Wu D, Well R, Cárdenas L M, et al. Quantifying N2O reduction to N2during denitrification in soils via isotopic mapping approach: Model evaluation and uncertainty analysis[J]. Environmental Research, 2019, 179: 108806.
[49] Verhoeven E, Barthel M, Yu L F, et al. Early season N2O emissions under variable water management in rice systems: Source-partitioning emissions using isotope ratios along a depth profile[J]. Biogeosciences, 2019, 16(2): 383–408.
[50] Ibraim E, Wolf B, Harris E, et al. Attribution of N2O sources in a grassland soil with laser spectroscopy based isotopocule analysis[J]. Biogeosciences, 2019, 16(16): 3247–3266.
[51] Lewicka-Szczebak D, Lewicki M, Well R. N2O isotope approaches for source partitioning of N2O production and estimation of N2O reduction - validation with the15N gas-flux method in laboratory and field studies[J]. Biogeosciences, 2020, 17(22): 5513–5537.
[52] Jackson A L, Inger R, Bearhop S, et al. Erroneous behaviour of MixSIR, a recently published Bayesian isotope mixing model: A discussion of Moore & Semmens (2008)[J]. Ecology Letters, 2009, 12(3): E1–E5.
[53] Moore J W, Semmens B X. Incorporating uncertainty and prior information into stable isotope mixing models[J]. Ecology Letters, 2008, 11(5): 470–480.
[54] Zhang J B, Müller C, Cai Z C. Heterotrophic nitrification of organic N and its contribution to nitrous oxide emissions in soils[J]. Soil Biology and Biochemistry, 2015, 84: 199–209.
[55] Phillips D L, Gregg J W. Source partitioning using stable isotopes: Coping with too many sources[J]. Oecologia, 2003, 136(2): 261–269.
[56] Denk T R A, Kraus D, Kiese R, et al. Constraining N cycling in the ecosystem model LandscapeDNDC with the stable isotope model SIMONE[J]. Ecology, 2019, 100(5): e02675.
[57] Blomberg M R A, Siegbahn P E M. Mechanism for N2O generation in bacterial nitric oxide reductase: A quantum chemical study[J]. Biochemistry, 2012, 51(25): 5173–5186.
[58] Shiro Y, Sugimoto H, Tosha T, et al. Structural basis for nitrous oxide generation by bacterial nitric oxide reductases[J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2012, 367(1593): 1195–1203.
Isotopocule Analysis to Source Partition Soil Produced N2O: A Review
XU Jin1, CAO Yacheng1,2*, WEN Teng1,3,4,5*, ZHANG Peiyi1, ZHANG Jinbo1,3,4,5, CAI Zucong1,3,4,5
(1 School of Geography Science, Nanjing Normal University, Nanjing 210023, China; 2 Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 3 Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Nanjing 210023, China; 4 Key Laboratory of Virtual Geographic Environment (Nanjing Normal University), Ministry of Education, Nanjing 210023, China; 5 State Key Laboratory Cultivation Base of Geographical Environment Evolution (Jiangsu Province), Nanjing 210023, China)
Soil is one of the important sources of N2O emissions. Soil N2O production pathway is numerous and regulated by variety of factors, in-depth analysis of soil N2O production pathway can adopt targeted emission reduction strategies. Stable isotope technology has been widely used to the study of soil N2O emissions, N2O isotope method is an emerging research method in recent years. This method analyzes N2O emission contribution by measuring the isotope composition of soil N2O (15NSPN2O,18ON2Oand15NbulkN2O), because not need to add markers, little interference to soil system and low in cost, it is suitable for field research on N2O emissions and is a powerful supplement to15N labeling method. This paper introduces in detail the principle of N2O isotope method, mass spectrometry method and quantitative analysis method, the factors affecting the method and its application prospect.
N2O isotopocules; Site preference; Source partitioning N2O; Isotope ratio mass spectrometry (IRMS)
S153
A
10.13758/j.cnki.tr.2022.03.001
徐锦, 曹亚澄, 温腾, 等. 同位素异位体溯源土壤N2O的方法、技术和展望. 土壤, 2022, 54(3): 425–436.
国家自然科学基金面上项目(41977084)资助。
(yccao@issas.ac.cn; wenteng@njnu.edu.cn)
徐锦(1998—),女,安徽安庆人,硕士研究生,主要从事土壤氮转化研究。E-mail: 201302014@njnu.edu.cn
