原发性胆汁性肝硬化合并系统性红斑狼疮患者外周血T细胞分化比例及其临床意义
2022-07-21周艳艳
周艳艳
系统性红斑狼疮(Systemic lupus erythematosus,SLE)患者常见合并肝硬化类型为原发性胆汁性肝硬化(Primary biliary cirrhosis,PBC),此类患者病情发展迅速,预后较差[1]。有研究发现,调节性T细胞或Th17平衡失调可能参与其异常自身免疫过程[2-4]。但是关于原发性胆汁性肝硬化合并系统性红斑狼疮患者外周血T细胞亚群及Th1、Th2和Th17细胞因子表达是否存在差异尚无明确定论。本研究选取我院60例PBC合并SLE患者作为研究对象,探讨其外周血T细胞分化比例及其临床意义。
资料与方法
一、一般资料
选取解放军联勤保障部队天津康复疗养中心(原第四六四医院)2018年1月至2021年1月收治的60例PBC合并SLE患者作为研究对象。纳入标准:所有患者均符合PBC合并SLE诊断标准(既往有SLE病史,主要表现为肺动脉高压、血红细胞减少、肾炎,且首次确诊为肝硬化)[5];治疗前未经过可能对研究结果产生影响的药物治疗;年龄≥18岁;对本研究知情并签署同意书。本研究经我院伦理委员会批准。排除标准:合并肝细胞癌者;合并细菌或真菌感染者;严重重要器官功能障碍者;合并全身炎症疾病者。
另选取60名同期来我院体检的健康者作为对照组。病例组患者中男性29例,女性41例;年龄为20~46,平均(38.84±2.58)岁;临床表现为肝性脑病2例、食管胃底静脉曲张5例、肝脾肿大7例、腹水13例、凝血异常14例,血红细胞减少19例。对照组患者中男性17例,女性43例。年龄为18~52,平均(38.95±2.83)岁。两组性别、年龄对比差异无统计学意义(P>0.05),具有可比性。
二、方法
对所有患者进行T淋巴细胞亚群检测,PCR测定,血清Th1类、Th2类、Th17类细胞因子分泌检测。
(一) T淋巴细胞亚群检测 抽取所有受检者的空腹肘静脉血液标本2 mL,分别加入乙二胺四乙酸二钾进行抗凝处理,并在样品测定管之中加入抗凝血50 μL,之后加入20 μL单抗,震荡混匀后,在室温下避光孵育20 min,再加入溶血素2 mL,震荡混匀,室温下避光防止10 min。应用1 500 r/min速度离心5 min后,放弃上层清液,加入500 μL PBS 应用流式细胞仪与BD FACSuite软件获取荧光参数,并检测CD3+、CD4+、CD8+、CD16+、CD56+、Treg、CD4+/CD8+表达水平。
(二)PCR测定 抽取所有受检者外周血4 mL,应用密度梯度离心分析,得到单个核细胞,应用PBS液洗涤两次,应用10%小牛血清与双抗RPMI1640和培养基,调节细胞浓度,赋予培养1 h之后,收集悬浮细胞,并应用尼龙柱法得到T淋巴细胞。TNF-α上游引物:5′-GCTTCTGCATTTGAGTTTGCTAGC-3′,下游引物:5′-CGAACACTTTGAATATTTCTTTAT-TAAG-3′、IL-2上游引物:5′-GAATGGAATTAAT-AAATTACAAGAATCCC-3′,下游引物:5′-TGTT-TCAGATCCTTTAGTTCCAG-3′;IL-4上游引物:5′-GGGTCTCACCCAACTGCT-3′,下游引物:5′-CGAACACTTGAATATTTCTTTCTCTCTAT-D′、IL-6上游引物:5′-GACCAAAGCCAGAGTCCTTC-AGAGAGATACAG-3′,下游引物:5′-TTGGATG-TCTTGGTCCTTAGCCAC-3′、IL-10上游引物: 5′-AACATACTGCTAACCGACTC-3′,下游引物:5′-ATGCTCCTTGATTTCTGG-3′、IL-17A上游引物:5′-CAGTGCCAGCCTCTGCTCAT-3′,下游引物:5′-ATACTCAGCACCAGCACAR-3′、IL-22上游引物:5′-CCAAGTGCTGCCGGTCATTTTC-3′,下游引物:5′-GGCTCGAGGGATGATTTCAA-3′。 PCR反应条件:95 ℃ 1 min,95 ℃ 15 s,58 ℃ 20 s,72 ℃ 40 s,主循环40次。并将收获的细胞在液氮下研磨,依照试剂盒说明书进行RNA提取操作,RNA含量、完整性与浓度检测与上述步骤相同。在20 g/L琼脂凝胶中电泳紫外灯下拍照,并将底片应用激光密度扫描。分别对每一个目的基因β-actin的吸光度(A)值进行测量,并取IFN-γ、TNF-α、IL-2、IL-4、IL-6、IL-10、IL-17A、IL-22 mRNA与β-actin吸光度比值作为相对含量。
(三)血清Th1类、Th2类、Th17类细胞因子分泌检测 抽取空腹静脉血3 mL,放置到真空试管内,待凝固后,应用3 000 r/min的离心速度在常温下离心5 min,留取上层清液。应用酶联免疫吸附法检测Th1类(IFN-γ、TNF-α、IL-2)、Th2(IL-4、IL-6、IL-10)类、Th17类(IL-17A、IL-22)细胞因子分泌水平,所有检测流程均依照试剂盒说明书严格进行。
三、统计学方法
采取统计学软件SPSS 23.0对本研究数据进行分析。计数资料以例数/百分比(n/%)表示,进行χ2检验;计量资料用均数±标准差表示,采用t检验。以P<0.05为差异有统计学意义。
结 果
一、外周血T淋巴细胞亚群表达对比
病例组CD3+、CD4+、CD8+、CD16+、CD56+、Treg和CD4+/CD8+比值明显低于对照组,CD8+高于对照组(P<0.05)。见表1。
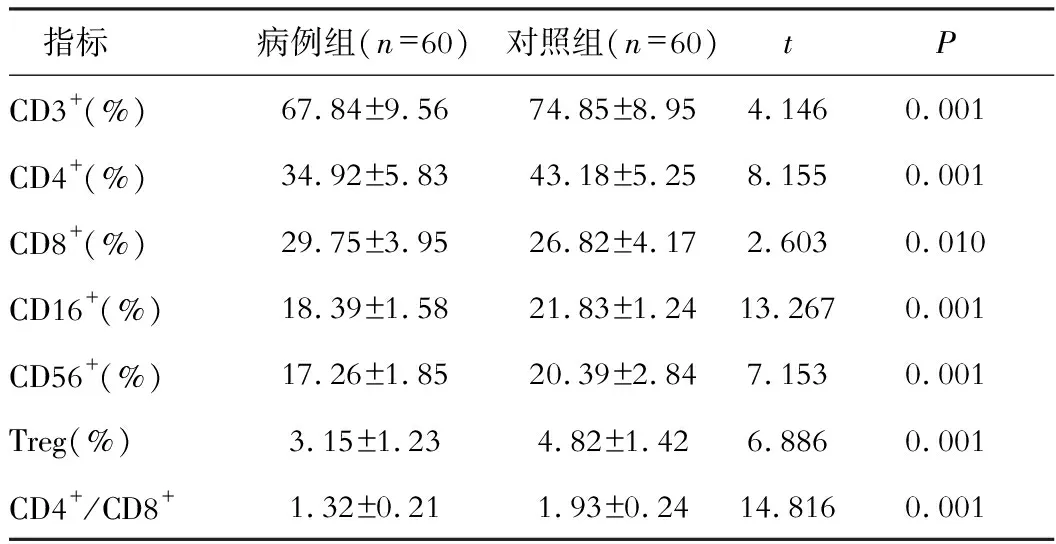
表1 外周血T淋巴细胞亚群表达对比
二、相关炎症细胞因子mRNA表达对比
病例组IFN-γ、TNF-α、IL-2、IL-4、IL-6、IL-10、IL-17A、IL-22 mRNA表达高于对照组,差异具有统计学意义(P<0.05)。见表2。
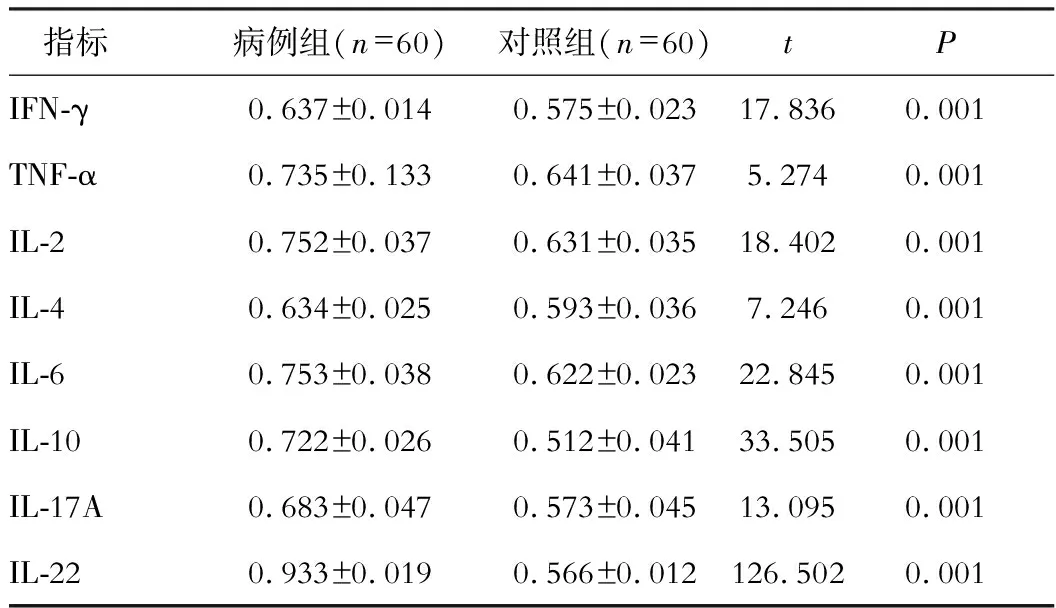
表2 相关炎症细胞因子mRNA表达对比
三、血清中Th1类、Th2类、Th17类细胞因子分泌
病例组Th1类(IFN-γ、TNF-α、IL-2)、Th2(IL-4、IL-6、IL-10)类、Th17类(IL-17A、IL-22)细胞因子分泌水平明显高于对照组(P<0.05)。见表3。
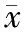
表3 血清中Th1类、Th2类、Th17类细胞因子分泌(±s)
讨 论
T淋巴细胞按照功能可分为细胞毒性T细胞、辅助性T细胞、异质性T细胞等亚群,按照表面标志可分为CD4+和CD8+两大亚群[6-7]。而Th细胞又可成为CD4+细胞,可分为Th2和Th1两个种类,通过主要组织相容性复合体(MHC Ⅱ)激活后分泌细胞因子,协调或调解免疫反应[8]。毒性或抑制T细胞又可成为CD8+细胞,通过MHCI与抗原结合直接作用在靶细胞上[9-10]。目前公认的PBC合并SLE发病机制主要为环境诱因、免疫耐受机制失衡、遗传易感性等多因素过程[11]。在常规分子水平上,PBC合并SLE发病被认为是MHC Ⅱ与抗原和T细胞受体,由于免疫耐受缺乏导致自身反应性T细胞逃避正常抑制,导致肝脏坏死,引发炎症发展[12]。多项研究发现[13-14],PBC合并SLE属于糖皮质激素疗法干预有效的慢性肝病,但是并不意味着治疗终止,在停药之后会出现病情反复发作现象。过去,虽然特定生物制剂在炎症疾病的治疗过程中有了巨大进展,但是PBC合并SLE的诊疗依然是人类面临的一项巨大挑战。吴志敏等[15]研究发现,自身免疫性肝病患者外周血活化的Tfh细胞数量增加,且活化Tfh细胞数目和外周血中免疫球蛋白水平呈正相关。目前关于外周血T细胞亚群在自PBC合并SLE发病中的作用机制研究较少。
本研究结果显示,病例组CD3+、CD4+、CD8+、CD16+、CD56+、Treg和CD4+/CD8+比值明显低于对照组,CD8+高于对照组(P<0.05)。已有大量研究证实[16],诸多疾病中外周血单个核细胞中CD4+/CD8+和CD4+及NK细胞活性或CD16+、CD56+淋巴细胞下降。以往研究对于HBV感染患者单个核细胞中CD4+与CD8+亚群研究发现,CD4+/CD8+和CD4+水平下降,CD8+水平上升与病毒复制状态和肝内炎症具有明显相关性,与本研究结果相符[17]。这可能是因为我们所使用的外周血实验单抗与其淋巴亚群识别特异性相关,也有可能是CD4+细胞亚群组分多样性相关。CD4+T细胞之中除了非特异性免疫抑制细胞(Ts)之外,还有自然杀伤性细胞(CD4+CD56+)。Ts属于激活型T细胞亚群,其表面标志为CD4+CD25+CD45RO+,会受到自分泌TGFβ1诱导后自激,通过包膜接触对于CD8+CTL与抗原提呈细胞等发挥出免疫抑制作用,进而导致机体出现炎症抑制与免疫耐受现象;病例组IFN-γ、TNF-α、IL-2、IL-4、IL-6、IL-10、IL-17A、IL-22 mRNA表达高于对照组,差异具有统计学意义(P<0.05);病例组Th1类(IFN-γ、TNF-α、IL-2)、Th2(IL-4、IL-6、IL-10)类、Th17类(IL-17A、IL-22)细胞因子分泌水平明显高于对照组(P<0.05)。由此证明,PBC合并SLE患者体内炎性因子明显升高。作为肝病主要差异性细胞群,CD4+细胞又可分为Th1与Th2两种,Th1细胞主要产生TNF-α、TNF-β、IFN-γ、IL-2等,增强了细胞的免疫应答。而Th2细胞主要产生IL-10、IL-6、IL-5以及IL-4等,辅助B淋巴细胞分化成抗体产生细胞,多与体液免疫相关。而Th1或Th2类的因子分泌和其相互之间的平衡在免疫应答调节和多种疾病的发生与发展中发挥了关键作用[18]。而Th17细胞异位其分泌IL-17而被命名。转化生长因子TGF-β和IL-6共存情况下,TGF-β会诱导Th17细胞的大量形成。而一旦缺乏IL-6,单独的TGF-β并不能诱导Th17细胞分化,由此可以看出IL-6和TGF-β属于启动Th17细胞分化的必要因素。Th17细胞分泌可产生IL-6、IL-22、IL-21、IL-17F、IL-17A等,并通过这些细胞因子发挥出其特有的相关功能,从而参与移植排斥、自身免疫性疾病、肿瘤、感染以及宿主防御等病理过程[19]。其中IL-17是Th17细胞主要的效应因子,属于重要的炎性介质,可诱导TNF-α、IL-6以及基质金属蛋白酶表达,进而引发组织损伤与炎症细胞浸润。Th17在许多器官特异性免疫性疾病发生、发展中发挥重要作用,例如类风湿性关节炎关节活检中均可发现IL-17的存在。另有动物实验表明[20],肝组织微环境更有利于Th17细胞发育分化,因此Th17可能参与PBC合并SLE的发生,与本研究结果相符。
综上所述,PBC合并SLE患者外周血T淋巴细胞亚群比例明显降低,提示患者有免疫功能下降,且PBC合并SLE患者会合并明显炎症反应升高现象。但本研究依然存在一定局限,并没有研究所有Th1、Th2和Th17细胞的相关因子类型,因此还需在后续研究中增加样本量进行深入研究。
