两种检测尼帕病毒的实时荧光定量PCR方法的比较与效果验证
2022-07-21肖舒奇师永霞危宏平袁志明
肖舒奇,师永霞,夏 菡,危宏平,袁志明,3,黄 弋,3
尼帕病毒(Nipah virus, NiV)是一种高致病性的人兽共患病毒,属于副黏膜病毒科(Paramyxoviridae)亨尼帕病毒属(Henipavirus)。该病毒于1998年在马来西亚的森美兰州双溪尼帕新城被首次发现,并于1999年在一家养猪场第1次引发疫情,造成大量生猪死亡。随后,在孟加拉国、印度、新加坡、柬埔寨等国家出现了多次尼帕病毒引发的疫情,给当地养猪业造成了巨大的影响[1]。尼帕病毒主要的自然宿主是狐蝠科的果蝠,可以感染猪、牛、马、山羊、猫、狗等多种动物,其中在猪中具有高度传染性,还可通过动物或者被污染的食物直接传播给人类,也可以直接人传人[2-6]。人类感染尼帕病毒后,会出现急性呼吸道感染和致命性脑炎,也会有无症状感染者,病死率为40%~75%。在2018年5月的印度喀拉拉邦地区暴发的疫情病死率高达91%[7]。由于该病毒宿主广泛,发病率和致死率高,目前没有针对其感染的有效疫苗或药物[8],被列为生物危害四级病原(Risk group 4)。
目前,我国没有出现尼帕病毒感染的病例,但考虑到尼帕病毒的自然宿主果蝠在我国的华南地区和东南部沿海岛屿也有分布,且和人畜的活动范围有广泛的重叠,加上周边国家地区的疫情状况及频繁的国际贸易来往,我国广西、广东、云南和海南等地存在尼帕病毒流行的风险[9-11]。因此,我国需要建立病毒的分离鉴定、核酸检测、血清学检测等多种诊断方法,完善尼帕病毒监测、预警和预报体系,降低尼帕病毒在我国流行的风险,保障人和动物的生命安全,维护社会公共卫生安全。
尼帕病毒是一种不分节段的单股负链的RNA病毒, 有囊膜和刺突, 病毒颗粒直径为40 nm至600 nm。其基因组全长约18.2 kb,编码6种结构蛋白,分别是核蛋白(NP)、磷蛋白(P)、基质蛋白(M)、融合蛋白(F)、糖蛋白(G)和大蛋白(L)[12-14]。NP在病毒基因组的复制、转录及病毒组装发挥重要作用[15],其基因序列保守,编码区核苷酸同源性高于其他基因,本研究中比较和验证的方法均是以NP为目标基因建立的核酸检测方法。
尼帕病毒是生物危害四级(Risk group 4)病原,此前由于缺乏尼帕病毒来源,核酸检测方法的验证通常只能使用质粒、假病毒或者体外转录模板RNA作为模拟样本,而本研究是国内首次利用尼帕病毒样品对两种实时荧光定量PCR(TaqMan real-time RT-PCR)检测方法进行比较和验证,为实时荧光定量PCR核酸检测方法的有效性提供了进一步评估验证,为建立良好、有效和稳定的诊断方法提供了技术支持。
1 材料与方法


表1 两种尼帕病毒实时荧光定量PCR检测方法引物、探针序列Tab.1 TaqMan real-time RT-PCR primers and probes
1.2 体外转录RNA标准品制备 选取合适的酶切位点,对含有尼帕病毒NP基因的质粒(pGH-NiV-NP,奥科鼎盛(武汉)生物科技有限公司)进行线性化。然后以纯化的线性化质粒DNA为模板 (E.Z.N.A.TMCycle-Pure Kit, Omega),使用RiboMAXTMLarge Scale RNA Production System-T7 (Promega)试剂盒进行体外转录[18]。转录后用DNase I (1U/μL, Beyotime)消化,并确认无残留DNA。待DNA完全被消化完之后,使用E.Z.N.A.TMMicroElute RNA Clean-up Kit (Omega)对RNA进行纯化处理,最后将得到的RNA标准品分装保存在-80 ℃冰箱。
1.3 病毒滴度测定 尼帕病毒(Bangladesh)由武汉国家生物安全(四级)实验室提供。取100 μL病毒进行梯度稀释(10-1~10-9),加入前1 d铺好Vero E6细胞的96孔板,每孔100 μL病毒稀释液,在37 ℃、5% CO2细胞培养箱内孵育1 h后,弃上清,每孔加入100 μL新鲜的含2% FBS (Gibco)的DMEM (Gibco)培养基。37 ℃、5% CO2细胞培养箱内培养3~5 d后可观察细胞病变,记录结果。

克里米亚-刚果出血热病毒(Crimean-Congo hemorrhagic fever virus, CCHFV)、登革病毒(Dengue virus, DENV)、日本乙型脑炎病毒(Japanese encephalitis virus, JEV)、 云南版纳病毒(Banna virus, BAV)、艾比湖病毒(Ebinur Lake Virus, EBIV)、寨卡病毒(Zika virus, ZIKV)、西藏环状病毒(Tibet orbivirus, TIBOV)均由国家病毒资源库提供。使用TRIzol LS(Invitrogen)试剂对上述病毒的细胞感染上清样本进行灭活并提取相应的病毒RNA作为特异性分析的对照样品。提取的RNA均保存于-80 ℃冰箱。
1.5 实时荧光定量PCR(TaqMan real-time RT-PCR) 实时荧光定量PCR使用HiScript II One Step qRT-PCR Probe Kit (Vazyme)试剂盒,依据使用说明书配制反应体系。每一个反应体系包含10 μL 2×One Step Q Probe Mix 缓冲液,1 μL One Step Q Probe Enzyme Mix酶混合物,0.4 μL 上游引物 (10 μmol/L),0.4 μL 下游引物 (10 μmol/L),0.2 μL TaqMan 探针 (10 μmol/L),6 μL RNase-free dd H2O和 2 μL RNA,总体积为20 μL。使用实时荧光定量PCR仪(CFX96, Bio-Rad)进行扩增,反应条件:50 ℃ 15 min, 95 ℃ 30 s,然后按95 ℃ 10 s,60 ℃ 30 s,进行40个循环,在60 ℃采集荧光信号。
1.6 以体外转录RNA为模板的标准曲线建立 将浓度为0.38 ng/μL体外转录的RNA标准品按10倍梯度稀释(10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8),使用RNase-free dd H2O稀释,且作为阴性对照,用建立的实时荧光RT-PCR方法的体系和反应条件确定两种检测方法的灵敏度,每种浓度的RNA标准品平行做3个复孔,并分别重复检测3次,绘制以体外转录RNA为模板的标准曲线。
1.7 以病毒RNA为模板的特异性和灵敏度分析 使用NiV-NP-Q和NiV-NP-UD两种实时荧光定量PCR方法同时检测NiV、DENV、JEV、BAV、EBIV、ZIKV、TIBOV、EBOV、CCHFV病毒的核酸,RNase-free dd H2O作为阴性对照,每种样品重复3次。此外,使用两种实时荧光定量PCR方法分别对梯度稀释的尼帕病毒细胞感染上清样本(101~107TCID50/mL)进行检测,以Log TCID50/mL为x轴、Ct值为y轴,绘制以已知滴度病毒RNA为模板的标准曲线。
2 结 果
2.1 标准曲线建立 两种检测方法的标准曲线见图1,以体外转录RNA模板拷贝数的对数(log RNA copies)为横坐标,以Ct值为纵坐标,NiV-NP-Q检测方法得到的标准曲线方程为y=-3.427 9x+41.631,R2=1,NiV-NP-UD检测方法的标准曲线方程为y=-3.336 1x+41.246,R2=1,均呈现良好的线性关系,并且两种方法的检测灵敏度均为10 copies/μL。图2为扩增曲线。每种浓度的RNA标准品重复检测3次,结果一致,变异系数均小于5%,显示两种检测方法都有较好的重复性和稳定性。
2.2 特异性分析 从NiV、DENV、JEV、BAV、EBIV、ZIKV、TIBOV、EBOV和CCHFV病毒感染细胞上清中提取病毒核酸,所得核酸浓度分别为97.9 ng/μL (NiV)、2.5 ng/μL (DENV)、38.1 ng/μL (JEV)、4.0 ng/μL (BAV)、17.4 ng/μL (EBIV)、6.8 ng/μL (ZIKV)、11.5 ng/μL (TIBOV)、17.2 ng/μL (EBOV)和208.8 ng/μL (CCHFV)。用NiV-NP-Q和NiV-NP-UD两种方法分别对上述病毒核酸进行检测,结果如图3所示。由图可见只有NiV的检测结果是阳性,其余均为阴性,说明2种方法对以上8种病毒没有交叉扩增,均具有较好的特异性。

图1 两种尼帕病毒实时荧光定量PCR检测方法灵敏度分析Fig.1 Sensitivity of two TaqMan real-time RT-PCR methods. Standard curves for NiV-NP-Q (a) and NiV-NP-UD (b) were constructed with seven 1∶10 dilutions ranging from 107 copies/μL to 101 copies/μL of in vitro transcribed RNA
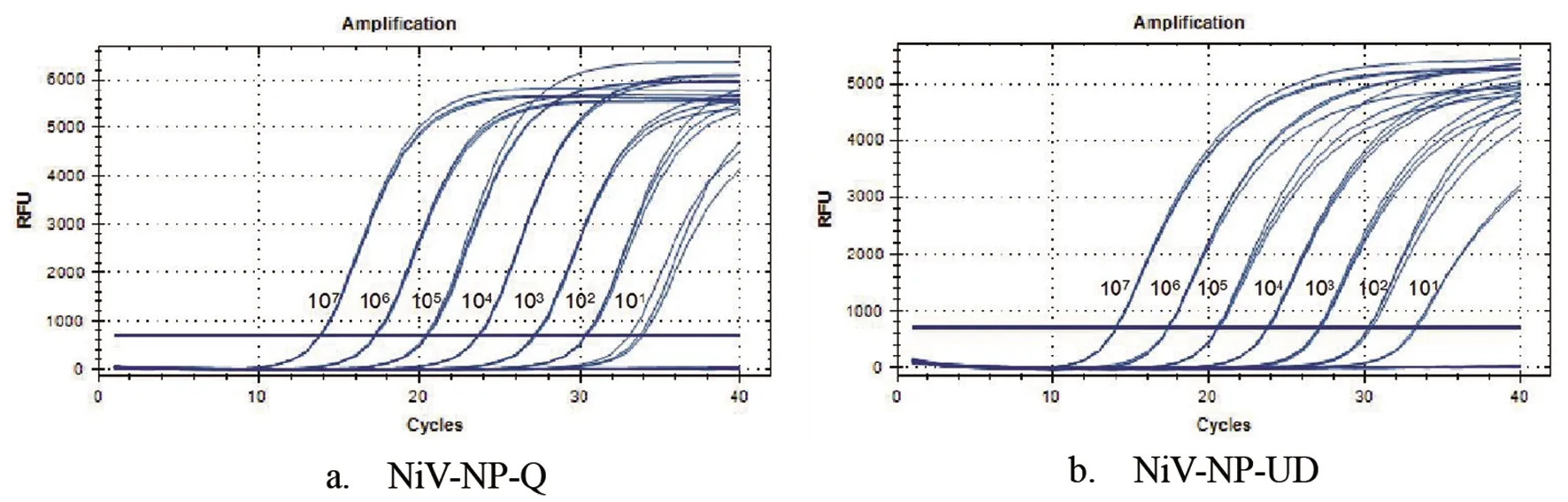
图2 两种尼帕病毒实时荧光定量PCR检测方法检测体外转录RNA模板的扩增曲线Fig.2 Amplification curves of nine 1∶10 dilutions ranging from 107 copies/μL to 10-1 copies/μL for in vitro transcribed RNA for NiV-NP-Q (a) and NiV-NP-UD (b)
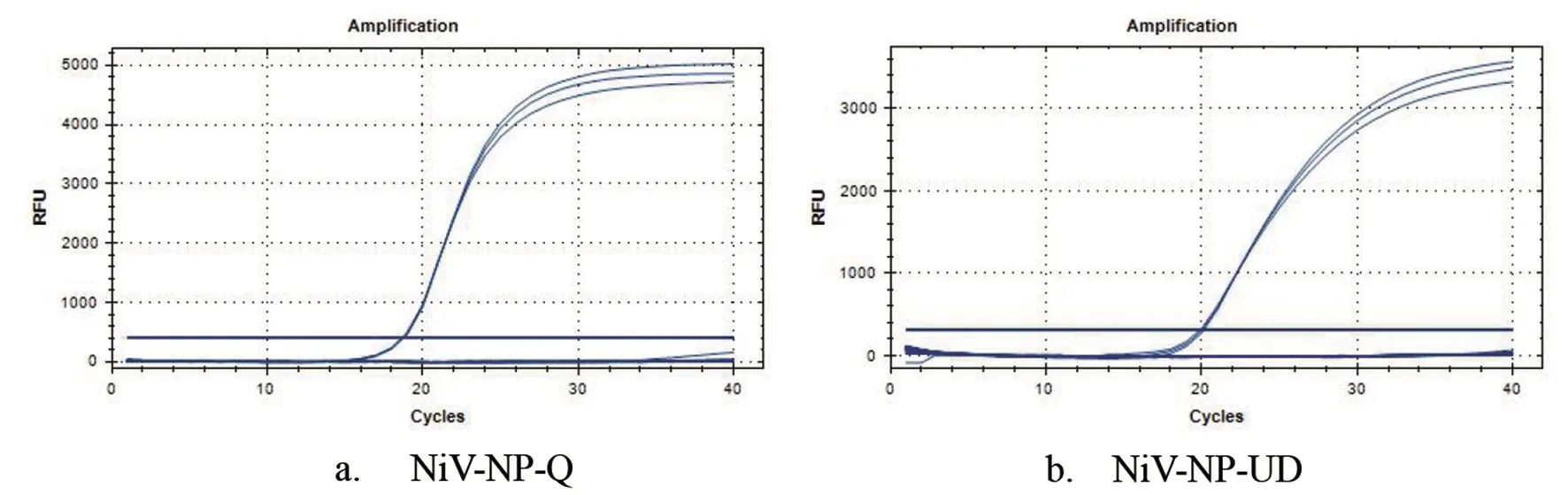
图3 两种尼帕病毒实时荧光定量PCR检测方法特异性分析Fig.3 Specificity of two TaqMan real-time RT-PCR methods: (a) NiV-NP-Q, (b) NiV-NP-UD
2.3 两种尼帕病毒实时荧光定量PCR检测方法的验证 从10倍梯度稀释的尼帕病毒感染细胞上清(107~101TCID50/mL)样本中提取了病毒RNA,以该RNA为模板对两种方法进行验证的结果如图4所示。以Log TCID50/mL为x轴、Ct值为y轴,分别获得两种方法相对应的线性方程,结果显示两者之间具有较好的线性关系,且两种检测方法的检测限均可达10 TCID50/mL,具有较高的灵敏度。

图4 两种尼帕病毒实时荧光定量PCR检测方法的验证及其以病毒RNA为模板的灵敏度分析Fig.4 Sensitivity of two TaqMan real-time RT-PCR methods. Standard curves for NiV-NP-Q (a) and NiV-NP-UD (b) were constructed with seven 1∶10 dilutions of viral RNA extracted from virus infected cell supernatants, ranging from 107 TCID50/mL to 101 TCID50/mL
3 讨 论
尼帕病毒被世界卫生组织(WHO)列为对人类最危险的病毒之一,由于其宿主范围广泛,传播性强,感染后病死率高,研发其诊断、预防和治疗方法刻不容缓[19-20]。实时荧光定量PCR检测方法具有灵敏度高、特异性好、稳定性好、效率高等优点,在诊断方面发挥重要作用。
目前国内外已经建立了一些尼帕病毒的定量PCR检测方法,与这些方法相比,本研究中的方法具备更好或相当的灵敏度和特异性。王浩等[11]同样以N基因作为靶基因,建立TaqMan qRT-PCR方法,通过检测RNA标准品得到的灵敏度为100 copies/μL,与之相比,本研究中的两种方法具有更高的灵敏度。Jensen等[21]以F和G之间非编码区基因为靶标建立qRT-PCR检测方法,分别检测了尼帕病毒的两种毒株Malaysia和Bangladesh,以病毒细胞感染样本为模板,其检测得到的灵敏度均为10 pfu/mL,计算出相对应的病毒RNA拷贝数为104copies/mL,结果与本研究相似,只是由于可使用的尼帕病毒毒株有限,本研究只针对Bangladesh毒株进行了检测验证。Guillaume等[12]以尼帕病毒的N基因为靶标建立了TaqMan探针RT-PCR法,对病毒RNA进行检测,灵敏度约为1 pfu/mL,由于使用了不同的滴度单位,无法与本研究中涉及的两种方法进行直接的比较,我们今后可采取同样的条件优化该方法并进行比较,为NiV的检测方法提供更多参考。Feldman等[22]建立了TaqMan探针、SYBR Green和巢式3种RT-PCR检测方法,认为SYBR Green RT-PCR方法成本较低,对于调查大量潜在的未知亨尼帕病毒更经济实用,TaqMan探针检测法更加灵敏,但价格较昂贵,用于定量检测已知亨尼帕病毒更为准确,我们的研究结果也显示出TaqMan探针法具备灵敏度高、特异性好等特点。
由于此前缺乏病毒来源,前期国内研究人员建立的一些尼帕病毒的定量PCR检测方法[10-11,17]仅仅使用DNA质粒或者体外转录RNA作为阳性模板,对检测方法的评估具有一定的局限性。而本研究首次在国内利用尼帕病毒感染上清样本为检测对象,同时设置了埃博拉病毒、克里米亚-刚果出血热病毒、乙型脑炎病毒等病毒的感染上清样本作为对照,对已建立的两种方法进行了特异性和灵敏度的验证,可以更为全面和真实地对检测方法进行评价,以便更好地运用到实际检测工作中。目前仍缺乏NiV检测方法的统一标准,尤其是在一些欠发达国家和地区,从而导致很多NiV感染未能得到准确检测的情况存在[15],本研究对已经建立的2种方法在同样检测条件下进行了比较和验证,为标准化NiV的核酸检测方法提供了参考。此外,已有研究显示高质量的病毒载量检测对很多DNA或RNA病毒性疾病患者的治疗和管理的必要性,如HIV/AIDS领域[23],病毒感染者体内的病毒载量可能与疾病治疗效果和预后有重要提示意义。本研究以已知滴度的病毒液为检测对象,对梯度稀释的病毒液进行病毒RNA提取和检测,建立了病毒滴度和Ct值之间的关系(图4),为临床检测和治疗工作提供了参考。但值得注意的是,当前我们国家没有尼帕病毒感染的病例报道,缺乏尼帕病毒感染的临床样本,因此,今后还需要利用临床样本对以上方法进一步评估,以明确实时荧光定量PCR检测方法对临床样本的适用性。
尼帕病毒感染是WHO研发蓝图中的重点疾病。研发蓝图是指在流行病暴发之前或者暴发期间,为了研发诊断工具、疫苗、药物、疗法等相关技术而建立的全球战略合作和防范平台。但目前没有针对尼帕病毒感染的药物或疫苗,因此,诊断和发现是尼帕病毒防控的第一步。核酸检测是实验室常用诊断方法之一,定量PCR法具有操作简便、检测高效、灵敏度高、特异性强和稳定性良好等优点,已在病原诊断方面被广泛应用,成为必不可少的诊断工具之一,特别是在流行病暴发期间。我国已有正在运行的生物安全四级(BSL-4)实验室,可以开展尼帕病毒等烈性病原相关的药物和疫苗研究,为未来烈性病原的科研提供相关的技术支持。本研究依托武汉BSL-4实验室对前期建立的两种尼帕病毒定量PCR检测方法进行了比较和评估验证,为建立优良、高效和稳定的实验室诊断方法提供了技术支撑。
(感谢武汉国家生物安全实验室全体工作人员在研究工作中提供的支持和帮助。)
利益冲突:无
引用本文格式:肖舒奇,师永霞,夏菡,等. 两种检测尼帕病毒的实时荧光定量PCR方法的比较与效果验证[J]. 中国人兽共患病学报,38(4):303-308. DOI:10.3969/j.issn.1002-2694.2022.00.015
