新型冠状病毒肺炎动物模型研究进展
2022-07-21蔡亚争周莉孙祖越
蔡亚争,周莉,,孙祖越
(1.湖北天勤生物科技有限公司武汉分公司,湖北武汉 430075;2.上海市计划生育科学研究所,中国生育调节药物毒理检测中心,上海 200032;3.复旦大学生殖与发育研究院,上海 200032)
2020 年1 月5 日,中国首次向美国国家生物技术信息中心GenBank 数据库提交SARS-CoV-2 基因组序列(MN908947.3)。SARS-CoV-2 是具包膜的正链RNA 病毒,属于β 冠状病毒,呈圆形或椭圆形颗粒,直径60~140 nm[4]。SARS-CoV-2 外壳主要包含4 种结构蛋白,分别是核衣壳蛋白(N 蛋白)、包膜蛋白(E 蛋白)、膜蛋白(M 蛋白)和刺突蛋白(spike glycoprotein,S 蛋白)[5]。SARS-CoV-2 通过S 蛋白与宿主细胞表面受体ACE2 特异性结合,进入宿主细胞内复制引起感染[6]。
S蛋白由2个亚基S1和S2组成。S1主要包含受体结合区(receptor-binding domain,RBD),直接参与ACE2 的识别;S2 参与病毒与宿主细胞膜的融合[7-8]。最近研究发现,酪氨酸蛋白激酶受体UFO能够结合SARS-CoV-2 的S 蛋白N 端结构域,是SARS-CoV-2 感染人类呼吸系统的潜在受体,可能成为不依赖于ACE2的新受体[9],为COVID-19 的治疗提供新靶点。
迄今为止,尚无理想的COVID-19 动物模型。通过筛选易感动物、构建人ACE2(human ACE2,hACE2)腺病毒载体、筛选鼠适应性毒株、重组毒株和基因编辑技术等方法,研究人员成功开发出能够部分模拟临床表现、发病过程、病理生理学变化和免疫学反应等特征的COVID-19 动物模型,主要包括非人灵长类、啮齿类和其他哺乳类COVID-19 动物模型等。本文针对COVID-19动物模型特征和适用范围进行综述。
1 非人灵长类COVlD-19动物模型
研究发现,非人灵长类动物在遗传学上与人亲缘关系极其相近,其ACE2 受体与SARS-CoV-2 具有高亲和力,非人灵长类COVID-19 动物模型可模拟部分临床表现和病理病变特点[10-13]。Yu 等[10]曾构建恒河猴COVID-19 动物模型,3~5 岁成年和15岁老年恒河猴通过气管接种SARS-CoV-2 1×106半数组织培养感染剂量(median tissue culture infective dose,TCID50),成年恒河猴表现出体重减轻、鼻腔内病毒高效复制和间质性肺炎等,而老年恒河猴表现出更严重的间质性肺炎。而Shi等[12]研究发现,6~11岁恒河猴通过气管接种SARS-CoV-2 7×106TCID50,恒河猴体重和体温无变化,但表现出呼吸道病毒高效复制和肺组织轻度病理改变(包括肺血管内血栓形成和细支气管上皮细胞坏死脱落),并且有自愈的倾向。通过该动物模型进一步研究发现,恒河猴可抵抗病毒再次感染,抗SARSCoV-2单克隆抗体CB6具有治疗和预防COVID-19的潜力,表明该模型可应用于抗SARS-CoV-2 药物筛选。
Rockx 等[13]构建了食蟹猴COVID-19 动物模型,对4~5 岁成年和15~20 岁老年食蟹猴通过气管和滴鼻联合途径接种SARS-CoV-2 1×106TCID50,成年和老年食蟹猴均未表现出明显的临床症状,体重无明显下降、呼吸道病毒高效复制和轻度肺组织病理改变(包括肺泡和细支气管上皮细胞坏死、肺泡水肿和少量炎症细胞浸润等),而老年食蟹猴上呼吸道中检测到病毒的时间有所延长。
虽然不同研究报道存在一定差异,但非人灵长类动物具有与人类相似的生物学特征,感染SARSCoV-2 后表现出体温升高、肺部病毒载量增加和间质肺炎,通过鼻拭子、咽拭子及肛拭子可检测到病毒复制。目前,非人灵长类COVID-19 动物模型应该是最有参考价值的模型,可适用于发病机制的研究和疫苗及治疗性药物的评估。但非人灵长类动物具有个体差异较大、繁殖周期长和价格高昂等缺点,因此其他种属COVID-19 动物模型的开发十分必要。
2 啮齿类COVlD-19动物模型
2.1 野生型啮齿类动物模型
2.1.1 腺病毒转导hACE2野生型小鼠
步骤2 计算各草莓植株所在位置的适应度函数值,记录最优个体和最优解。适应度函数所计算的个体适应度值为执行一次订单任务的总时间。
Anderson 等[14-15]开发了在巨细胞病毒(cytomegalovirus,CMV)启动子控制下表达hACE2 的腺病毒载体(Ad5-ACE2),Ad5-ACE2 可使小鼠表达hACE2。Sun 等[16]首次构建了Ad5-hACE2 COVID-19 小鼠模型,给野生型小鼠滴鼻接种Ad5-ACE2 2.5×108病灶形成单位(focus forming unit,FFU),5 d 后小鼠肺上皮细胞表达hACE2 受体;通过滴鼻接种SARS-CoV-2 1×105空斑形成单位(plaque forming unit,PFU)感染病毒后,小鼠表现出体重减轻、肺部病毒高效复制和间质性肺炎等。通过该模型显示,COVID-19 患者恢复期血浆和瑞德西韦治疗后,该模型小鼠体重减轻、肺部病毒载量升高和肺组织病理改变均有明显改善。
Zost 等[17]将野生型小鼠滴鼻接种AdV-hACE2(表达hACE2 的腺病毒)2.5×108FFU,5 d 后滴鼻接种SARS-CoV-2 4×105PFU,观察2 种单克隆抗体(COV2-2196 和COV2-2130)分别单独用药和联合用药的预防和治疗作用。两者分别单独用药和联合用药后,该模型小鼠体重减轻、肺部病毒载量升高和间质性肺炎均有明显改善。Zhang 等[18]通过Ad5-hACE2 模型证明,相比单克隆抗体2H2(来源于受体结合区免疫后的小鼠),c2H2/c3C1(人鼠嵌合化单克隆抗体组合)双抗体鸡尾酒疗法对COVID-19 具有更好的治疗效果,对该模型小鼠的肺部病毒载量降低更显著。Tian 等[19]将野生型小鼠滴鼻接种Ad5-hACE2 2.5×108FFU,4 d 后滴鼻接种SARS-CoV-2 1.5×105PFU,用该模型验证NVX-CoV2373 疫苗的预防效果。结果表明,NVXCoV2373 疫苗免疫后,该模型小鼠体重减轻、肺部病毒载量升高和间质性肺炎均有明显改善。Ad5-hACE2 小鼠COVID-19 模型可表现出体重减轻、肺部病毒高效复制和肺组织病理改变包括间质性肺炎等,适用于抗病毒药物的筛选和疫苗评价。缺点是该模型无法发展成严重致死的症状和无肺外组织损伤。
2.1.2 叙利亚金黄地鼠
Chan 等[20]发现,叙利亚金黄地鼠的ACE2 蛋白与hACE2 蛋白高度相似,与SARS-CoV-2 具有高亲和力。给金黄地鼠滴鼻接种SARS-CoV-2 1×105PFU 感染病毒,2 d 后金黄地鼠表现出体重减轻、肺部病毒高效复制和肺组织轻度病理改变。Rosenke 等[21]通过该动物模型研究显示,羟氯喹无明显的预防或治疗效果。Sia 等[22]研究发现,给金黄地鼠滴鼻接种SARS-CoV-2 8×104TCID50感染病毒,2 d 后金黄地鼠表现出肺部病毒高效复制和肺组织轻度病理变化等与轻度COVID-19 患者类似的症状。Osterrieder 等[23]研究发现,叙利亚金黄地鼠滴鼻接种来自慕尼黑的SARS-CoV-2M(SARSCoV-2 München)1×105PFU 感染病毒,2 d 后金黄地鼠表现出体重轻微减轻、肺部病毒高效复制和间质性肺炎等。Kreye等[24]应用该模型验证了单克隆抗体CV07-209对感染SARS-CoV-2的叙利亚金黄地鼠的治疗和预防作用。结果表明,经单克隆抗体CV07-209 治疗(接种病毒后2 h 给药)和预防(接种病毒前24 h 给药)后,该模型小鼠体重减轻和肺部组织病理改变(包括间质性肺炎、支气管上皮细胞坏死和炎症细胞浸润等)均有明显改善。叙利亚金黄地鼠COVID-19 模型可模拟轻度临床症状,但无法发展成严重致死的症状,适用于轻度患者发病机制研究和抗病毒药物的评价。
2.1.3 基于鼠适应病毒株和重组病毒株的小鼠感染模型
Wang等[25]通过实验筛选出可适应野生型小鼠的SARS-CoV-2 突变毒株HRB26M。给老龄小鼠接种HRB26M 1×104.4PFU感染病毒,3 d后老龄小鼠表现出呼吸道和肺部病毒高效复制及间质性肺炎。通过该模型亦证明了瑞德西韦对病毒的抑制作用。进一步研究发现,与SARS-CoV-2(HRB26毒株)基因组比较,HRB26M 毒株有3 处氨基酸位点突变和1 处缺失,分别为nsp8 蛋白A81T、S 蛋白Q498H 和N969S 突变及S 蛋白中临近裂解位点的675~679 位(QTQTN)缺失[25]。Gu 等[26]通过实验筛选出适应野生型BALB/c 小鼠的SARS-CoV-2 突变毒株MASCp6,给6周龄和9月龄的BALB/c小鼠滴鼻接种MASCp6 1.6×104PFU 感染病毒,2 d 后小鼠均表现出呼吸道和肺部病毒高效复制和间质性肺炎,其中老龄小鼠表现出更严重的间质性肺炎。同时应用该模型测试了皮下注射重组亚单位候选疫苗(RBD-Fc),发现免疫RBD-Fc后能有效抑制肺部病毒复制并改善肺组织病理损伤。Dinnon等[27]通过反向基因技术设计出了重组毒株SARSCoV-2 MA,给BALB/c 小鼠接种1×105PFU 感染病毒,随后小鼠表现出肺部病毒高效复制和肺组织病理改变(如上皮损伤、炎症浸润和细支气管周围淋巴细胞炎症等);候选药物干扰素λ1a 治疗后,该模型小鼠呼吸道上皮细胞中病毒载量明显降低。
突变毒株或重组毒株COVID-19小鼠模型能模拟部分临床病理病变,且具有很好的可重复性,适用于发病机制的研究、治疗药物和疫苗的评价,缺点是变异毒株或重组毒株可能会产生免疫逃逸现象。
2.2 转基因啮齿类动物模型
研究发现,野生型小鼠的ACE2 与人类的ACE2存在一定差异,其ACE2受体与SARS-CoV-2的亲和力较低,因此野生型小鼠不易感染SARSCoV-2[28]。SARS 期间开发出的多种转基因小鼠模型逐渐被用于COVID-19 研究。通过基因编辑技术,国内外科研人员成功构建了可在不同启动子驱动下表达hACE2 的转基因小鼠,包括细胞角蛋白18(human cytokeratin,K18)编码基因启动子驱动下表达hACE2转基因小鼠(简称K18-hACE2小鼠)、肝细胞核因子3/叉头同源物4(hepatocyte nuclear factor-3/fork homologue 4,HFH4)启动子驱动下表达hACE2转基因小鼠(简称HFH4-hACE2小鼠)、CAG 启动子驱动下表达hACE2 的转基因小鼠谱系如AC-12,AC-22,AC-50,AC-63 和AC-70(简称CAG-hACE2 小鼠)和小鼠ACE2(mouse ACE2,mACE2)启动子驱动下表达hACE2 的转基因小鼠(简称mACE2-hACE2小鼠)。
2.2.1 K18-hACE2小鼠
McCray 等[29]开发了K18-hACE2 小鼠,而且hACE2 主要在上皮细胞中表达。Oladunni 等[30]构建了K18-hACE2小鼠COVID-19模型,K18-hACE2小鼠接种SARS-CoV-2 1×105PFU 感染病毒,2 d后肺部病毒高效复制,肺组织出现严重病理变化(包括弥漫性肺泡损伤、炎症细胞浸润、组织损伤和肺血管损伤等);6 d 内小鼠体重下降20%,全部死亡。Zheng 等[31]构建了致死性呼吸道疾病的K18-hACE2 小鼠COVID-19 模型,K18-hACE2 小鼠滴鼻接种SARS-CoV-2 1×105PFU 后,肺是病毒早期攻击的主要靶器官,后期病毒透过血脑屏障损伤脑部,并且脑损伤可能是小鼠致死的主要原因。通过该模型证实了COVID-19患者恢复期血浆具有一定预防和治疗COVID-19的作用。
K18-hACE2小鼠模型具有易感特点,可表现出部分临床表现和病理病变,适用于抗病毒药物的筛选和疫苗评价,但缺点是致命的脑炎与人类感染症状差异大。
2.2.2 HFH4-hACE2小鼠
Menachery 等[32]开发出HFH4-hACE2 小鼠。Jiang等[33]成功构建了HFH4-hACE2小鼠COVID-19模型。HFH4-hACE2 小鼠滴鼻接种SARS-CoV-2 3×104TCID50,感染后在肺、气管和脑中检测到高病毒载量,并出现类似临床病理改变(包括支气管和肺血管周围炎症细胞浸润、肺泡水肿和纤维蛋白渗出等),部分小鼠体重大幅减轻并发生致命的脑炎。进一步研究发现,预先暴露于SARS-CoV-2 的HFH4-hACE2小鼠可保护其免受病毒再次侵害。
HFH4-hACE2 小鼠模型具有易感特点,适用于抗病毒药物的筛选和疫苗评价,但缺点是其致命的脑炎与人类临床症状差异大。
2.2.3 CAG-hACE2小鼠
Tseng 等[34]开发出CAG-hACE2 小鼠,其中AC-70 小鼠的hACE2 在多种组织器官中均高度表达。AC-70小鼠滴鼻接种SARS-CoV 1×106TCID50,2 d 后表现出体重减轻、肺部病毒载量升高及血管和细支气管周围轻微至轻度炎症浸润,并伴有支气管和细支气管上皮细胞肿胀和空泡化;3 d后表现出肺炎症浸润减少及间质增厚逐渐消退,脑内病毒高效复制;8 d内小鼠全部死亡[35]。但暂无正式报道使用该小鼠用于COVID-19研究。本研究集体研究表明,CAG-hACE2 小鼠接种SARS-CoV-2 1×105PFU,3 d后小鼠体重大幅减轻,部分小鼠死亡,肺部病毒高效复制,表现出SARS-CoV-2感染急性期病理变化等症状(待发表)。
2.2.4 mACE2-hACE2小鼠
研究人员通过不同方法开发出mACE2-hACE2小鼠[36-38]。Bao 等[37]通过将mACE2 启动子显微注射到ICR 小鼠受精卵原核中的方式培育出能表达hACE2 的mACE2-hACE2 小鼠,该小鼠接种SARS-CoV-2 1×105TCID50感染病毒后,表现出体重减轻、肺部病毒高效复制、弥漫性间质性肺炎和广泛的肺外器官损伤等,但症状较轻微且非致命,可能是由于小鼠肺部hACE2 表达水平较低。Sun等[38]通过CRISPR/Cas9 技术把hACE2cDNA 插入到mACE2基因中开发出表达hACE2的转基因小鼠。该小鼠对SARS-CoV-2高度致敏,滴鼻SARSCoV-2 4×105PFU 感染病毒后,未观察到明显临床症状;6 d 后在肺气管和脑中均检测到病毒复制,并出现间质性肺炎;老年mACE2-hACE2 小鼠肺组织病理变化更接近于临床症状,并且ig 接种SARSCoV-2 5×106PFU 也可成功被感染,这为探究新的感染途径提供了思路。
在K18,HFH4 和CAG 启动子驱动下表达hACE2 的转基因小鼠可模拟部分临床表现和肺组织病理变化,但其局限性在于严重肺外器官损伤(包括中枢神经系统和致死性脑炎等);在mACE2启动子驱动下表达hACE2 的转基因小鼠可模拟部分临床表现和肺病理变化,但可能存在hACE2表达差异较大的缺点。因此,可根据hACE2转基因小鼠的临床表现、病理生理学和病原学等重要指标,综合考虑COVID-19动物模型的选择。
3 其他哺乳类COVlD-19动物模型
3.1 雪貂
雪貂是常被用于人类呼吸道病毒研究的动物模型。Shi 等[39]发现,SARS-CoV-2 可在雪貂上呼吸道中高效复制,而不会造成严重疾病或死亡。Kim 等[40]报道了SARS-CoV-2 感染和传播的雪貂模型。雪貂鼻腔内接种SARS-CoV-2 1×105.5TCID50感染病毒,2 d 后体温升高,4 d 后在呼吸道出现病毒高效复制,并可通过空气传染,但肺部病毒复制量极低。Cox等[41]通过雪貂COVID-19模型研究发现,口服药物莫纳皮拉韦(molnupiravir)能明显减少上呼吸道病毒载量并完全阻断病毒传染。雪貂COVID-19 模型可通过空气传播病毒,适用于对COVID-19 感染途径的研究,缺点是肺部无大量病毒复制。
3.2 中国树鼩
中国树鼩是非人灵长类动物的近亲。Xu 等[42]报道,中国树鼩可能成为SARS-CoV-2 致病机制研究、药物和疫苗评价的模型动物。约1 岁的成年中国树鼩和5~6岁的老年中国树鼩,通过ig、滴鼻和滴眼的途径总接种SARS-CoV-2 1×107TCID50感染病毒,3 d 后表现出血清谷草转氨酶和尿素氮水平升高、肺部病毒高效复制和肺损伤(包括肺泡间隔增厚和间质出血)等。有趣的是,从肺部病毒载量结果分析,与成年中国树鼩相比,老年中国树鼩似乎更不容易感染SARS-CoV-2。中国树鼩有望成为SARS-CoV-2 致病机制研究、药物和疫苗评价的模型动物。
4 结语
目前迫切需要理想的COVID-19动物模型用于致病机制研究及有效药物和疫苗的评价。理想的动物模型应该是易感动物,并且能够最大化模拟人类COVID-19 疾病临床表现、疾病过程、病理生理变化和免疫学反应等疾病特征[43]。现已报道的COVID-19动物模型各有优缺点(表1),研究人员应根据研究目的选择合适的动物模型。非人灵长类COVID-19 模型是目前相对理想的动物模型,可作为非临床研究最后一步药效学评估,但非人灵长类动物存在个体差异较大、繁殖慢和成本高等限制。Ad5-hACE2 小鼠COVID-19 动物模型能模拟临床肺组织病理改变,且具有构建周期短、方法简单和易于重复等优点,稳定和可靠的hACE2腺病毒载体是该模型快速推广到各研究机构的关键。叙利亚金黄地鼠COVID-19 动物模型具有较大开发潜力,但症状相对较轻。变异毒株或重组毒株COVID-19小鼠模型能较好地模拟临床肺组织病理改变,但该变异毒株或重组毒株可能会产生免疫逃逸现象。雪貂COVID-19 模型适用于呼吸道传染研究,但肺病毒复制量较少。中国树鼩COVID-19动物模型有望用于SARS-CoV-2 致病机制研究、药物和疫苗评价。自从疫情爆发后,转基因小鼠COVID-19 模型陆续被报道,但不同研究报道存在一定差异,包括转基因小鼠品系、攻毒剂量和攻毒后观察时间等。因此,研究人员需要提前摸索出可重复性高的转基因小鼠COVID-19 动物模型。总之,COVID-19动物模型的进一步优化和发展,对疾病发病机制的研究、抗病毒药物和疫苗的研制起到至关重要的作用。
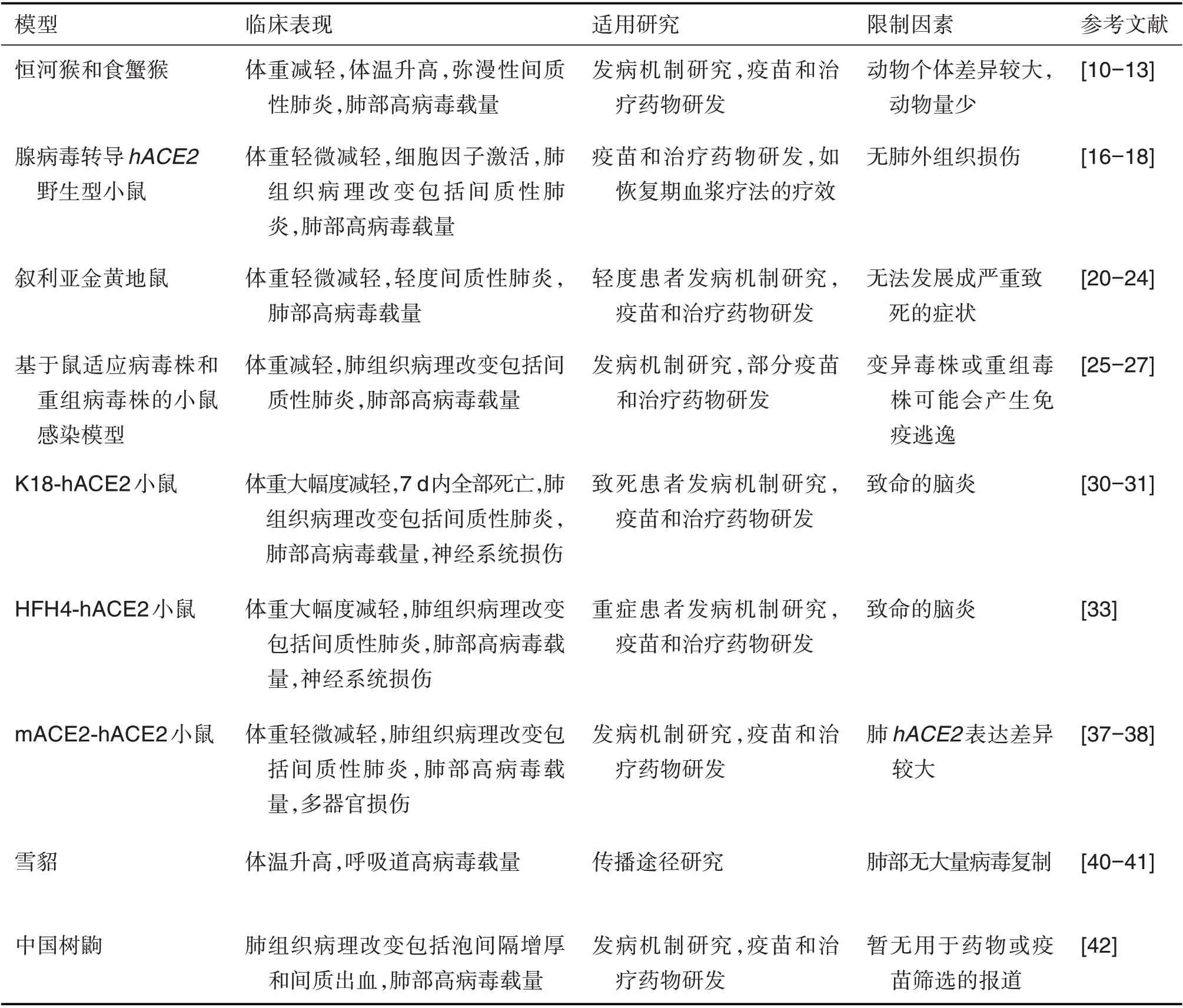
表1 现已报道的新型冠状病毒肺炎(COVlD-19)动物模型的特征(截止2021-03-01)
虽然已有多款疫苗附条件上市,但令人担忧的突变毒株,如快速传播的奥密克戎B.1.1529 毒株,对现有的疫苗是否存在免疫逃逸需要进一步研究证实。COVID-19 发病机制的深入研究不仅是COVID-19 动物模型的进一步优化和发展的基础,而且是疫苗和药物研发的基础。因此,研究人员面临的挑战和突破是从分子层面深入揭示COVID-19发病机制,包括病毒感染、病毒复制、器官损伤和机体免疫反应等。同时,鉴于现有的动物模型存在的差异,期望国内外研究人员制备出更规范、成熟、稳定的COVID-19动物模型。
