血清血红素氧合酶-1水平变化在评估胃癌患者术后效果中的价值
2022-07-20孙春阳佳木斯市中心医院普外一科黑龙江佳木斯154002
孙春阳 (佳木斯市中心医院普外一科,黑龙江 佳木斯 154002)
胃癌是常见的恶性肿瘤之一,我国是胃癌的高发区,目前胃癌已经成为我国发病率及死亡率仅次于肺癌的第二大肿瘤[1]。胃癌的发生发展是一个逐渐演变的过程,是多种因素共同作用的结果[2]。在胃癌的发生、发展过程中,肿瘤细胞保护细胞免受氧化应激反应损伤与对抗细胞凋亡重要的环节[3-4]。血红素氧合酶-1(HO-1)是氧化应激反应过程中重要的调节蛋白,分子量为33 000,全长为288个氨基酸。HO-1主要位于内质网膜上,可以使螺旋的骨架和血红素相互靠近,从而嵌入了血红素[5]。HO-1是血红素代谢的限速酶,可代谢血红素生成铁离子、一氧化碳和胆红素,从而工程组成了机体不可或缺的内源性抗氧化应激损伤体系,在维持细胞正常功能、增强细胞抗损伤能力等方面发挥重要作用[6]。血清HO-1水平与心血管疾病、妊娠期高血压疾病的病情判断、预后及转归存在相关性,因HO-1具有抗凋亡的作用,可能与恶性肿瘤的发生与发展存在相关性[7]。本研究具体探讨了血清HO-1水平变化在评估胃癌患者术后效果的价值,目的是为胃癌术后患者提供简单、易操作且准确性高的预后判断工具,希望为改善患者预后、延长患者生存时间提供依据。
1 资料与方法
1.1一般资料:选择2018年7月~2021年1月在我院接受择期根治性手术治疗的早中期胃癌患者180例设为胃癌组。纳入标准:临床分期为Ⅰ~Ⅱ期;小学及以上文化水平,精神状态良好;所有患者具有完整的术前血清学指标资料;在血清学检测前未接受任何治疗;均经病理确诊为胃癌;具有完整的随访资料。同期选择在本院体检的健康人群180例设为对照组,纳入标准:平素身体素质较好,小学及以上文化水平,体检时未发现胃癌也未发现其他恶性肿瘤。两组排除标准:妊娠或哺乳期妇女;患有慢性呼吸系统疾病患者;患有传染性疾病或接触史的患者;合并严重心、脑、肾疾病患者;合并其他肿瘤者;临床资料缺乏者。本研究经过本院医学伦理委员会同意。
1.2血清HO-1检测:采集所有入选者的空腹静脉血1~2 ml,不抗凝,室温下静置20 min后,以3 000 rpm/min离心5 min,取上层血清置于-80℃冰箱保存。采用酶联免疫法进行集中一次性检测血清HO-1含量,检测过程严格按照德国罗氏公司操作说明书进行。
1.3预后调查:所有患者随访到2021年8月1日,调查与记录患者的生存时间;同时调查患者的临床病理特征,包括淋巴结转移、临床分期、组织学分化、肿瘤最大直径等指标。
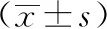
2 结果
2.1两组人群的一般资料比较:胃癌组中男92例,女88例;平均体重指数(22.33±1.84)kg/m2;年龄22~78岁,平均(56.67±2.22)岁。对照组中男91例,女89例;平均体重指数(22.83±1.02)kg/m2;年龄24~79岁,平均(56.53±2.11)岁。两组的性别、年龄、体重指数比较差异无统计学意义(P>0.05)。
2.2胃癌组患者的预后情况:胃癌组所有患者随访到2021年8月1日,平均随访时间为(18.28±2.48)个月;生存155例,死亡25例,死亡率为13.9%,平均生存时间为(14.21±1.24)个月。
2.3两组人群的血清HO-1水平比较:胃癌组患者的血清HO-1水平(10.24±1.48)ng/ml高于对照组的(4.09±0.83)ng/ml,差异有统计学意义(P<0.05)。在胃癌组中,死亡患者的血清HO-1水平(14.24±0.98)ng/ml高于非死亡患者的(7.09±0.33)ng/ml,差异有统计学意义(P<0.05)。
2.4胃癌组不同预后患者的病理特征比较:在胃癌组中,死亡患者的淋巴结转移、肿瘤直径、病理类型、临床分期、分化类型等与非死亡患者比较差异有统计学意义(P<0.05)。见表1。
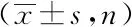
表1 胃癌组不同预后患者的病理特征比较
2.5胃癌组患者病理特征、术后死亡与HO-1的相关性分析:在胃癌组中,Spearsman相关分析显示术后死亡、临床分期、肿瘤最大直径、组织学分化、淋巴结转移与HO-1都存在相关性(P<0.05)。见表2。
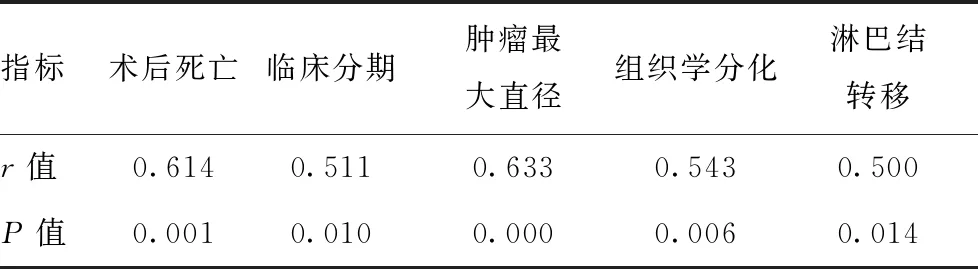
表2 胃癌患者病理特征、术后死亡与HO-1的相关性(n=180)
2.6影响胃癌患者预后的因素分析:在胃癌组中,多因素Cox比例风险模型分析显示HO-1为影响患者术后死亡的重要因素(OR=2.273,95%CI=1.349~3.861,P=0.013,β=1.809,SE=0.671,Wald=6.225)。
2.7HO-1预测价值:ROC曲线显示HO-1预测胃癌患者术后死亡的曲线下总面积为0.811(P=0.002),最佳阈值为11.88 ng/ml,敏感度与特异度分别为75.5%和86.9%。见图1。

图1 HO-1预测胃癌患者术后死亡的ROC曲线
3 讨论
胃癌为常见的恶性肿瘤,在我国的病死率一直较高,由于各种因素的影响,有>80.0 %的胃癌患者确诊时已发展至中晚期,导致5年生存率一直较低,严重影响患者的生活质量[8]。现代研究表明肿瘤的发生发展是涉及多种因素、多种基因表达变化与多种细胞因子参与的过程,胃癌的早期诊断与检测有助于早期发现胃癌高危人群,也可对已有胃癌患者进行病情判断与预测预后[9]。随着分子生物学技术不断发展,肿瘤标志物在临床诊断上的应用越来越广泛。
HO-1也称为热休克蛋白32(HSP32)和诱导型HO,广泛分布于全身组织,易受激素、缺氧、金属离子、炎性因子等多种因素的影响。HO-1可诱导血红素的甲基桥裂解,然后生成铁离子、一氧化碳和胆红素,广泛地参与人体内的相关生理反应。本研究显示胃癌组的血清HO-1水平高于对照组(P<0.05),表明胃癌患者多伴随有血清HO-1水平的高表达。从机制上分析,HO-1具有诱导肿瘤转移、促进肿瘤血管生成、清除氧自由基、保护肿瘤细胞等作用,其也能够与细胞浆中的可溶性尿苷酸环化酶结合并使之激活,从而可调节肿瘤细胞功能和信息传递[10]。抑制恶性肿瘤细胞的HO-1活性,可促进肿瘤细胞凋亡,抑制细胞增殖并提高肿瘤细胞对于化疗药物的敏感性[11]。
胃癌是具有高发病率和高死亡率的恶性肿瘤之一,且当前的发病年均增长率显著高于其他消化道恶性肿瘤,且有年轻化的趋势[12]。根治性手术治疗仍然是胃癌的主要治疗方式,虽然近年来胃癌的诊疗技术取得了很大进步,但胃癌患者5年生存率仍然较低[13]。因此如何对胃癌术后患者的预后进行准确判断,对延长患者生存时间及制定治疗方案均具有重要意义。临床预测模型是判断肿瘤患者预后最准确和最具区分效力的方法之一,可根据各个变量因子的取值水平对患者预后进行个体化预测,目前在临床研究中逐渐得到广泛应用。目前评价结直肠癌预后常用根据患者的临床分期、肿瘤最大直径、组织学分化、淋巴结转移等因素具有一定的主观性,且获得上述指标对患者有一定的创伤性,很难作为预测性指标应用于临床[14]。随着分子生物学的发展,一些血清学生物标志物已经应用于恶性肿瘤的疾病判断与预后预测。本研究显示Spearsman相关分析显示胃癌患者术后死亡、临床分期、肿瘤最大直径、组织学分化、淋巴结转移与HO-1都存在相关性(P<0.05);多因素Cox比例风险模型分析显示HO-1为影响患者术后死亡的重要因素(P<0.05);ROC曲线显示HO-1预测胃癌患者术后死亡的曲线下总面积为0.811(P=0.002),最佳阈值为11.88 ng/ml,敏感度与特异度分别为75.5%和86.9%。从机制上分析,HO-1是一种微粒体酶,在细胞和组织被处于肿瘤应激反应时,HO-1可作为保护性蛋白被广泛诱导表达[15]。HO-1也可促进铁蛋白表达,抑制炎症反应,进一步阻止机体氧化损伤,从而保护机体细胞免遭补体活化介导的炎性损伤。同时HO-1诱导的氧化应激反应能诱导人脐静脉内皮细胞表达血管细胞黏附分子-1,可促进恶性肿瘤的增殖[16]。HO-1表达上升提示机体抗肿瘤免疫力下降,为肿瘤提供生长环境,有利于自身肿瘤的恶性增殖与转移,导致患者疾病恶化与预后变差[17-18]。本研究也存在一定的不足,纳入的患者数量比较少,单一的指标对胃癌的诊断与预测效果也都有一定的误差,将在后续研究中进行探讨。
综上所述,血清HO-1在胃癌中呈现高表达状况,与患者的临床病理特征存在相关性,是影响胃癌患者术后死亡的重要因素,评估患者预后也具有重要的价值。
