miR-143对妊娠期糖尿病胎盘葡萄糖代谢和线粒体功能的作用
2022-07-20麦彩园广东省妇幼保健院广东广州510010
麦彩园 (广东省妇幼保健院,广东 广州 510010)
妊娠期糖尿病(GDM)为育龄期的女性孕前有可能潜在的糖耐量异常,或糖代谢正常,到妊娠时才出现的以血糖升高为主要表现的代谢性疾病,是妊娠期常见的并发症[1]。据统计,全球约15.8%的妊娠妇女存在GDM[2]。GDM会影响母亲和后代。母体血糖升高会引起胎儿血糖升高,从而导致胎儿胰岛素分泌增加。 胰岛素是胎儿生长因子,可导致巨大胎儿,并增加剖宫产和胎儿出生创伤的风险,包括阴道撕裂、难产、窒息等[3]。胎盘本身的代谢对于全面了解胎盘如何调节营养物质的传递,能量平衡,胎儿的生长以及胎儿的程序发育至关重要。MicroRNA (miRNA)是一种非编码RNA,已经在调节细胞增殖、凋亡、代谢等多个领域被广泛研究[4],主要通过与靶基因的3' 端非编码区的结合,对靶因子产生调控作用,从而影响细胞的增殖、凋亡[5]。miR-143位于染色体5号位上,参与脂肪形成,在几种癌症中存在下调,可以抑制己糖激酶2(HK-2)并上调有氧糖酵解[6]。miR-143通过抑制Ⅰ型葡萄糖转运蛋白(GLUT1),抑制T细胞葡萄糖摄取和糖酵解,调控T细胞分化[7]。Hastie等研究表明,妊娠前肥胖或妊娠前糖尿病妇女的胎盘降低了线粒体呼吸链酶的表达,这可能对胎盘功能产生不利影响[8]。肿瘤细胞有氧环境下能够摄取葡萄糖,生成的丙酮酸不经过氧化磷酸化,而在胞质中酵解形成乳酸,为瓦氏效应(Warburg effect)或有氧糖酵解[9]。已有研究显示,胎盘滋养细胞具有相同的特性,依赖于有氧糖酵解供能[10]。本文研究GDM患者胎盘中miR-143的表达情况,检测滋养细胞有氧糖酵解代谢、线粒体功能有关指标水平,分析miR-143对GDM患者胎盘线粒体功能及葡萄糖代谢的影响。
1 资料与方法
1.1仪器及试剂
1.1.1仪器:实时PCR检测系统:Bio-Rad公司,美国。荧光素酶报告检测系统:Progmega公司,美国。
1.1.2试剂:酶联免疫吸附试验(ELISA)试剂盒、RNA提取试剂盒、反转录试剂盒、引物:Bio-Rad公司,美国。培养基、载体、胎牛血清、脂质体Lipofectamine 2000、pMiR report质粒:Invitrogen公司,美国。质粒抽提试剂盒:Takara公司,中国。miR-143模拟物(miR-143 mimics)和对照物(miR-143 NC)、RNAiMAX:Qiagen公司,德国。Trizol试剂:Takara公司,中国。
1.2收集胎盘组织:本方案按照赫尔辛斯基宣言有关规定,经由本院医学伦理委员会审查通过,患者签署知情同意。选择2019年8月~2021年7月在本院行剖宫产的GDM患者30例,收集胎盘的原发性绒毛滋养细胞,分为两组:Diet组为单纯饮食组,Drug组为胰岛素治疗,每组15例。另外对照组15例为无妊娠并发症的孕妇,收集顺产后胎盘组织。三组均为单胎妊娠。胎盘娩出后,清理胎盘表面,自母体面-胎儿面获取1 cm×1 cm大小的全层胎盘组织,去除羊膜,随机取3个部位,冷冻并储存在-80℃冰箱。
1.3胎盘匀浆组织ELISA测定:使用夹心ELISA在胎盘匀浆中测量人胎盘催乳素(hPL),在涂有与辣根过氧化酶结合的抗hPL抗体包被的孔中将等份的胎盘匀浆孵育。结合的过氧化物酶量和匀浆中hPL的浓度成正比。
1.4实时定量反转录聚合酶链反应(RT-qPCR):将样品移到1 ml RNAiso Plus液的EP管,混和均匀,加入氯仿0.2 ml,混和均匀,离心。上层水相移至离心管,加入异丙醇,离心。移去上清液,然后加入乙醇。混和均匀,离心弃去上清液,再加无RNA酶水40 μl,读取OD值。反转录将RNA合成cDNA。用Primer Premier5.0软件设计、Takara公司合成的引物,引物序列:miR-143上游引物5'-GCCGGCGCCCGAGCTCTGGCTC-3',下游引物5'-TGAGATGAAGCACTGTAGCTC-3';上游引物5'-GLUT1 CACATGCCTTCTTTGCCAAG-3',下游引物5'-TCTATACACAGCAGGGCAGGA-3';HK-2上游引物5'-AGCGACGTGGCTATTGTGAAG-3',下游引物5'-GTACTCCCCTCGTTTGTGCAG-3';磷酸果糖激酶(PFK)上游引物5'-GTACGAATTCTTGGCCTGACCTGAAT-3',下游引物5'-GCGCCCCGGGCCGACTCTTATGTTGTGT-3';乳酸脱氢酶(LDH)上游引物5'-TATCGAGAATCTGATCGCAGAAGAC-3',下游引物5'-GGGCAACAAGTTCATCAGCCAAATCC-3';过氧化物酶体增殖活化受体γ辅助活化因子1α(PGC-1α)上游引物5'-GACCACAAACGATGACCCTC-3',下游引物5'-ATGTTGCGACTGCGGTTG;-3'过氧化物酶体增殖物受体γ(PPARγ)上游引物5'-GCAGTGGGGATGTCTCATAATGC-3',下游引物5'-CAGGGGGGTGATGTGTTTTGAAC-3';U6上游引物5'-GGTGGTGGAGAACTCTTCA-3',下游引物5'-GAGCAGCGTCTTCAGGAGCA-3'。反应体系: TaqMan®Fast Advanced Master Mix(2×)10 μl, TaqMan®Advanced miRNA Assay(20×)1 μl, cDNA反应液(1∶10 稀释)5 μl,无核酸酶水4 μl。按以下条件扩增:95 ℃ 20 s;95 ℃ 1 s,60 ℃ 20 s,40个循环。miR-143选择U6做内参,其他因子选择3-磷酸甘油醛脱氢酶(GAPDH)为内参。检测三组miR-143的表达;三组GLUT1、HK-2、PFK、LDH的水平;三组PGC-1α、PPARγ的水平。使用Rotor-Gene Q Software计算Ct值,用2-ΔΔCT表示相对表达量。所有样本重复3遍。
1.5细胞分离与培养:用酶消化和percoll梯度纯化法从胎盘中分离出绒毛滋养细胞。将细胞接种在Seahorse XF24板,置于37 ℃、5%CO2孵箱,在浓度17 mmoL/L的葡萄糖DMEM培养基中培养。
1.6双重荧光素酶报告基因检测、miR-143 mimics进行转染:在基因网站http://www.targetscan.org/vert_70/上寻找miR-143靶向作用的基因GLUT1(SLC2A1即GLUT1)。将指数生长的滋养细胞以2×105/cm2的密度接种至12孔板,细胞融合达80%,将miR-143 mimics及miR-143 NC进行转染(按Lipofeetamine 2000转染试剂盒说明书的方法),设只加Lipofectamine 2000的对照组。从Drug组胎盘分离的滋养细胞,用1 nmoL/L miR-143 mimics或阴性对照miRNA转染,再于24 h后,细胞被洗净并转染,野生型3’UTR GLUT1和突变型3’UTR GLUT1的pGL3-,荧光素酶报告实验测量细胞的荧光强度。以miR-143 mimics转染Drug组滋养细胞,RT-qPCR检测GLUT1、HK-2、PFK、LDH的水平以及PGC-1α、PPARγ的水平。
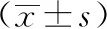
2 结果
2.1三组临床资料比较:三组患者年龄、体重指数(BMI)、孕周、胎儿重量、口服葡萄糖耐量试验(OGTT)0 h血糖(OGTT 0 h PG)、OGTT 2 hPG比较,差异无统计学意义(P>0.05);Diet组较对照组、Drug组胎盘重量增加,胎儿/胎盘重量减少,差异有统计学意义(P<0.05)。见表1。
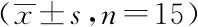
表1 三组临床资料比较
2.2ELISA法检测三组hPL:Diet组hPL含量明显高于对照组,Drug组hPL含量明显高于Diet组和对照组,差异均有统计学意义(P<0.05)。见图1。

图1 三组入选者胎盘hPL相对表达量比较

图2 miR-143在三组滋养细胞表达量比较
2.3RT-qPCR检测三组miR-143水平:miR-143在Drug组滋养细胞中相对表达量均明显低于对照组和Diet组,差异均有统计学意义(P<0.05)。见图2。
2.4RT-qPCR检测三组糖代谢指标和线粒体功能:与对照组和Diet组比较,Drug组胎盘中糖代谢相关指标GLUT1、HK-2、PFK和LDH显著上调,差异有统计学意义(P<0.05);与对照组比较,Diet组、Drug组中线粒体呼吸功能相关指标PGC-1α、PPARγ显著下调,且Drug组PGC-1α、PPARγ显著低于Diet组,差异均有统计学意义(P<0.05)。见图3、图4。

注:*P<0.05图3 三组GLUT1、HK2、PFK和LDH的水平
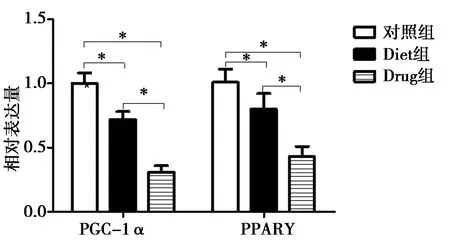
注:*P<0.05图4 三组PGC-1α、PPARγ的水平
2.5miR-143可靶向调控GLUT1表达:使用数据库http://www.targetscan.org/vert_70/验证miR-143与GLUT1的潜在结合靶点,其结合位点见图5。而荧光素酶报告基因结果显示miR-143可显著抑制野生型pMIR-GLUT1-WT的荧光素酶活性,而不影响突变型pMIR-GLUT1-MT荧光素酶活性。见图6。

图5 数据库预测miR-143和GLUT1结合(SLC2A1即是GLUT1)

注:*P<0.05图6 荧光素酶报告基因结果
2.6miR-143 mimics转染对葡萄糖代谢、线粒体功能的影响:以miR-143 mimics转染Drug组滋养细胞后,GLUT1、HK2、PFK和LDH表达明显降低,而PGC-1α、PPARγ的表达明显升高,差异均有统计学意义(P<0.05)。见图7、图8。
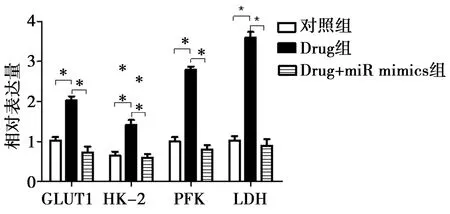
注:*P<0.05图7 miR-143对滋养细胞糖代谢指标的影响

注:*P<0.05图8 miR-143对滋养细胞线粒体功能的影响
3 讨论
胎盘在母体和胎儿同种异体移植物之间提供免疫界面,在母体和胎儿之间运输营养物质和废物,并且是影响胎儿、胎盘和母体新陈代谢和发育的肽和类固醇激素的来源。胎盘被认为在GDM的发病机制中起着至关重要的作用,具有物质交换、防御、合成及免疫功能,因为与GDM相关的并发症会在胎盘分娩后消失[11]。本研究结果说明GDM的胎盘肥大,可以在其呼吸减少时维持胎儿的质量。
hPL对胎儿的生长、胎盘的功能均有影响,它是在孕期适应母体内分泌胰腺的主要刺激因素,增加了β细胞的大量胰岛素生成,从而帮助母体在妊娠期间弥补高血糖。在整个妊娠过程中,hPL的浓度逐渐增加,并直接分泌到胎儿和母体循环中,临床上测定hPL mRNA反映胎盘功能状态及胎儿宫内发育情况,胎盘变大与母体血液中的hPL水平升高有关[12]。本研究结果符合胎盘组织的hPL水平在GDM患者中明显增加的表现,也符合胎盘变大与母体hPL水平升高有关的理论。
在健康的人类和大鼠中,进入胎盘的葡萄糖中至少有33%是通过线粒体的氧化磷酸化来实现代谢,可以满足高代谢率的滋养细胞[13]。PPARγ是一类转录因子,通过促进能量沉积或能量耗散来调节能量平衡,PGC-1α是PPARγ的共激活因子,可诱导促进线粒体的生物发生与脂肪酸氧化,PGC-1α和PPARγ的下调都有助于降低Drug组胎盘中的线粒体功能[14-15]。沉默信息调节蛋白(SIRT1)过表达可能通过介导PPARy通路对肥胖大鼠肝脏的脂肪沉积、变性及氧化应激起到了调节作用[16]。妊娠前肥胖或妊娠前糖尿病妇女的胎盘降低了线粒体呼吸链酶的表达,这可能对胎盘功能产生不利影响[8]。本研究说明GDM患者的胎盘线粒体功能受损,可能是胎盘代偿肥大的原因。这与之前研究的妊娠并发先兆子痫和母体肥胖的孕妇胎盘中线粒体呼吸复合物的表达和活性降低,肥胖母亲胎盘分离的滋养层细胞中的呼吸减少一致[17];也与高脂饮食大鼠中的研究[14]一致。
GLUT1是葡萄糖进入细胞的唯一载体,HK-2是糖酵解途径的第一个酶,PFK-1是糖酵解的限速酶,是反映最主要的调控位点,LDH在糖代谢中起着重要作用。它们的表达水平对GDM的严重程度和预后有诊断和预测价值[18]。GLUT1与糖代谢紧密相关,参与孕妇与胎儿的葡萄糖转运,是胰岛素转导途径的最终一步,其在胎盘组织中含量的高低对GDM有重要意义[18]。研究显示经野生型p53诱导的磷酸酶1(Wip1)特异性抑制剂(GSK2830371)治疗,PFK、HK-2和LDH的活性以及肝脏乳酸量均增高,可以进一步促进肝再生并提高肝细胞的有氧糖酵解水平[19]。达英-35联合二甲双胍治疗大鼠,在卵巢水平上改善其内分泌功能,促进卵泡颗粒细胞增殖,其机制是通过提高糖酵解相关限速酶(GLUT1、HK-2、PFK和LDH)的表达,维持卵泡发育所需要的能量[20]。本研究与糖尿病妊娠中基底膜GLUT1转运蛋白表达增加的报道一致[21]。GDM胎盘中葡萄糖的可用性和消耗量的增加可能反映在糖酵解途径中限速酶的表达或活性增加。
Muralimanoharan研究发现来自受药物控制的GDM胎盘组织中的miR-143明显降低了50%,miR-143的过表达减少了糖酵解;发现受药物控制的GDM胎盘中hPL显著升高,线粒体功能降低,糖酵解增加,miR-143和自噬相关蛋白(mTOR)活化降低,miR-143过表达能够部分拯救线粒体功能并减少受药物控制的GDM胎盘滋养层细胞中的糖酵解酶[22]。本研究再次证实了以上结论。
本研究中荧光素酶报告基因法检测miR-143可靶向调控GLUT1表达。以miR-143 mimics转染Drug组绒毛滋养细胞后,其结果提示miR-143过表达可导致糖酵解减少,线粒体功能升高。
综上所述,GDM患者hPL明显升高,miR-143表达降低,糖酵解增加,线粒体功能降低。miR-143可靶向调控GLUT1,miR-143过表达能够部分挽救线粒体功能并减少GDM胎盘滋养细胞中的有氧糖酵解。本文样本量较小,对于miR-143的表达与患者临床资料的相关性还存在不足,而miR-143对线粒体的调控机制可待进一步研究。
