载药微球加载不同药物化疗栓塞治疗肝细胞癌的疗效探讨
2022-07-20谢炳灿叶书文胡鸿涛陈欣菊张玉元王若愚李春霞周纪妹张延藏
李 臻, 谢炳灿, 叶书文, 李 鑫, 吴 刚, 胡鸿涛, 陈欣菊, 吴 阳,于 琦, 张玉元, 余 鹏, 王若愚, 李春霞, 周纪妹, 张延藏
经动脉化疗栓塞术(transarterialchemoembolization,TACE)治疗中晚期肝细胞癌(hepatocellular carcinoma,HCC)疗效已得到临床公认,并被诸多指南推荐[1]。近年来,载药微球化疗栓塞术(drug-eluting beads transarterial chemoembolization,DEB-TACE) 在临床得到广泛应用,近期疗效优于传统TACE[2-4]。 DEBTACE 治疗HCC 常规加载的是蒽环类药物(阿霉素、表柔比星、吡柔比星等)[5],亦有研究报道加载雷替曲塞、 三氧化二砷等药物[6-7]。 本研究探讨CalliSpheres 载药微球(C-DEB)分别加载吡柔比星、雷替曲塞和三氧化二砷治疗HCC 的临床疗效及安全性。
1 材料与方法
1.1 病例分组和纳入排除标准
回顾性分析2016 年6 月至2020 年5 月在郑州大学第一附属医院接受DEB-TACE 治疗的303 例HCC 患者临床资料,排除使用不同类型微球62 例,术中灌注药物不一致39 例, 合并其他肿瘤15 例,临床资料不全37 例,最终纳入150 例患者。 根据加载药物分为A、B、C 3 组,A 组50 例加载吡柔比星,B组50 例加载雷替曲塞,C 组50 例加载三氧化二砷。
纳入标准:①经组织病理学证实或符合诊断标准的HCC 患者; ②肝功能Child-Pugh A 或B 级;③无法外科切除或拒绝手术,至少有一个可测量病灶;④无心、肺、肝、肾等脏器严重功能障碍。 排除标准:①肝功能Child-Pugh C 级;②合并其他恶性肿瘤;③严重脏器功能及凝血功能障碍;④临床或随访资料不全。 本研究经郑州大学伦理委员会批准,所有患者均签署知情同意书, 且至少完成一次DEB-TACE 治疗。
1.2 手术器械
0.035 英寸亲水膜导丝(日本泰尔茂公司)、5 F RH 导管(美国库克公司)、穿刺针及5 F 血管鞘(美国麦瑞通公司)、2.3 F 微导管系统(日本泰尔茂公司)、100~300 μm 及300~500 μm CalliSpheres 载药微球(苏州恒瑞迦俐生生物医药科技有限公司,批号20153131072)、普通栓塞微球(苏州恒瑞迦俐生生物医药科技有限公司,批号20153131072)、350~560 μm 明胶海绵(杭州艾力康公司)、350~560 μm聚乙烯醇颗粒(杭州艾力康公司)、吡柔比星(深圳万乐药业有限公司,批号H10930105)、雷替曲塞(南京正大天晴制药有限公司,批号H20090323)、三氧化二砷(北京双鹭药业股份有限公司,批号H20080665)。
1.3 介入治疗方法
载药微球配制采用20 mL 注射器抽取载药微球,竖直放置2~3 min,待微球沉降后排出上清液;用10 mL 注射器抽取0.9%NaCl 或5%葡萄糖水溶解60~80 mg 吡柔比星、4 mg 雷替曲塞或60 mg 三氧化二砷,与微球进行混合,每间隔5 min 轻摇注射器,载药时间分别为15 min、15 min 和40 min。
患者取仰卧位,常规消毒铺巾,局麻后以改良Seldingers 法穿刺右股动脉, 导丝引导下引入5 F RH 导管至肝总动脉、 肠系膜上动脉或膈肌动脉等行血管造影以明确肿瘤供血动脉, 评估肿瘤大小、数量及有无肝动脉-门静脉/肝静脉瘘等。 以导管或微导管超选至责任血管, 缓慢灌注100 mg 奥沙利铂、500 mg 氟尿嘧啶水化液各100 mL。 分别以加载吡柔比星、雷替曲塞、三氧化二砷的载药微球栓塞肿瘤,栓塞终点为复查造影示肿瘤染色消失。 若仍有肿瘤染色, 可追加普通栓塞微球或明胶海绵颗粒、聚乙烯醇颗粒巩固栓塞。
1.4 疗效评价与随访
于治疗后1、3 和6 个月患者行肝脏增强CT 或MRI 检查, 根据改良实体瘤疗效评价标准(mRECIST)评估疗效:完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。 对影像学检查提示有肿瘤残余或新发病灶者,则行巩固栓塞治疗。 评价3 组患者术后1、3 和6 个月的客观缓解率(ORR)、疾病控制率(DCR)。 随访1~46 个月,记录无进展生存期(PFS)和总生存期(OS)。 比较3 组患者治疗前与治疗后1 个月血常规、AFP、肝功能等指标,观察有无严重不良事件发生。 随访终点为2020年12 月31 日或患者死亡。
1.5 统计学分析
采用SPSS21.0 统计学软件进行数据处理。正态分布的计量资料以±s 表示,3 组间比较采用单因素方差分析,两两比较采用LSD-t 检验;计数资料以例数(%)表示,比较用χ2检验;疗效分析用Kruskal-Wallis 秩和检验,生存差异采用Log-rank 检验。 P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料
3 组患者基线资料比较差异均无统计学意义(均P>0.05),见表1。

表1 3 组患者基线资料比较
2.2 实验室指标
治疗后1 个月,3 组患者肝功能均有不同程度好转,AFP≥400 μg/L 例数均较治疗前减少, 特别是C 组患者治疗前后差异有统计学意义(P=0.009)。治疗后3 组患者肝功能指标比较差异无统计学意义(P>0.05),C 组AFP≥400 μg/L 的例数少于其他两组,差异有统计学意义(P<0.05)。 见表2。
表2 介入治疗前后3 组患者AFP 和肝功能水平比较 (±s)

表2 介入治疗前后3 组患者AFP 和肝功能水平比较 (±s)
组别 例数 AFP≥400 μg/L AST(U/L) ALT(U/L) ALP(U/L) Alb(g/L) TBil(μmol/L)A 组 50治疗前 30(60.0) 54.35±33.33 40.13±29.71 114.89±35.31 37.67±7.00 16.98±12.87治疗后1 个月 25(50.0) 51.48±34.15 39.42±28.84 110.04±29.69 34.30±5.78 15.40±9.72 B 组 50治疗前 30(60.0) 57.00±31.19 47.08±34.80 132.38±69.72 38.69±4.54 14.18±5.61治疗后1 个月 24(48.0) 53.62±37.85 43.58±36.58 124.14±63.41 35.77±5.12 15.07±9.80 C 组 50治疗前 21(42.0) 55.20±28.57 46.86±28.85 133.82±78.45 36.99±4.25 16.23±10.50治疗后1 个月 12(24.0) 47.51±29.79 34.04±17.96 121.74±51.34 35.23±5.24 15.32±10.90
2.3 疗效评价
治疗后1 个月,3 组患者的ORR 分别为86%、68%和84%,其中A 组与B 组比较差异有统计学意义(P=0.032);3 组患者的DCR 分别为94%、88%和98%,差异无统计学意义(P>0.05)。
治疗后3 个月,3 组患者的ORR 分别为74%、44%和70%,A 组与C 组均高于B 组, 差异有统计学意义(P=0.002、0.009);3 组DCR 分别为86%、66%和80%, 其中A 组与B 组比较差异有统计学意义(P=0.019)。
治疗后6 个月,3 组患者的ORR 分别为54%、46%和48%,DCR 分别为66%、66%和62%,差异均无统计学意义(P>0.05)。 见表3。

表3 3 组患者术后疗效比较 [例(%)]
2.4 生存分析
采用Kaplan-Meier 法进行生存分析,A 组、B 组和C 组患者的OS 分别为32.5 个月、22.1 个月和24.9 个月,差异无统计学意义(P>0.05);PFS 分别为10.1 个月、8.5 个月和12.0 个月,差异无统计学意义(P>0.05)。
2.5 不良反应
3 组患者术后不良反应主要表现为栓塞后综合征及骨髓抑制,临床表现为发热、肝区疼痛、恶心呕吐,术后经止吐、镇痛、应用升白药物及抗生素治疗后症状均好转。 组间不良反应发生率比较差异均无统计学意义(均P>0.05)。 见表4。

表4 3 组患者不良反应发生情况比较 [例(%)]
2.6 影像学表现
1 例63 岁男性HCC 患者的影像学表现见图1,1 例45 岁女性HCC 患者的影像学表现见图2。
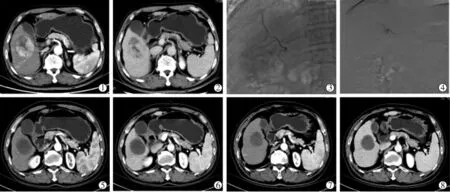
图1 患者男,63 岁,CT 可见肝右叶HCC

图2 患者女,45 岁,CT 可见肝右叶HCC
3 讨论
TACE 作为我国中晚期肝癌的主要治疗手段,相关指南推荐其适应证为Ⅱb 及Ⅲa 期, 也包括不能手术的Ⅰb 期和Ⅱa 期患者[1]。 BCLC 临床肝癌分期系统虽仅推荐B 期患者,但临床研究表明,对于A 期及C 期患者,TACE 亦有明显疗效[8-9]。传统TACE是以碘化油和化疗药乳剂来栓塞肿瘤, 疗效受肿瘤血供特点影响,且化疗药反复进入体循环亦增加全身不良反应[10]。 DEB-TACE 是当前介入医学研究的热点之一,CalliSpheres 载药微球(C-DEB)作为国产新型栓塞剂,在缓释加载药物、提高局部药物浓度的同时,可精准栓塞肿瘤血管床[11-13]。 文献报道,DEBTACE 治疗肝癌在局部肿瘤控制和延长生存期方面,优于传统TACE[11]。
C-DEB 主要通过自身的负电荷离子团吸引正电荷化疗药物来完成加载, 常见加载药物是蒽环类,如阿霉素、表柔比星、吡柔比星等[14]。 研究表明,C-DEB 可加载的药物种类在逐步增加,加载三氧化二砷的DEB 在栓塞肝癌细胞后,能通过抑制VEGF mRNA、VEGF 高 表 达 而 抑 制HepG2、MHCC97H 细胞[15],其最大载药率约为23%[7]。雷替曲塞作为一种新型细胞毒药物,通过特异性抑制胸腺嘧啶合成酶从而抑制肿瘤细胞DNA 合成, 来产生抗肿瘤作用,亦可应用于肝癌的TACE 治疗[16-17]。 研究报道,C-DEB 可加载雷替曲塞,最大载药率达60%[6]。
本研究回顾性分析C-DEB 分别加载吡柔比星、 雷替曲塞和三氧化二砷栓塞治疗HCC 患者的临床资料, 结果显示术后1 个月吡柔比星组ORR、DCR 分别为86%、94%, 术后3 个月ORR、DCR 分别为74%、86%,与王文辉等[18]报告的术后1 个月ORR(92%)和DCR(100%)及术后3 个月ORR(76%)和DCR(88%)结果基本一致。Lee 等[14]报道,加载吡柔比星化疗栓塞治疗HCC 术后1 个月ORR 达91.4%,与本研究相符。三氧化二砷组术后1 个月和术后3 个月的ORR、DCR 与文献报告基本一致[19]。 组间比较发现, 吡柔比星组术后1 个月、3 个月的ORR 均高于雷替曲塞组; 三氧化二砷组术后3 个月ORR 高于雷替曲塞组。 分析组间疗效差异原因:①载药微球释放药物速度不同,0.5 h 药物释放率吡柔比星为50%[20],雷替曲塞高达80%[6],三氧化二砷为31.4%[7]。与其他两组相比,雷替曲塞短时间内即可从微球内大量释放,不能长时间作用于肿瘤部位,可能影响疗效;②药物抗肿瘤机制不同,雷替曲塞仅抑制肿瘤细胞DNA 合成, 而吡柔比星与三氧化二砷均可干扰肿瘤细胞DNA 及mRNA 合成, 具有较强的抗肿瘤活性[21];③术者在DEB-TACE 术中能否做到精准超选、不遗漏寄生血管,也会影响疗效。
患者的OS 和PFS 是本研究的主要观察指标。吡柔比星组OS、PFS 分别为32.5 个月、10.1 个月,与既往报道相符[20];雷替曲塞组分别为22.1 个月、8.5 个月;三氧化二砷组分别为24.9 个月、12.0 个月;3 组差异无统计学意义。 本研究中多数病例配有不同方案的系统治疗,对研究结果可能有一定影响。3 组患者术后1 个月AFP 均有不同程度降低,肝功能均较术前好转,体现了DEB 局部缓释药物的特性。
3 组患者术后不良反应发生率差异无统计学意义, 但雷替曲塞要低于吡柔比星及三氧化二砷,相关症状发生率与既往报道相符[18]。
总之,C-DEB 加载吡柔比星和三氧化二砷治疗HCC 的近期疗效优于雷替曲塞,但雷替曲塞组术后不良反应相对较轻,总体治疗技术安全可行。 但本研究可能存在一定的干扰因素,如组间及组内载药微球粒径选择不一致,联合靶向或免疫治疗时方案亦有差别,这些可能影响研究结果。 此外,必须强调肝癌的个体化综合治疗, 建立以介入治疗为基础,辅助靶向、免疫等综合治疗策略。