相位角在结直肠癌手术患者营养评估及预后预测中的应用
2022-07-19洪芳静卓嘉璐郭盼盼
洪芳静, 韩 婷, 卓嘉璐, 李 伟, 郭盼盼
(1. 安徽理工大学医学院,安徽 淮南 232001; 2. 同济大学附属第十人民医院临床营养科,上海 200072)
结直肠癌(colorectal cancer, CRC)是消化道常见恶性肿瘤,我国CRC的发病率、死亡率在全部恶性肿瘤中分别位居第3及第5位[1]。20%的CRC患者伴有营养不良,营养不良会导致患者错过最佳手术时机,降低辅助治疗效果,增加并发症发生率,延长住院时间,并影响患者整体康复与预后[2],故针对CRC患者进行及时规范的营养评估尤为关键,为进一步行营养干预及改善预后提供依据。人体成分测定是分析肿瘤患者营养状况变化、评估营养不良程度的良好工具[3],生物电阻抗法(bioelectrical impedance analysis, BIA)是一种通过电学方法进行人体体成分分析的技术,相位角(phase angle, PA)是由BIA法测得的容抗和电阻之比的反正切值,反映细胞完整性,其可有助于评价患者营养不良及预后[4-5]。本研究主要探讨PA在CRC手术患者营养评估及预后预测的应用,为改善CRC手术患者营养状况及预后提供依据。
1 资料与方法
1.1 一般资料
选取2020年4月—12月同济大学附属第十人民医院收治的结直肠癌手术患者241例为研究对象,其中男性138例(57.3%),女性103例(42.7%),年龄23~90岁,平均年龄(64.86±11.84)岁,肿瘤部位: 左半结肠72例,右半结肠57例,直肠112例。术后病理分型: 腺癌221例,黏液腺癌16例,印戒细胞癌4例。肿瘤TNM分期: 0期7例,Ⅰ期39例,Ⅱ期103例,Ⅲ期79例,Ⅳ期13例。纳入标准: (1) 年 龄≥18岁,术后病理证实为结直肠癌的患者;(2) 能进行正常的语言沟通;(3)同意参与本研究。排除标准: (1) 有认知功能障碍;(2) 严重恶病质,伴有腹水、双下肢水肿及脑、心、肺、肝、肾等重要脏器损害者;(3) 身体内有金属植入者(如心脏起搏器、心脏支架、骨折固定钢板等);(4) 四肢不健全的患者;(5) 体质量指数(body mass index, BMI)<16 kg/m2和>35 kg/m2(此范围BMI会影响BIA结果)[6]。
1.2 方法
1.2.1 人体测量指标 入院后24 h内应用上海力衡仪器仪表有限公司TZ120型120 kg身高体质量秤测量身高、体质量,根据公式计算体质量指数(body mass index, BMI),BMI=体质量(kg)/[身高(m)]2。
1.2.2 人体成分分析 入院后24 h内应用生物电阻抗法通过体成分分析仪InbodyS10(韩国Biospace)来测定体成分,由接受过统一正规操作流程培训的营养医师完成测量。测得PA及骨骼肌质量指数(skeletal muscle mass index, SMI),SMI=四肢骨骼肌质量(kg)/[身高(m)]2。根据KyleH[7]标准,生物电阻抗50 kHz,男性PA<5°、女性PA<4.6°定义为低PA,将研究对象分为低PA组和正常PA组。
1.2.3 营养筛查与评估 本研究采用营养风险筛查2002(Nutrition risk screening 2002, NRS 2002)、患者主观整体评估量表(Patient generated-subjective global assessment, PG-SGA)及全球领导人发起的营养不良倡议(Global Leadership Initiative on Malnutrition, GLIM)对所有研究对象入院48 h内进行营养筛查与评估,由同一临床营养医师面对面调查。
NRS 2002量表[8]包括3部分即营养状态受损评分、疾病严重程度评分和年龄评分(≥70岁加1分),总分≥3分为有营养风险。
PG-SGA量表[9]由患者自评(体质量、进食、影响进食的症状、身体活动功能)及医务人员评估(疾病、年龄和代谢、肌肉)两部分组成,各部分得分总和为营养评估得分,总分≥4分评定为营养不良。
GLIM诊断标准[10]第一步为营养筛查,本研究选用NRS 2002作为营养筛查工具。经NRS 2002筛查≥3分存在营养风险患者进一步行第二步营养不良诊断,评估标准包括: 3个表现型指标(非意向性体质量下降、低BMI和肌肉量丢失)和2个病因学指标(食物摄入或吸收降低、炎症或疾病负担)。诊断营养不良,应至少存在一种表现型指标和一种病因学指标。非意向性体质量下降的标准: 6个月内体质量丢失>5%或6个月以上体质量丢失>10%;低BMI标准: BMI<20 kg/m2(<70岁)或<22 kg/m2(≥70岁);依据亚洲肌肉减少症工作组(Asian Working Group for Sarcopenia, AWGS)专家共识推荐,本研究选取BIA测量的SMI作为肌肉量丢失判定指标: 男性SMI<7.0 kg/m2,女性SMI<5.7 kg/m2为异常[11]。
1.2.4 生化指标 入院后次日晨空腹,应用全自动生化分析仪测定前白蛋白(pre-albumin, PALB)、总蛋白(total protein, TP)、白蛋白(albumin,ALB)、血红蛋白(hemoglobin,HGB)、白细胞(WBC)、中性粒细胞、淋巴细胞、血小板(blood platelet, PLT)、C反应蛋白(C-reactive protein, CRP)、血CEA、血CA199、纤维蛋白原(fibrinogen,FBG)等,计算中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio, NLR)、血小板/淋巴细胞比值(platelet-to-lympho-ccyte ratio, PLR)、预后营养指数(prognostic nutri-tional index, PNI)。PNI=血清白蛋白值(g/L)+5×外周血淋巴细胞总数(×109/L)。并行改良格拉斯哥预后评分(modified Glasgow Prognostic Score, mGPS): CRP≤10 mg/L计为0分,CRP>10 mg/L并ALB≥35 g/L计为1分,CRP>10 mg/L并ALB<35 g/L计为2分。
1.3 统计学处理
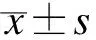
2 结 果
2.1 两组患者一般情况比较
本研究共纳入研究对象为241例,其中正常PA组165例(68.5%),低PA组76例(31.5%)。两组患者在性别、肿瘤分期、病理类型分布无统计学差异(P>0.05)。两组患者的年龄及肿瘤部位分布有统计学差异,低PA组年龄[(70.68±12.07)岁]较正常PA组年龄[(62.18±10.74)岁]明显上升,差异有统计学意义(P<0.001),低PA组右半结肠癌罹患比例(35.5%)明显高于正常PA组(18.2%),差异有统计学意义(P<0.05)。
2.2 不同营养状况组间PA比较
为比较不同营养状况PA的差异,按NRS 2002分组,结果显示无营养风险组PA值明显高于营养风险组(P<0.05)。按PG-SGA及GLIM分组,结果均显示无营养不良组PA值明显高于营养不良组(P<0.05),见表1。

表1 不同营养状况组间的PA比较Tab.1 Comparison of PA in patients with different nutritional status
2.3 PA与不同营养评定工具一致性比较
PA标准分别与NRS 2002、PG-SGA、GLIM行Kappa一致性检验结果显示,PA与NRS 2002(K=0.265,P=0.000)、GLIM(K=0.404,P=0.000)存在一致性,与PG-SGA不存在一致性(K=0.097,P=0.084)。
2.4 2组患者营养及预后指标比较
低PA组的BMI、SMI、PALB、TP、ALB、HGB、PNI(P<0.05)低于正常PA组,低PA组的年龄、FBG、NLR、PLR高于正常PA组(P<0.05)。2组mGPS评分分布有统计学意义(P<0.001)。低PA组并发症(包括肠梗阻、切口感染、腹腔感染、吻合口瘘、心血管疾病、肺部感染、胃肠功能紊乱、脑梗死、意识障碍、消化道出血等)较正常PA组增多(P<0.001),2组患者血CEA、血CA199阳性分布无差别,见表2。

表2 2组患者营养及预后指标比较Tab.2 Comparison of nutrition and prognostic indicators between two groups
2.5 PA与各变量的相关性
单因素差异有统计学意义的,进一步行Spearman相关性分析,PA与年龄、FBG、NLR、PLR、NRS2002、PG-SGA、mGPS、GLIM呈负相关,与BMI、SMI、PLAB、TP、ALB、HGB、PNI成正相关(P<0.05),见表3。
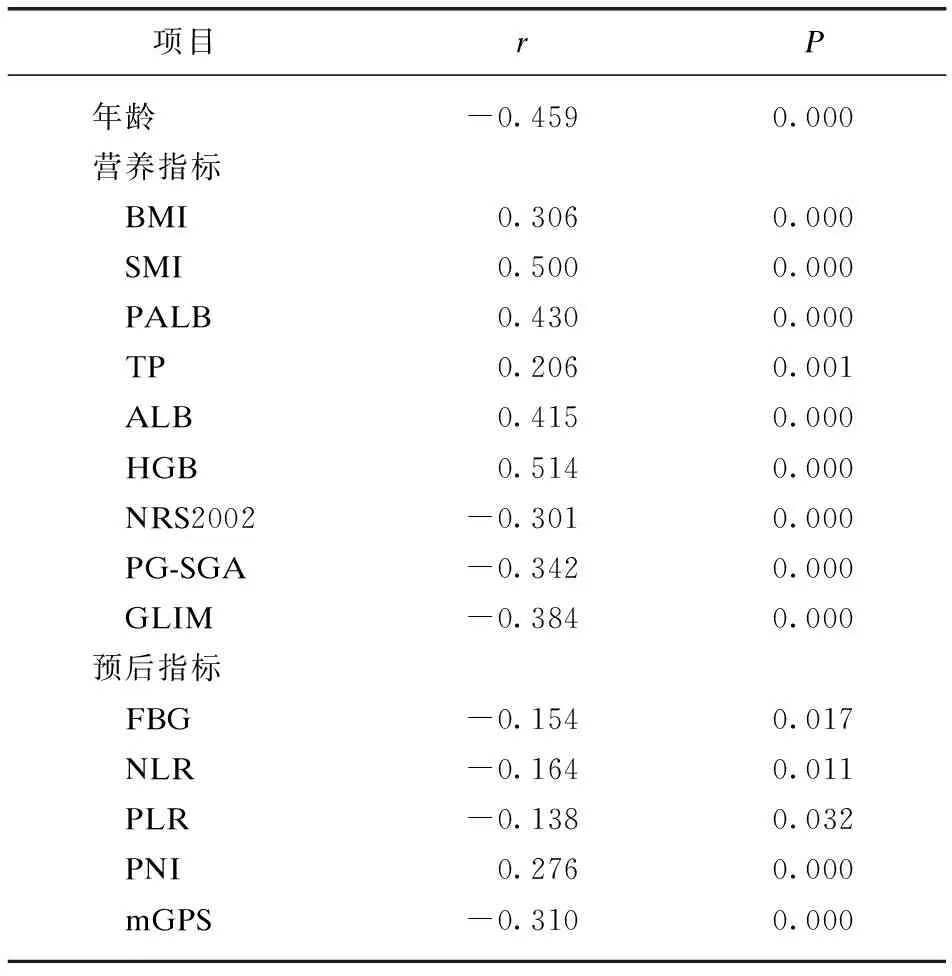
表3 CRC手术患者PA与各变量的相关性Tab.3 Correlations of phase angle with other variables in patients with CRC undergoing surgery
2.6 PA和多变量之间的多元线性回归分析
相关性分析提示有统计学意义的,进一步行多元线性回归分析,以PA为因变量,以年龄、BMI、SMI、PLAB、TP、ALB、HGB、NRS2002、PG-SGA、GLIM、FBG、NLR、PLR、PNI、mGPS为自变量,结果显示年龄、SMI、PALB、HGB、GLIM、PNI、mGPS对PA的影响,差异有统计学意义(P<0.05),见表4。
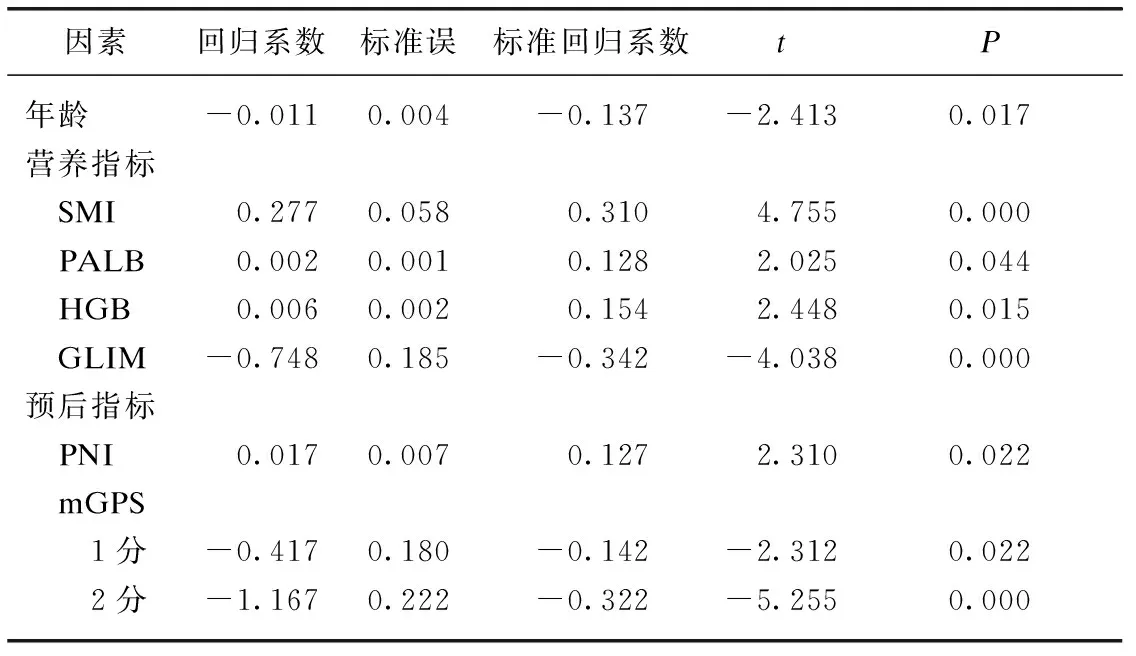
表4 CRC手术患者PA和多变量之间的多元线性回归Tab.4 Multiple linear regressionof PA with multiple variables in patients with CRC undergoing surgery
3 讨 论
3.1 PA与营养状况
有研究证实PA与食管癌、肺癌及胸外手术患者营养状况相关[12-15],本研究亦提示PA与营养指标密切相关,低PA组BMI、SMI、PALB、TP、ALB、HGB低于正常PA组,PA与NRS 2002、PG-SGA、GLIM呈负相关,与BMI、SMI、PLAB、TP、ALB、HGB呈正相关,NRS 2002筛查营养风险组PA及PG-SGA、GLIM评定的营养不良组PA明显下降,PA标准与NRS 2002及GLIM均存在一致性,PA标准与PG-SGA不存在一致性,考虑与PG-SGA涵盖了更多主观反映营养状态的维度及样本量不足等因素有关。PA可作为CRC患者肌肉异常和功能的预测指标[16],本研究结果亦提示SMI与PA正相关,且为PA独立影响因素,提示PA有利用识别CRC患者肌少症的发生。本研究提示PALB为PA独立影响因素,PALB作为一种半衰期很短的急性负时相反应蛋白,可以及时体现患者营养状况,术前低PALB水平有助于预测结肠肿瘤术后的短期预后[17],故相对于其他营养指标,PA可能更有助于及时反应患者营养状况。CRC患者常伴有贫血,右半结肠癌患者贫血发生率相对左半结肠癌及直肠癌更高,本研究提示低PA组的HGB明显下降,考虑与PA组右半结肠癌患者比例明显增加有关。HGB亦为PA独立影响因素,针对HGB下降的CRC患者,应及时行进一步营养评估,并积极纠正贫血。PA随年龄增长而下降[15],本研究亦提示低PA组患者较年长,PA与年龄呈负相关,年龄亦是PA独立影响因素,故相对于中青年,老年CRC患者的营养状况更应引起重视。综上所述,CRC手术患者PA与营养状况密切相关,故结合PA可以辅助CRC手术患者的营养诊断,利于及时了解营养不良情况,为进一步行营养干预提供依据。
3.2 PA与临床预后
研究表明PA与肝硬化、成人急性白血病、终末期肾病、心脏手术患者的预后及晚期癌症患者死亡率相关[18-22],本研究提示PA与CRC相关预后指标关系密切。NLR、PLR、PNI、mGPS等基于全身炎症、营养状况及免疫状态的预后指标,有利于更准确地预测CRC患者生存期和选择最佳治疗方案[23]。NLR、PLR可以较好评估机体免疫状态与肿瘤患者预后[24],CRC患者的高NLR及PLR提示预后差[25]。Luvian等[26]研究提示PNI是CRC患者重要且独立的预后因素。mGPS与CRC患者营养不良、术后并发症、术后5年生存率、总生存期均有关[27]。此外FBG亦促进肿瘤血管生成及肿瘤细胞转移,FBG和PLR联合可作为CRC患者治疗效果及预后的预测指标[28]。本研究提示低PA组的NLR、PLR、FBG均明显高于正常PA组,PNI低于正常PA组,低PA组的并发症明显增多,这与Nishiyama等[29]研究结直肠疾病手术患者低PA提示的营养不良是术后严重并发症的独立预测因素的结果相符。本研究提示PNI及mGPS为PA独立影响因素,因PNI及mGPS均包含有ALB,故考虑同时包含有营养参数的预后指标对PA值的影响更大。有研究提示血CEA、CA199亦可评估CRC预后[30],故纳入本研究观察指标,但2组间并未提示有统计学差异,考虑血CEA、CA199与患者营养及炎症状况关联较少,故不同PA组间无明显差异。综上所述,在CRC手术患者中,PA与NLR、PLR、PNI、mGPS等预后指标密切相关,低PA提示免疫炎症反应增加、术后并发症增多及预后不良,故PA可辅助预测CRC患者的预后。
在CRC手术患者中,PA作为无创、客观、快速的手段有助于营养状况及预后的评定,有利于帮助及时识别存在营养风险及预后欠佳的患者,为后续及时有效进行营养干预治疗提供更好的依据,从而改善CRC患者的预后。
