2021年诺贝尔生理学或医学奖解读
2022-07-18宋新强任雨轩何欢欢范金克赵丽君朱晓雯
宋新强, 任雨轩, 张 玉, 何欢欢, 范金克, 赵丽君, 朱晓雯,彭 涛
(1. 信阳师范学院 a. 生命科学学院; b. 医学院, 河南 信阳 464000; 2. 河南中医药大学 第二临床医学院, 河南 郑州 450003)
0 引言
恰当地感知周围的世界对人类的幸福至关重要。从避免吃变质的食物、看到和听到一辆驶来的汽车,到闻到漏气的气味或者感受到炉子燃烧的灼热,感官协同工作来维持人类的生命。因此,揭示支撑人类感官的分子和细胞机制的研究多次引起诺贝尔生理学或医学委员会的注意。听觉(1961年)、视觉(1967年)和嗅觉(2004年)等感受器,此前都已得到认可。2021年,因为发现了能够检测温度和触觉的受体,所以诺贝尔生理学或医学奖授予了David JULIUS(戴维·朱利叶斯)博士和Ardem PATAPOUTIAN(阿德姆·帕塔普蒂安)博士两位科学家。
他们工作的起源可以追溯到另一对诺贝尔奖获得者。1944年,ERLANGER博士和GASSER博士因在不同类型的周围神经纤维中形成动作电位的工作而获得诺贝尔奖。他们描述的外周神经元负责传递疼痛感,神经细胞是高度特化的细胞,可以识别和传递不同类别的刺激信号,使机体精确感知外周环境。比如: 通过指尖能够区分物体表面纹理的细微差别,也能分辨出令人舒适的和不适的热度。
然而,这个感知过程中有一个基本问题还没有答案: 温度和机械刺激如何转换为神经系统的电信号? 神经冲动究竟是如何产生从而让机体感受到温度和压力的? 这正是今年获奖的科学家们深度解答的问题。
1 发现温度感受器
机体对外界信息的感受,通过外周感觉神经元传入到脊髓和大脑。感觉这些不同刺激的神经元位于背根神经节(dorsal root ganglion, DRG) 和三叉神经节(trigeminal ganglion, TG),分别传导身体和头面部对温度、机械力、化学物质等多种刺激的感觉信息。根据所检测到的环境刺激,DRG神经元在功能上分为本体感受器、低阈值机械感受器和感知疼痛或温度的细胞[1]。其中,大部分感知温度的神经元也是伤害性感受神经元,可以通过对过热或过冷刺激的伤害性感受,保护机体免受伤害。本体感觉神经元和低阈值机械敏感神经元的外周分支在骨骼肌和皮肤等特殊器官中终止,而温度和痛觉神经元的轴突到达皮肤的表皮和真皮层并作为自由神经末梢(图1)。

注:a. 由传入(感觉)和传出(运动)神经根连接形成的脊神经为皮肤、骨骼肌、内脏和腺体提供周围神经支配。箭头表示传入感觉和传出脉冲的方向。运动神经元的胞体位于脊髓的腹角内。感觉神经元的胞体位于背根神经节(DRG)。DRG内有感觉神经元亚类,如本体感觉神经元(蓝色)、低阈值机械感觉神经元(红色)和温度和痛觉感觉神经元(绿色)。这些神经元集中投射到背角中间神经元,并向外周投射到靶组织。本体感觉神经元(蓝色纤维)投射到靶组织内的特殊结构,如肌肉,并感觉肌肉拉伸。b. 低阈值机械感觉神经元(红纤维)投射到传递机械刺激的末端器官。温度和痛觉感觉神经元(绿色)不会投射到特定的末端器官;相反,它们作为游离神经末梢终止于皮肤各层,以及血管和毛囊附近。
人们在吃辣椒时,除了感觉辣以外,为什么常常会伴随着灼热,甚至是疼痛的感觉?19 世纪中叶已经有人第一次将辣椒素从辣椒粉中分离出来并命名为辣椒素(capsaicin)。1919 年,NELSON 报道了辣椒素的化学结构。20世纪90年代,JULIUS试图通过利用辣椒素来回答这个问题。
JULIUS和他的同事[2]在加利福尼亚大学利用背根神经节(DRG)细胞,从中提取信使RNA,并构建了一个包含数百万个片段的cDNA 文库,认为在能够感知疼痛、热和触觉的DRG 细胞的cDNA 文库里,应当包含着可以编码辣椒素受体的 DNA 片段。然后将这个cDNA 文库划分成不同的组别,每组大约包含16 000 个基因,依次将这些组的表达克隆瞬时转染到原本不能对辣椒素产生反应的人胚胎肾细胞(human embryonic kidney 293 cell,HEK293)中,并利用钙离子敏感的荧光染料进行功能筛选。如果含有辣椒素受体的cDNA文库被转入细胞,那么这些细胞就能对辣椒素产生反应。实验确定出在辣椒素刺激下细胞内钙离子浓度显著升高的单个阳性克隆,并将对应的受体命名为香草酸受体亚型 1(vanilloid receptor subtype1, VR1),也称为辣椒素受体。JULIUS 最终确定的这个辣椒素敏感基因,编码一种新的离子通道蛋白,后来被命名为TRPV1。让人惊奇的是,TRPV1不仅能被辣椒素激活,同时也可以被43 ℃以上的高温激活,所以也称热受体。这一发现,首次揭示了离子通道在物理和化学信号之间的共同转导作用,即辣椒素等化学物质刺激与温度等物理刺激,可通过细胞膜上TRPV1蛋白通道转化为统一的电信号[3],从分子层面揭示了躯体感受认知的最本质来源(见图2[2,4])。

注: a. 使用钙成像技术克隆辣椒素受体。用啮齿动物背根神经节(DRG) cDNA文库瞬时转染HEK293细胞,用辣椒素(capsaicin)处理前(左)和处理期间(右)的克隆池进行显微镜荧光钙成像。单独转染载体(pCDNA3的细胞对辣椒素无反应。转染了第11个文库的细胞中,有细胞质钙含量显著增加现象(中间,箭头)。该池被反复细分和重新测定,直到分离出单个阳性克隆(VR1)(底部)。b. 在表达 VR1 的卵母细胞中对辣椒素和来自4种辣椒提取物的反应。右下角,绘制了每种辣椒提取物的相对效力。每个细胞的值被归一化为用辣椒素获得的反应。提取物在注水细胞中没有引起任何反应。不同辣椒品种已报道的辣度(史高维尔单位)如下:哈瓦那辣椒(Habanero,H)100 000~300 000;泰式青椒(T)50 000~100 000;热蜡辣椒(W)5 000~10 000和波布拉诺辣椒(P)1 000~1 500,辣椒素(C)的额定值为16×106 单位。c. 香草酸受体的表达仅限于感觉神经元。Northern杂交分析显示VR1转录本仅限于感觉神经节。从成年大鼠制备Poly(A)+ RNAs,但DRG-P1样品除外,该样品是从新生幼鼠的背根神经节分离的。d. 原位杂交检测感觉神经节细胞亚群中VR1的表达。用地高辛标记的VR1衍生反义核苷酸探针检测成年大鼠背根神经节(DRG)和三叉神经节(TG)。阳性染色(紫色)仅限于直径较小的细胞体(箭头),而在直径较大的细胞体(箭头)中不存在。e. VR1被有害的热刺激激活。瞬时转染VR1而非单独载体(pcDNA3)的HEK293细胞,在受热时表现出细胞质游离钙显著增加。f. 利用辣椒素鉴定出一种可被热痛激活的离子通道蛋白,即辣椒素受体TRPV1。其他的相关离子通道蛋白TRPM8、TRPM3、TRPA1、TRPM2相继被鉴定出,解释了不同的温度如何诱导神经细胞产生不同的电信号。
TRPV1 受体的发现,不仅解释了辣椒素激活伤害性感受神经元的原理,也为更多温度敏感型受体的发现提供了思路。2002 年,JULIUS 团队[5]继续用表达克隆的方法,在TG找到了对薄荷醇(menthol)和8~28 ℃温度刺激敏感的冷觉受体(cold and menthol-sensitive receptor, CMR1)。同时,PATAPOUTIAN 团队[6]基于模型预测和分子克隆技术也发现了这一受体,并将其命名为TRPM8受体。而TRPA1对寒冷敏感,能感知辣根、大蒜和芥末[7]。此后,人们发现TRP通道支持自然界的多种感官功能,例如,一些蛇使用TRPA1直系同源物作为红外探测器,而骆驼和一些地松鼠进化出了TRPV1变体,使它们能够承受显著升高的环境温度[8],逐渐完善了机体对温度感受的外周机制(见图3)。

注: a. 温度激活的瞬时受体电位离子通道,以及不同的温度敏感型感觉神经元。b. 表达外源TRPM8通道蛋白的CHO细胞通过细胞内钙浓度增加来响应低温刺激。RPM8 稳定转染 CHO 细胞和未转染 RPM8 的CHO 细胞,用荧光显微镜观察。加上15 ℃冷刺激(通过微型热电偶在细胞室内测量),荧光增加,表明细胞内Ca2+在表达TRPM8的细胞中增加。增加细胞内Ca2+通过颜色的变化(蓝-绿-黄-红)来表示。最高水平的钙浓度用红色表示。c. 表达外源 TRPM8 通道蛋白的CHO细胞通过细胞内钙浓度增加来响应薄荷醇刺激。
表达 TRPM8 的细胞,25 ℃时,细胞对薄荷醇有反应。钙成像实验的代表性图像表明,在薄荷醇(menthol)刺激下,大量钙的流入。这种反应在未转染 TRPM8 的CHO细胞或没有细胞外钙的细胞中未见。
2 发现触觉感受器
TRP家族中温度感受器被不断发现,解析了脊椎动物对外界温度刺激的响应机制。但是感知领域当中另外一个关键问题,即如何将机械刺激转化为触觉、机械压力感觉的分子机制还未解答。
在 JULIUS 首次描述TRPV1十年后,PATAPOUTIAN在斯克里普斯研究所(美国加利福尼亚州拉霍拉市)的同事们[9]开始了一个类似的旅程,以确定使神经元能够对物理触摸做出反应的机械传感器。为了寻找参与机械转导的蛋白质,筛选了几种小鼠和大鼠细胞系(Neuro2A,C2C12,NIH/3T3,Min-6、50B11,F11,PC12),通过压力驱动的玻璃探针对细胞表面施加压力,同时在另一个移液器处检测和记录电压信号(图4)。
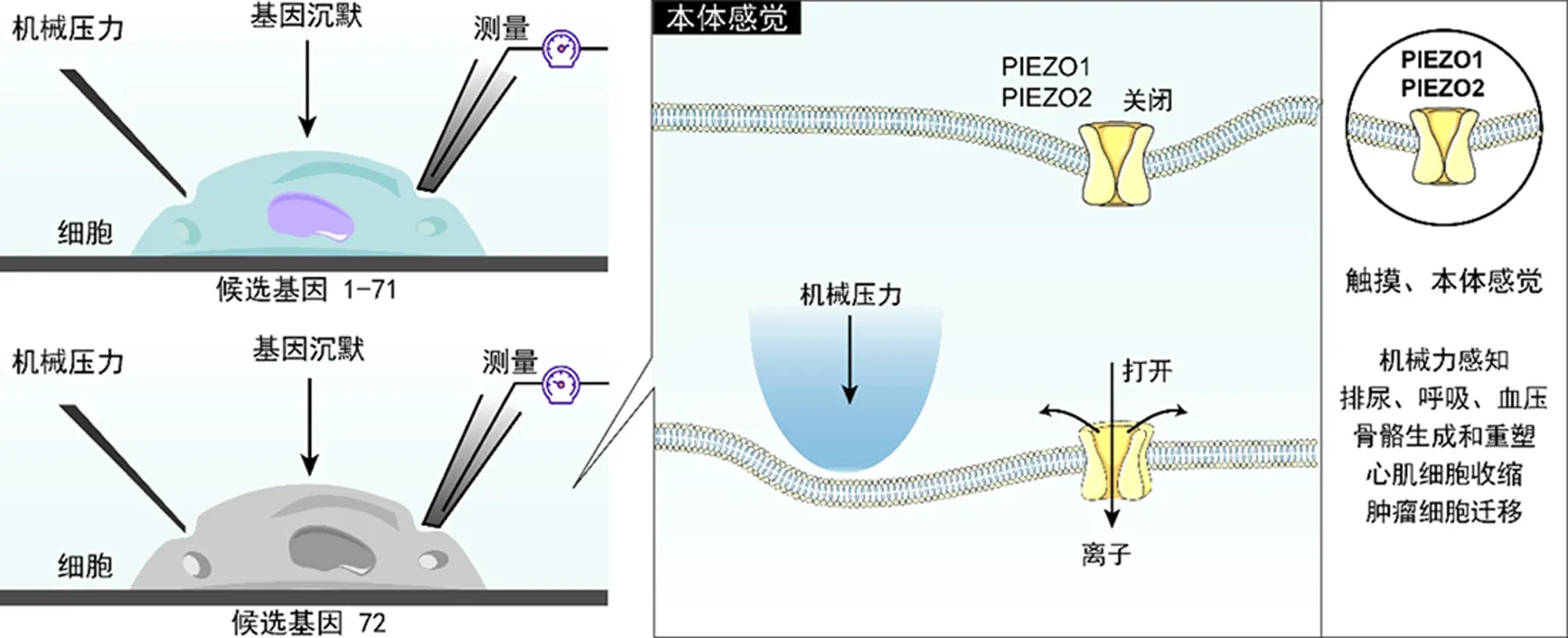
图4 细胞对机械力刺激的反应[9-10,13]Fig. 4 Cellular response to mechanical force stimulation
最后发现胶质瘤细胞系(Neuro2A,N2A),当被微针这种机械力刺激时,它会释放出可检测到的电信号。推测这个可被机械力激活的受体是一种离子通道蛋白。利用RNA profiling 技术,确定了500多个候选基因,在测试了72个候选基因后,发现Fam38A 基因的敲除导致机械激活电流的显著降低。将这个机械敏感的离子通Fam38A基因命名为PIEZO1——在希腊语中意为“压力”[10]。根据与PIEZO1 的相似性,PATAPOUTIAN 又发现了第二个压力敏感离子通道基因,命名为PIEZO2[11-12]。PATAPOUTIAN 通过对机械力(mechanical force)刺激敏感的细胞系进行基因敲除和筛选,发现被机械力激活的离子通道蛋白PIEZO1 和 PIEZO2;这种离子通道在许多生理过程和疾病状态中都起重要作用。
研究发现,PIEZO 受体参与多种生理和病理过程,如PIEZO1 受体与心肌细胞收缩、骨的生成和重塑、肿瘤细胞迁移等密切相关[10-14];PIEZO2 受体直接参与介导触觉、本体感觉、血压、呼吸以及膀胱控制等[13-15]。
3 受体发现的意义
JULIUS 和PATAPOUTIAN 两位科学家对热受体(TRPV1)、冷受体(TRPV8)和机械压力受体(PIEZO)的突破性发现,深入揭示了冷热和机械力刺激如何导致神经冲动的产生,为人类理解感觉、知觉与其他生理病理活动奠定了基础。
早在1969 年,科学家[16]发现了一种光感知缺陷的果蝇突变体,当暴露在持续光照下时,它只表现出短暂的特异性胞内钙离子浓度升高。后来发现,这是由于离子通道编码基因的功能拷贝缺失造成的,该基因被命名为TRP,即瞬时受体电位(transient receptor potential,TRP)。1997 年,JULIUS 团队[2]发现TRP家族成员TRPV1 既是辣椒素的受体,又可以被高温激活,从而鉴定出第一个温度感受器。随后又通过冷冻电镜解析出TRPV1受体的结构[17-18],为针对TRPV1 受体的药物研发提供了依据。辣椒素受体TRPV1通道可作为镇痛靶点,辣椒素脱敏具有明显的治疗潜力[19-20]。TRPV1 在无髓鞘类型的初级感觉神经元上表达。通过诸如辣椒素、热H+及公认的内源性香草素等激动剂激活 TRPV1,触发促炎性神经肽,如肽物质(SP)、降钙素基因相关肽(CGRP)的释放,从而启动神经源性炎症的生化级联反应。同时,产生一种在大脑中被感知为疼痛或瘙痒的神经冲动。蛋白激酶C(PKC)和神经生长因子(NGF)降低了TRPV1(致敏)的激活阈值。用治疗剂量的辣椒素刺激TRPV1可导致一种持续(长达数月)而且可逆的、对进一步的刺激毫无反应(沉默)的状态,一般将这种现象称为脱敏。高剂量辣椒素贴剂和特定部位注射可以通过这种机制减轻疼痛。治疗剂量和超治疗剂量的辣椒素分别导致可逆脱敏和不可逆神经毒性,两者之间的界限尚不明确。尽管脱敏和神经毒性都依赖于辣椒素诱导的通过TRPV1通道的Ca2+内流,但下游的分子机制仍知之甚少。线粒体肿胀是辣椒素神经毒性的早期超微结构标志。Ca2+被认为是在线粒体中隔离的,在线粒体中它通过包括半胱天冬酶激活的分子途径触发细胞凋亡。鞘内注射树脂毒素被用作“分子手术刀”,通过消融感觉神经元来实现慢性顽固性疼痛的癌症患者的永久镇痛(图5)。事实上,高剂量辣椒素贴片和特异性部位注射已被临床证明可以有效缓解骨关节炎、疱疹后神经痛和糖尿病多发性神经病患者的疼痛[21-25]。

图5 疼痛途径中的TRPV1:激动剂脱敏和拮抗剂阻断的异同[21]Fig. 5 TRPV1 in the pain pathway: similarities and differences between agonist desensitization and antagonist blocking
辣椒素会引起强烈的初期疼痛反应,这也限制了患者的耐受剂量。为了减少这种副作用,人们开发了一些“非刺激性”TRPV1激动剂,如 olvanil (NE19550)[26]和MRD-652[22],它们在受体的激活动力学上与辣椒素不同。这些化合物在动物疼痛模型中显示出很好的前景,但它们的临床价值还有待证实。
尽管PIEZOs在生理上和各种疾病中意义重大(见图6),但其药理作用不甚清楚。

注:a. 显示了在小鼠模型中识别的PIEZO1(黑点)和PIEZO2(绿点)的不同表达模式和功能作用。突出展示了机械感觉器官中已确定的表型,而其他承受机械力的器官(如结肠、肠道和胃)的生物学功能尚未确定。b. 除了生理功能外,PIEZO相关疾病也在整个人体内出现。在心血管和躯体感觉障碍中分别发现了人类PIEZO1和PIEZO2的点突变。PIEZO依赖的机械转导在各种癌症中的潜在作用是一个新兴的领域,目前发现的PIEZO1表达上调(黑色箭头)强调了这一点。到目前为止,小细胞肺癌和非小细胞肺癌均显示PIEZO1(黑色箭头)和PIEZO2(绿色箭头)表达下调。
PIEZO的突变可以导致功能丧失或者功能获得。对于PIEZO1和PIEZO2的功能来说,既需要抑制剂,也需要激活剂。现有的阻断剂如钌红、Gd3+和 GsMTx4 毒素肽对 PIEZOs 来说不是特异性的。虽然特异性化学激活剂 Yoda1和Jedi1/2已被确定用于 PIEZO1,但它们的作用是在微摩尔和亚毫摩尔范围内观察到的,不适合进一步的临床研究。因此,需要开发新的高通量筛选技术,将分子神经科学、药理学和生物物理学结合起来识别靶向 PIEZOs 的小分子。此外,毒素多肽、相互作用蛋白、内源性分子和多肽可以作为筛选调控 PIEZO功能的候选靶点。理想情况下,任何新发现的候选药物都应该表现出对通道的高亲和力,并且应该首先在体外测试其对细胞的毒性,然后在体内测试其临床进展。PIEZO 的药物发现是令人兴奋,但也是一个非常具有挑战性的途径[27]。
鉴于PIEZO广泛的表达模式,人们担心PIEZO调节剂和治疗药物的脱靶效应。了解组织特异性影响和其他因素(如内源性分子)如何调节PIEZO通道的机械敏感性将有助于提高任何治疗操作的特异性。此外,开发靶向药物传递和基因治疗方法将有利于PIEZO相关疾病的治疗。通道活性丧失是遗传疾病的致病因素,提供野生型PIEZOs的基因治疗可能成为未来的治疗选择。有些病理不是由通道突变引起的,而是由基因表达改变引起的。可以采用创伤小的方法(如超声和磁遗传学)结合组织/器官特异性的原理,来操纵转录因子和PIEZO表达。此外,组织特异性PIEZO相互作用的蛋白也可以进行靶向修改其功能。STOML3就是这样一个例子[28],因为它已经被证明可以使PIEZO的反应敏感,而小分子靶向STOML3,逆转了小鼠神经性疼痛驱动的行为。
4 展望
热受体(TRPV1) 、冷受体(TRPM8) 和机械压力受体(PIEZO)的突破性发现,帮助科学家解答了长期困扰人们的谜题,即冷、热和机械压力是如何导致神经冲动的产生。TRP通道是机体感知温度的关键,PIEZO通道赋予人体触觉和本体感觉,此外,二者还在其他许多与感受温度和机械刺激有关的重要生理过程中起关键作用。这些研究成果正在应用于慢性疼痛等多种疾病治疗手段的研发中。JULIUS 和PATAPOUTIAN在温度和压力感受器方向的成就,是神经科学研究中(特别是离子通道方面)优秀科学家的典范。他们的工作,将推动生理和病理条件下温觉、冷觉、触觉等感觉系统的功能研究,能激发更多年轻人投身到神经科学领域研究的热情,去揭示生活中的自然规律,研制出更多更好的治疗神经系统疾病的药物,为人类健康服务。
