枸橼酸托法替布治疗活动性强直性脊柱炎的随机对照研究
2022-07-18姜克悦刘磊王文惠
姜克悦 刘磊 王文惠
南阳市第一人民医院风湿免疫科(河南南阳 473000)
强直脊柱炎(ankylosing spondylitis,AS)是以骶髂关节、脊柱附着点炎症为主要表现的严重临床疾患,患者可出现四肢大关节以及椎间盘纤维环及其附近结缔组织纤维化和骨化,同时累及眼、肺、肌肉等多个组织脏器,该病属于风湿病范畴,发病机制尚未明确[1-3]。活动性AS 病情进展迅速,若不及时采取高效的治疗方案可致脊柱永久性强直、功能受限甚至残疾[4-5],寻找对该病治疗高效可靠的方案十分必要、紧迫。目前国内活动性AS的治疗以非甾体消炎药和免疫抑制剂为主,具体治疗效果差异较大,部分患者的病情优化不甚明显,正处于治疗瓶颈的众多患者受到身心折磨,亟待更多新型药物及治疗方案出现。枸橼酸托法替布是一种Janus kinase(JAK)激酶抑制剂,可阻断多种炎症信号通路并抑制JAK1、JAK3 活性[6],国外研究显示其在改善类风湿性关节炎患者关节疼痛等症状体征方面效果得到肯定[7],但目前该药在AS 中的应用效果研究涉及较少。鉴于炎症反应在AS 尤其是活动性AS 的发生发展过程中扮演重要角色,结合枸橼酸托法替布的药理作用,推测其在活动性AS 治疗中也可发挥一定作用,但目前尚未相关定论。本研究将对枸橼酸托法替布治疗活动性AS 患者的疗效、安全性进行分析,报告如下。
1 资料与方法
1.1 病例资料 本研究为前瞻性研究设计,选取2017年1月至2021年1月在本院接受治疗的活动性AS 患者90 例纳入研究。纳入标准:(1)符合临床AS 诊断标准[8];(2)AS 处于活动期,Bath 强直性脊柱炎疾病活动指数≥4,背痛视觉模拟评分(VAS)≥4,已应用最大剂量非甾体抗炎药3 个月且疗效不佳;(3)患者年龄18 ~80 周岁;(4)全程配合治疗、临床资料完整。排除标准:(1)脊柱完全强直者;(2)合并活动性结核;(3)合并其他组织脏器急慢性感染性疾病;(4)合并恶性肿瘤性疾病。参照随机数表法将入组患者分为对照组、观察组各45 例,对照组中男26 例,女19 例,年龄(48.23 ± 11.19)岁;观察组中男27 例,女18 例,年龄(49.04 ± 10.72)岁。两组患者的基础资料分布情况见表1。所有入组患者本人均签署知情同意书,本院伦理委员会审核批准此次研究计划。
表1 两组患者的基础资料比较Tab.1 Comparison of basic data between two groups ±s

表1 两组患者的基础资料比较Tab.1 Comparison of basic data between two groups ±s
组别对照组(n=45)观察组(n=45)t/χ2值P 值性别男26 27 0.046 0.830女19 18年龄(岁)48.23±11.19 49.04±10.72 0.351 0.727 BMI(kg/m2)24.74±2.19 24.51±2.43 0.472 0.638病程(年)背部疼痛3.19±0.65 3.08±0.71 0.767 0.445背部关节炎症2.95±0.42 2.92±0.45 0.327 0.744 AS 确诊时间(年)2.03±0.45 2.11±0.49 0.807 0.422
1.2 治疗方法 对照组患者接受活动性AS 常规治疗,具体如下:柳氮磺吡啶肠溶片口服,每日3~4 次,共服用8 片/d;美洛昔康胶囊口服,1 粒(7.5 mg)/次,每日服用2 次。1月/疗程,持续3 个疗程。观察组患者在对照组治疗方案基础上加入枸橼酸托法替布治疗,具体如下:枸橼酸托法替布片口服,10 mg/次,每日服用2 次。1月/疗程,持续3 疗程。
1.3 疗效相关指标评估 治疗前后,分别采用Bath 强直性脊柱炎功能指数(BASFI)、Bath 强直性脊柱炎计量指数(BASMI)、总体背痛评分(采用VAS 评价,总分0~10 分,疼痛越严重、分值越高)、Jenkins 睡眠评估问卷调查(JSEQ)评分评估患者的治疗效果。
1.4 炎症相关外周血指标检测 治疗后,分别留取空腹外周静脉血标本并分离血清,采用酶联免疫吸附法测定其中C 反应蛋白(CRP)水平,采用魏氏法测定血沉(ESR)水平。
1.5 整体疗效评估 治疗3 个疗程后,评估所有活动性AS 的治疗效果,包括显效、有效、无效三类。显效:AS 患者受累脊柱关节疼痛、僵硬基本消失或者显著减轻,胸廓扩张度接近正常,血液炎症指标水平下降至正常或者接近正常;有效:受累脊柱关节疼痛和僵硬改善,胸廓扩张度较治疗前增加,血液炎症指标水平无改变或者出现下降;无效:病情改善未达上述标准或加重。治疗显效、有效病例均属整体治疗有效范畴。
1.6 治疗安全性 治疗期间,记录皮疹、脱发、消化道症状、肺部感染、肺栓塞、肝功能损伤、肾功能损伤、心肌损伤等不良反应的发生情况。
1.7 统计学方法 使用软件SPSS 20.0 对文中数据进行处理,计量资料表示为均数±标准差,两组间比较采用独立样本t检验,同组内治疗前后比较采用配对t检验;计数资料的比较采用χ2检验;等级资料的比较采用秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 疗效相关指标评估 治疗前,两组患者的BASFI、BASMI、VAS、JSEQ 评分值差异无统计学意义(P>0.05)。治疗后,两组患者的BASFI、BASMI、VAS、JSEQ 评分值均低于治疗前;观察组患者上述指标评分值均低于对照组患者(P<0.05)。见表2。
表2 两组患者的疗效相关指标评估Tab.2 Evaluation of efficacy related indicators in two groups ±s
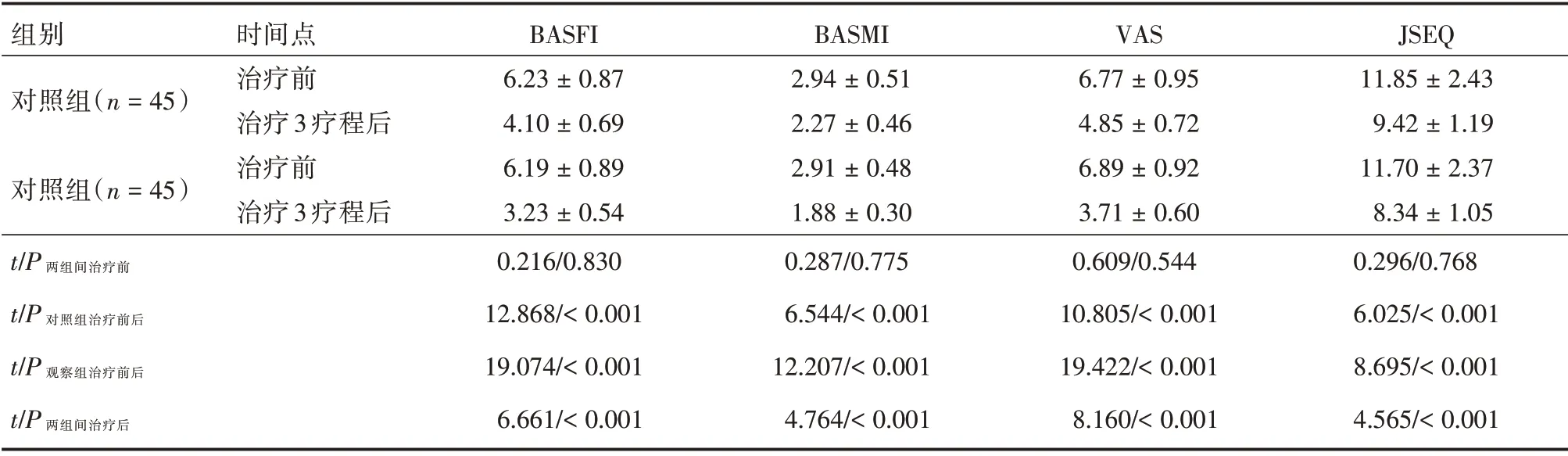
表2 两组患者的疗效相关指标评估Tab.2 Evaluation of efficacy related indicators in two groups ±s
组别对照组(n=45)对照组(n=45)t/P 两组间治疗前t/P 对照组治疗前后t/P 观察组治疗前后t/P 两组间治疗后时间点治疗前治疗3 疗程后治疗前治疗3 疗程后BASFI 6.23±0.87 4.10±0.69 6.19±0.89 3.23±0.54 0.216/0.830 12.868/<0.001 19.074/<0.001 6.661/<0.001 BASMI 2.94±0.51 2.27±0.46 2.91±0.48 1.88±0.30 0.287/0.775 6.544/<0.001 12.207/<0.001 4.764/<0.001 VAS 6.77±0.95 4.85±0.72 6.89±0.92 3.71±0.60 0.609/0.544 10.805/<0.001 19.422/<0.001 8.160/<0.001 JSEQ 11.85±2.43 9.42±1.19 11.70±2.37 8.34±1.05 0.296/0.768 6.025/<0.001 8.695/<0.001 4.565/<0.001
2.2 炎症相关外周血指标水平比较 治疗前,两组患者的CRP、ESR 水平差异无统计学意义(P>0.05)。治疗后,两组患者的外周血CRP、ESR 水平均低于治疗前;其中观察组患者的外周血CRP、ESR 水平均低于对照组患者(P<0.05)。见表3。
表3 炎症相关外周血指标水平比较Tab.3 Comparison of inflammation related peripheral blood index levels ±s

表3 炎症相关外周血指标水平比较Tab.3 Comparison of inflammation related peripheral blood index levels ±s
组别对照组(n=45)对照组(n=45)t/P 两组间治疗前t/P 对照组治疗前后t/P 观察组治疗前后t/P 两组间治疗后时间点治疗前治疗3 疗程后治疗前治疗3 疗程后CRP(mg/L)28.34±5.96 17.16±2.88 28.17±5.45 11.34±2.30 0.141/0.888 11.330/<0.001 19.085/<0.001 10.593/<0.001 ESR(mm/h)50.34±8.16 30.71±5.45 49.85±8.34 21.42±4.76 0.282/0.779 13.420/<0.001 19.860/<0.001 8.612/<0.001
2.3 整体疗效比较 治疗后,两组患者的疗效分级情况差异有统计学意义(P<0.05),观察组患者的治疗总有效率高于对照组患者(P<0.05)。见表4。

表4 整体疗效比较Tab.4 Comparison of overall efficacy 例
2.4 治疗安全性 治疗期间,观察组患者出现2例轻度肝酶升高,对症治疗后好转,不影响后续治疗进行;对照组患者出现1 例轻度肝酶升高,1 例皮疹,均不影响治疗。两组治疗相关不良反应发生率比较差异无统计学意义(P>0.05)。
3 讨论
AS 患者关节功能损害程度与炎症反应程度密切相关,陈慧等[9]指出免疫性炎症反应是导致AS发生发展的直接原因之一;SCALISE 等[10]研究认为AS的发病机制涉及肠道生态失调引起“肠-关节轴”激活并引起炎症。抑制AS 患者的炎症反应被认为是改善病情的重要方法,寻找高效合理的具有抗炎作用的药物十分关键。枸橼酸托法替布是一种新型的口服蛋白酪氨酸激酶抑制剂,以细胞内JAK-STAT 信号转导通路为靶点实现抗炎等作用,目前认为其适用于甲氨蝶呤疗效不足或对其无法耐受的中度至重度活动性类风湿关节炎(RA)成年患者[11-12]。枸橼酸托法替布的具体作用实现具体通过调控信号通路,减少下游炎症细胞因子合成,从而实现抗炎、调节免疫的作用[13-14]。枸橼酸托法替布可阻断IL-2、IL-7、IL-9、IL-15等与JAK3结合的共同γC 链细胞因子,还可阻断IL-6、IL-11 等gp130家族因子,以及IFN-α/β、IFN-γ等Ⅱ型细胞因子受体家族分子。枸橼酸托法替布也可对Th1 细胞的分化及致病性Th17 细胞产生负面作用。
本研究将枸橼酸托法替布加入活动性AS患者的治疗,经3 疗程治疗后评估其治疗效果。BASFI、BASMI、VAS、JSEQ 均是评估AS患者肢体活动度、疼痛程度以及对正常睡眠质量的影响的常用评分,HU 等[15]、SAYED ABDULLA 等[16]、PÉCOURNEAU 等[17]证实了上述评分值对AS 病情的间接评估价值。文中观察组患者经过3 个疗程治疗后,BASFI、BASMI、VAS、JSEQ 评分值低于对照组患者,提示枸橼酸托法替布加入整体治疗可有效改善活动性AS 患者的肢体僵硬程度、减轻疼痛程度和优化睡眠质量。
枸橼酸托法替布的抗炎作用是其治疗疾病的最主要机制,在活动性AS 患者的治疗中可能也通过减轻炎症反应来实现治疗目的。CRP、ESR 是反映各种急慢性炎症程度的非特异性指标,潘贤峰[18]、高巧霞[19]分别在其研究中发现AS 患者CRP、ESR 水平异常增加,在辅助疗效评估方面具有一定价值。本研究中两组患者治疗后CRP、ESR 水平均呈下降趋势,其中观察组患者该指标水平下降更为显著,提示枸橼酸托法替布确实减轻了活动性AS 患者的全身炎症反应,侧面提示其治疗效果可靠性,与上文各个评分值下降的结果趋势吻合。除抗炎作用外,枸橼酸托法替布可能还通过其他作用途径对活动性AS 病情产生影响。如有研究[20]发现枸橼酸托法替布可调节机体体液免疫,抑制B细胞及T 细胞分化增殖、免疫球蛋白类别转换。最后发现观察组患者的治疗有效率较高,疗效分级更优,明确了枸橼酸托法替布治疗的可靠性。
枸橼酸托法替布在国内临床中的应用并不多,在关注其治疗效果同时,治疗安全性也是临床工作者较为关心的。枸橼酸托法替布应用后的不良反应主要包括感染、肝酶及肌酐升高等,积极减少严重不良反应出现是该药后续普及推广的基础。文中两组患者治疗期间均无严重并发症出现,经对症干预后不影响后续治疗实施,初步提示枸橼酸托法替布在活动性AS 治疗中具有良好的安全性。但文中仅观察了活动性AS 患者治疗3 个月期间的不良反应,若后续患者需要长期服药,需进一步进行长期安全性随访。
由此可知:枸橼酸托法替布联合基础方案治疗活动性AS,在短期治疗有效性及安全性方面较为可靠。关于该药的远期疗效及安全性问题有待后续研究。同时本研究也存在以下局限性:纳入病例数有限可能使数据产生偏倚,且未涉及枸橼酸托法替布发挥疗效的具体信号通路等,需后续更多研究不断拓展明确。
