自动提取定量肿瘤内部磁敏感信号与R2*值预测卵巢囊腺肿瘤的侵袭性
2022-07-16胡文君刘爱连李烨王洪凯庄明睿宋清伟
胡文君,刘爱连*,李烨,王洪凯,庄明睿,宋清伟
1.大连医科大学附属第一医院放射科,辽宁 大连 110611;2.大连理工大学生物医学工程学院,辽宁 大连 116051;*通信作者 刘爱连 liuailian@dmu.edu.cn
卵巢囊腺肿瘤是最常见的卵巢肿瘤[1],根据侵袭性可分为良性、交界性和恶性。卵巢囊腺癌(ovarian cystadenocarcinoma,OCAC)预后差,生存率低,术后常不能保留卵巢[2],因此术前鉴别卵巢肿瘤的侵袭性对选择适当的治疗方式及改善预后至关重要。表观弛豫率(R2*值)是定量评估局部组织氧含量的敏感指标[3],肿瘤内部磁敏感信号(intratumoral susceptibility signal,ITSS)可以反映肿瘤内部的新生血管及出血情况[4],R2*及ITSS已广泛应用于多个部位肿瘤的鉴别与分级,但目前鲜有研究将其应用于卵巢肿瘤。本研究拟探索自动定量ITSS及R2*值对OCAC和卵巢囊腺瘤(ovarian cystadenoma,OCA,包括良性和交界性囊腺瘤)的鉴别诊断价值。
1 资料与方法
1.1 研究对象 回顾性分析2015年1月—2019年12月于大连医科大学附属第一医院行MRI提示有卵巢病变的患者,纳入标准:①临床资料完整、手术病理证实为卵巢囊腺肿瘤;②术前行盆腔1.5T MRI扫描,含增强T2*加权血管成像(enhanced T2 star weighted angiography,ESWAN)序列。排除标准:①MRI检查前接受过放化疗;②图像质量不佳,影响观察。最终纳入38例共47个病灶,其中29例单侧病灶,9例双侧病灶,将其分为OCAC组14例23个病灶和OCA组24例24个病灶。本研究经本院伦理委员会审批(PJ-KSKY-2021-251),免除患者知情同意。
1.2 检查方法 采用GE 1.5T MR扫描仪(GE Signa HDXT),体部8通道相控阵线圈。扫描前患者禁食水4~6 h。首先行常规平扫,包括轴位T1WI序列(TR 500 ms、TE 10 ms、激励次数2.0、矩阵320×129)及轴位压脂T2WI序列(TR 4 000 ms、TE 125 ms、激励次数4.0、矩阵288×224),层厚4.0 mm,间隔l.0 mm,视野36 cm×36 cm;然后行ESWAN序列扫描:轴位3D成像,5个回波,TR均为16.5 ms,TE分别为2.1、5.1、8.0、10.9、13.8 ms,翻转角12°,扫描层厚5.0 mm,层间距0.8 cm,激励次数0.71,视野40 cm×40 cm,扫描矩阵256×192,重组矩阵512×512。
1.3 数据测量 将ESWAN序列图像传输至GE ADW 4.6工作站,经Functool软件处理获得R2*、T2*、幅度、相位图。由于相位图中存在的条带状伪像会严重影响ITSS的测量,测量前需要对相位图进行伪影去除,流程(图1):①首先检测相位图中高灰度值和低灰度值的异常像素;②根据高像素值和低像素值相邻像素的特征确定伪影区域;③根据周围非伪影像素的灰度值重新计算伪影区域中的像素值。使用批处理程序去除伪影后的相位图,导出为NII格式并传输至AnatomySketch 1.0(AS 1.0)软件(大连理工大学),该软件使用基于Qt和VTK库的C++编程。
由2名分别具有2年和6年腹部影像诊断工作经验的住院医师和主治医师,采用双盲法参照T2WI选取肿瘤最大层面及其相邻上下2个层面沿肿瘤边缘勾画感兴趣区(ROI),勾画完成后AS软件自动计算出相位图的ITSS比率。ITSS比率定义为在ITSS面积最大的层面中ITSS面积与该层面肿瘤面积的比值(图2)。同2名观察者分别在工作站上完成两组病变R2*值的测量,参照T2WI在R2*图上选取同样的3个层面沿肿瘤边缘勾画ROI,R2*值取3个层面的平均值。
1.4 统计学方法 应用SPSS 26.0和MedCalc 19.1.2软件。采用Shapiro-Wilk检验各参数的正态性,符合正态分布的计量资料用±s表示,组间比较采用独立样本t检验;符合偏态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whitney秩和检验。计数资料用例(%)表示,采用χ2检验比较。采用组内相关系数检验2位观察者测量各参数结果的一致性,采用受试者工作特征(ROC)曲线评估各有差异参数单独及联合使用对两组的鉴别诊断效能,采用Delong检验比较各参数及联合参数诊断效能的差异。P<0.05表示差异有统计学意义。
2 结果
2.1 患者临床及病理特征比较 OCAC比OCA更易累及双侧卵巢,且CA125水平高于OCA(均P<0.05),见表1。
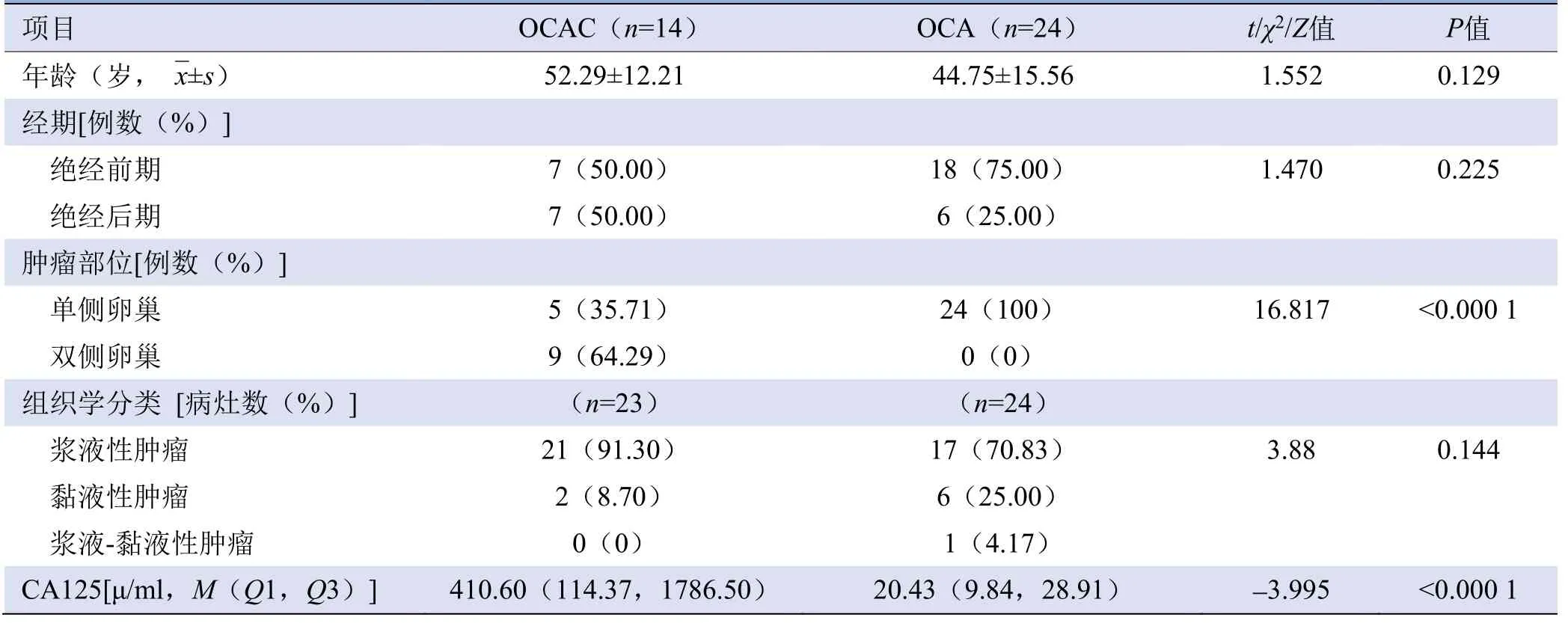
表1 38例卵巢囊腺肿瘤患者的临床及病理资料
2.2 常规MRI表现 OCA组共24例24个病灶,其中多囊性肿块22例,直径约3~14 cm,T1WI呈低信号,T2WI呈高信号,壁及分隔薄而均匀;6例有壁结节,T1WI呈等信号,T2WI呈低信号。囊腺瘤2例,含有较多实性成分,分隔较厚,增强扫描呈明显强化,被误诊为卵巢癌。
OCAC组共14例23个病灶,其中多房囊实性肿块21例,直径约2~17 cm,T1WI呈稍低信号,T2WI呈稍高信号,间隔及囊壁厚薄不均,可见明显实性成分,T1WI呈稍高信号,T2WI呈稍低信号。出现腹膜腔及淋巴结转移3例。因表现不典型被误诊为囊腺瘤2例。
2.3 一致性检验 2位观察者测量病灶各参数一致性良好(ICC>0.75),OCAC、OCA组的ITSS及R2*值一致性较好(ICC=0.953、0.925、0.987、0.999)。取观察者1的测量结果进一步分析。
2.4 两组各参数比较 OCAC组的R2*值及ITSS比率分别为9.08(7.50,10.61)/s、0.23±0.09,均高于OCA组的2.70(1.33,4.31)/s、0.12±0.07,差异有统计学意义(Z=-4.873,P<0.000 1;t=-4.748,P<0.000 1),见图3、4。
2.5 各参数的鉴别诊断效能比较 ITSS、R2*值和两者联合诊断OCAC的AUC分别为0.823、0.915、0.951,ITSS、R2*值的阈值分别为0.152、6.730/s,其对应的敏感度分别为78.3%、87.0%、91.3%,特异度分别为79.2%、95.8%、87.5%,ITSS与R2*的诊断效能差异无统计学意义(P>0.05),两者联合的诊断效能优于ITSS单独诊断(P<0.05),见表2和图5。

表2 ITSS、R2*及两者联合对OCAC的诊断效能比较
3 讨论
3.1 OCAC与OCA鉴别诊断的必要性 卵巢囊腺肿瘤根据病理特征分为良性、交界性和恶性。OCAC是最常见的卵巢癌亚型[5],由于其早期症状无特异性,确诊时常处于晚期,治疗难度大,致死率高。OCAC的治疗方式通常为全面分期手术或肿瘤细胞减灭术[2]。卵巢交界性囊腺瘤是一种低度恶性潜能肿瘤,其与良性卵巢囊腺肿瘤均可行保留生育功能的手术治疗[6]。因此,卵巢囊腺肿瘤的术前定性诊断对于制订最佳临床治疗策略至关重要。
MRI是诊断卵巢肿瘤的主要影像学技术,但在常规MRI图像上两种病变的影像表现常有重叠,鉴别困难[7],本研究中4例因此误诊。ESWAN是一种利用不同组织间磁敏感差异成像的功能MRI技术,可获得R2*值、T2*值、幅度值和相位值等多个定量参数,ESWAN序列鉴别肿瘤良恶性具有独特的价值[8],但目前其应用于卵巢肿瘤侵袭性的研究鲜有报道。
3.2 自动定量ITSS鉴别OCAC及OCA的价值 ITSS是相位图上肿瘤内部连续点状或细线状的低信号区域,主要来源为病灶内部的微出血和新生血管[4]。恶性肿瘤的生长、侵袭和转移依赖新生血管形成,血管生成水平是评估肿瘤侵袭性的重要指标[9]。ITSS与组织病理学样本中微血管的密度和大小一致[10],是无创、直观显示肿瘤内部血管增殖的影像学标志。目前ITSS的主要测量方法为半定量,即依据ITSS的频率及大小进行分级,但得出的结果不总是一致,Xu等[11]及Park等[12]分别用半定量ITSS对胶质瘤进行分级,Park等[12]发现仅高级别胶质瘤中有ITSS,而Xu等[11]在不同级别的胶质瘤中均发现ITSS。Bhattacharjee等[13]提出一种用MATLAB软件定量ITSS的方法,结果表明自动定量比半定量ITSS对颅脑胶质瘤分级具有更高的敏感度和特异度,其优点是对全肿瘤中ITSS容积进行定量,但只适用于肉眼可见ITSS的肿瘤,且图像未经去伪影处理,可能会导致结果不准确;此外与颅脑相比,腹部器官由于受到呼吸和胃肠道蠕动伪影的影响,会严重影响ITSS的自动定量,因此该方法可能不适用于腹部器官。
本研究首次使用自动提取并定量ITSS预测卵巢肿瘤的侵袭性,克服了半定量方法无法反映病变局部差别、难以比较的缺点;并且由于恶性肿瘤的血管走行不规则、聚集成簇、不易于辨认,使人工计数ITSS费时、费力且主观性强,因此使用AS软件对ITSS自动提取定量更适用于临床工作。与Bhattacharjee等[13]提出的颅脑肿瘤定量ITSS方法相比,本研究方法的优点为:①无需预先筛选肉眼可见ITSS的图像;②采用相位图去伪影处理,更适用于易发生运动伪影的腹部器官;③将所有处理程序集成于一个软件,较MATLAB操作简便。但由于腹部器官较颅脑形态不对称,毗邻组织复杂,该软件目前仅能计算肿瘤ITSS面积最大层面的ITSS比率。
本研究提出的自动定量ITSS方法在鉴别OCA和OCAC方面有良好的效能,且两位观察者间的一致性较好,证实了该方法的稳定性。OCAC的ITSS比率显著高于OCA,病理研究证明卵巢癌较卵巢良性肿瘤微血管密度更高[14],新生肿瘤血管走行不规则,血流阻力增大,血液停留时间延长,血氧被过度利用,脱氧血红蛋白增加,且管壁通透性高,常伴发微出血,脱氧血红蛋白及其氧化产物等顺磁性物质造成局部磁场不均、T2*时间缩短,质子频移与周围组织产生相位差,使新生血管及微出血在相位图上显示为低信号区[15],从而增高ITSS比率。
3.3 R2*值鉴别OCAC及OCA的价值 R2*值由不同时间梯度重聚获得,可无创反映局部组织氧含量。当局部组织氧合水平下降时,血液代谢产物如含铁血黄素、脱氧血红蛋白等顺磁性物质增加,磁场去相位,质子的弥散相位无法快速重聚,使R2*值升高[16]。本研究中OCAC的R2*值显著高于OCA,与OCAC低氧微环境和乏氧肿瘤血管形成有关。研究表明,低氧微环境是卵巢癌增殖、侵袭和转移的重要因素,并使卵巢癌中缺氧诱导因子HIF-1水平显著升高[17],同时缺氧刺激会使更多的新生血管形成,这些血管为乏氧性血管,功能不完整,进一步导致血氧含量减低,R2*值升高,本研究结果与既往研究结果一致。田士峰等[18]用ESWAN序列鉴别子宫肉瘤与子宫肌瘤退行性变,结果显示子宫肉瘤的R2*值高于子宫肌瘤退行性变,证明R2*值可以反映肿瘤侵袭性。
ROC曲线分析显示,R2*的AUC、敏感度、特异度均高于ITSS,主要原因可能是R2*反映的组织氧合水平受到肿瘤细胞增殖和新生血管形成的双重影响;但两者的诊断效能无显著差异,且ITSS能自动定量,较R2*更加简便易行,可以避免主观偏差。ITSS和R2*联合可以提高诊断效能,将敏感度提升至91.3%。
3.4 本研究的局限性 ①参数的测量不在全肿瘤层面,不能反映整个肿瘤的情况。②本研究纳入样本量相对较小,未来会增加样本量进行更深入的研究。
总之,自动定量ITSS方便可行,未来有望应用于卵巢肿瘤及更多部位的肿瘤研究中。ITSS和R2*可有效判断卵巢囊腺肿瘤的侵袭性,两者联合能够提高诊断效能,可以作为临床无创鉴别OCAC和OCA的定量指标,为制订治疗方案和判断预后提供有价值的信息。
