碲锌镉心脏专用SPECT对PCI术后造影阴性胸痛患者冠状动脉微血管功能障碍的诊断价值
2022-07-15李琳琳李剑明
李琳琳,李剑明
(天津医科大学心血管病临床学院,泰达国际心血管病医院,天津 300457)
0 引言
《中国心血管健康与疾病报告2020》指出冠状动脉疾病(coronary artery disease,CAD)严重危害民众的身体健康,有较高的发病率,且发病率逐年攀升[1]。经皮冠状动脉介入(percutaneous coronary intervention,PCI)治疗是目前临床治疗阻塞性CAD的有效手段,能够通过球囊扩张或支架植入解除冠状动脉狭窄、开通闭塞血管,从而缓解心肌缺血及相关症状。但临床上部分患者在经过PCI治疗后胸痛症状仍不能得到明显缓解。有研究表明,采用PCI解除心外膜梗阻后,冠状动脉微血管功能障碍(coronary microvascular dysfunction,CMD)是引起患者术后心肌缺血和胸痛的主要原因[2-3]。因此,对于PCI术后冠状动脉造影(coronary angiography,CAG)阴性但有明显胸痛症状的患者,如何进一步无创性诊断其是否存在CMD具有重要意义。研究表明,在不存在心外膜梗阻的前提下,心肌血流储备(myocardial flow reserve,MFR)的减低提示患者存在CMD[4-5]。新一代碲锌镉(cadmium-zinc-telluride,CZT)心脏专用SPECT(CZT-SPECT)能够实现血流定量显像[6],从而能便捷地获取MFR。目前,国内尚未见采用CZTSPECT心肌血流定量诊断PCI术后CMD的相关临床研究报道。本研究通过回顾性分析PCI术后CAG阴性胸痛患者的心肌定量血流数据,探讨CZT-SPECT心肌血流定量显像对该类患者CMD的诊断价值。
1 资料与方法
1.1 研究对象
回顾性收集2018年12月至2021年7月于泰达国际心血管病医院进行CZT-SPECT心肌血流定量显像的PCI术后患者384例,从中筛选出显像前后3个月内行CAG且结果呈阴性的胸痛患者共64例,其中,男42例、女22例,年龄34~79岁,平均年龄(61.48±9.48)岁。纳入标准:(1)成功行PCI术;(2)CZF-SPECT检查前后3个月内行CAG检查且结果阴性,二者之间无再次血运重建治疗;(3)有典型或不典型胸痛症状;(4)病例临床资料完整;(5)经心内科医师结合临床症状及心电图结果疑诊心绞痛者。排除标准:(1)既往行冠状动脉搭桥术者;(2)PCI不完全血运重建者,即PCI术后靶血管仍存在明显狭窄(狭窄程度≥50%)者;(3)有心肌梗死病史者;(4)存在三磷酸腺苷或腺苷药物负荷禁忌者;(5)定量显像失败、无法计算MFR者;(6)患有以下可能引起非心源性胸痛的疾病者:胸骨骨折、皮下蜂窝组织炎、皮炎等胸壁疾病,肺部肿瘤、胸膜肿瘤、肺炎、肺结核等呼吸系统疾病,以及反流性食管炎、消化性溃疡病史等。患者在检查前均被告知三磷酸腺苷或腺苷药物负荷的试验过程和潜在风险,所纳入患者均签署知情同意书。本研究已通过院内伦理委员会审查。
1.2 研究方法
1.2.1 显像设备及方案
设备为CZT-SPECT(NM530c,美国GE公司);显像剂为99mTc-甲氧基异丁基异腈(methoxyisobutylisonitrile,MIBI)。检查前准备:严格要求患者显像前24 h不饮用茶、咖啡、可乐等饮品或食用任何含咖啡因与茶碱的食物,并停止服用各种心血管药物(主要包括硝酸酯类、钙拮抗剂、β阻滞剂等)至少24 h。
显像采用一日法或二日法方案:一日法采用先静息后药物负荷显像方案,第1次注射显像剂的剂量为185~296 MBq,间隔1~4 h后行三磷酸腺苷或腺苷药物负荷,药物负荷具体方案参见文献[7],负荷高峰注射显像剂的剂量是静息注射的3倍;采用二日法方案时,静息和负荷显像注射剂量大致相同,均为370~555 MBq。静息显像:预注射显像剂18.5~37 MBq(预定位显像用);预定位后先启动动态采集(表模式采集10 min),开启程序10 s后再经预埋静脉通道行显像剂注射,注射方式采用“弹丸”式注射,在5 s内完成,动态采集结束40~60 min后行常规静息门控断层显像。负荷显像:心脏预定位后,在负荷高峰时注射显像剂,注射要求同静息显像,表模式连续采集10 min后结束,间隔15~30 min后行常规负荷门控断层显像。常规门控采集参数:8帧/心动周期,心率窗宽±15%,能峰为140 keV,能峰窗宽±10%,一日法的静息和负荷显像分别采集6 min和4 min,二日法的静息和负荷显像均采集4 min。所有患者CZT-SPECT显像前均需采集CT衰减校正数据:电压为120 kV,电流为20 mA,扫描范围为肺尖至肝脏中下部,设备为NM690(美国GE公司)。
1.2.2 图像重建和分析
将动态表模式数据传送至Myoflow Q(北京百灵云生物医学科技有限公司)工作站,自动重分为系列动态图像:10 s×10次+20 s×5次+60 s×2次+280 s×1次;然后调用CT衰减校正数据进行完整的CT与CZT-SPECT的图像融合对位、轴位调整、衰减和散射校正;自动勾画或手动调整心血池曲线输入函数的感兴趣区(region of interest,ROI)和心肌基底部位置,生成左室心血池、左室心肌的动态曲线和拟合曲线,最终获得左心室(left ventricle,LV)和三支血管区域的静息心肌血流(rest myocardial blood flow,rMBF)、负荷心肌血流(stress-myocardial blood flow,sMBF),进而获得三支血管区域的MFR,即sMBF与rMBF的比值。左心室壁心肌按美国心脏协会(America Heart Association,AHA)17节段法进行区域划分,心肌节段放射性分布按5点评分法计算:0分,放射性分布正常;1分,放射性分布轻度减低;2分,放射性分布中度减低;3分,放射性分布重度减低;4分,无放射性分布。通过QGS+GPS软件(美国Cedars-Sinai医学中心)获得相应的常规半定量参数,如灌注减低范围(Extent)、累积静息评分(summed rest score,SRS)、累积负荷评分(summed stress score,SSS)、累积差值评分(summed difference score,SDS)。
1.2.3 观察指标及判定标准
依据CAG结果和PCI手术记录,以CAG显示心外膜血管狭窄程度<50%为阴性[8],排除无近期(检查前后3个月内)CAG或CAG阳性的患者。
以2.0为界值[9],将纳入病例分成CMD组(LVMFR<2.0)和非CMD组(LV-MFR≥2.0),对比2组临床基线资料、定量血流参数和半定量参数。
满足以下3个特征则定义为典型胸痛症状:(1)有明确诱因,如劳累、体力运动或情绪激动诱发;(2)胸痛位置位于胸骨后或心前区;(3)经休息或含服硝酸酯类药物可于数分钟内缓解。若满足以上3个特征中的2项,则定义为不典型胸痛症状。
1.2.4 统计学处理
使用SPSS 26.0软件对数据进行统计分析,计数资料用频数、百分比(%)表示。符合正态分布的计量资料用±s表示,2组比较采用独立样本t检验;不符合正态分布的计量资料用M(Q25,Q75)表示,2组比较采用Mann-Whitney U检验。计数资料使用皮尔逊卡方检验,P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料比较
最终纳入患者64例,筛选流程如图1所示。根据纳入与排除标准将筛选后的患者分成2组:CMD组共计33例,占51.6%(33/64);非CMD组共计31例,占48.4%(31/64)。2组患者的高血压、高脂血症、胸痛症状、糖尿病、冠心病家族病史、吸烟史、饮酒史、年龄、性别、身体质量指数(body mass index,BMI)和PCI治疗血管支数差异均无统计学意义(P均>0.05),具体见表1。
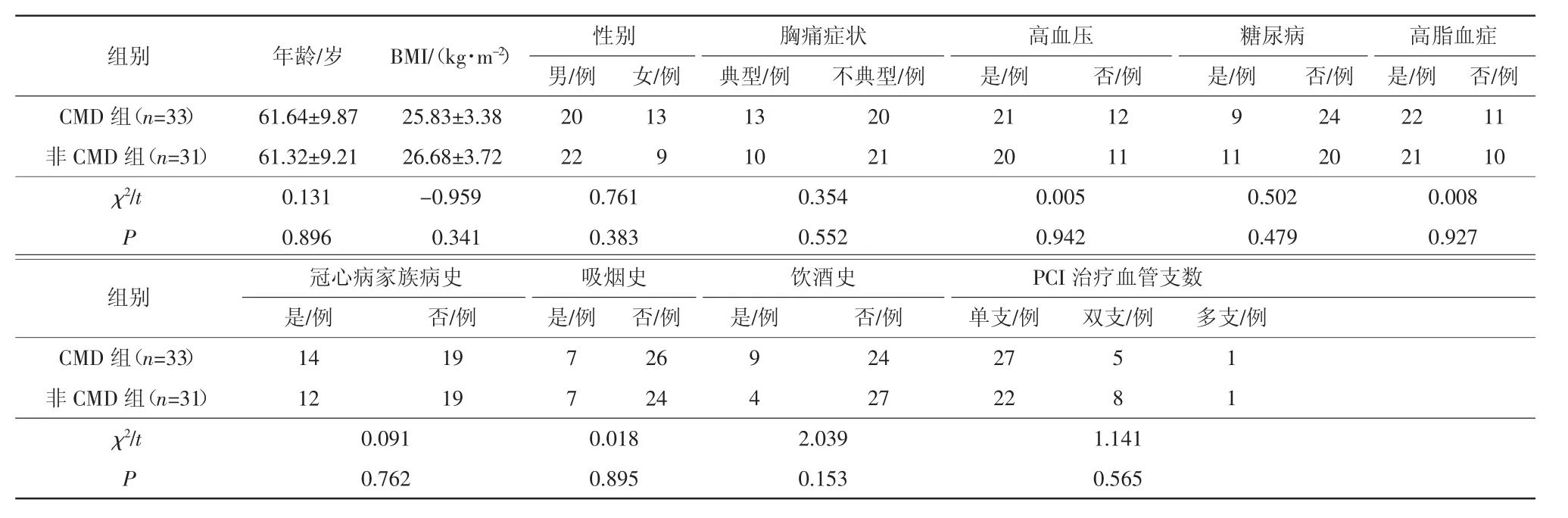
表1 PCI术后CMD组与非CMD组的一般资料比较
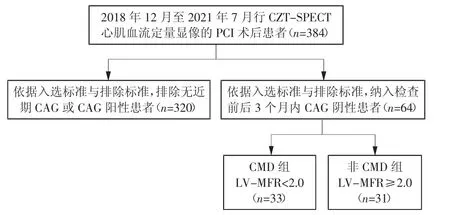
图1 病例筛选流程图
2.2 组间的血脂生化指标比较
2组间的血脂生化指标,包括PCI术后CMD组与非CMD组总胆固醇、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)及低密度脂蛋白胆固醇(LDL-C)均无统计学差异(P均>0.05),见表2。

表2 PCI术后CMD组与非CMD组血脂生化指标比较
2.3 组间的定量血流参数及半定量参数比较
与非CMD组比较,PCI术后CMD组的LV-sMBF明显减低(P<0.05),2组间的LV-rMBF无统计学差异(P>0.05)。比较2组间的半定量血流参数,发现PCI术后CMD组与非CMD组间的负荷Extent、静息Extent、SSS、SRS、SDS均无统计学差异(P均>0.05),详见表3,典型病例如图2所示。

图2 PCI术后造影阴性患者CMD典型示意图
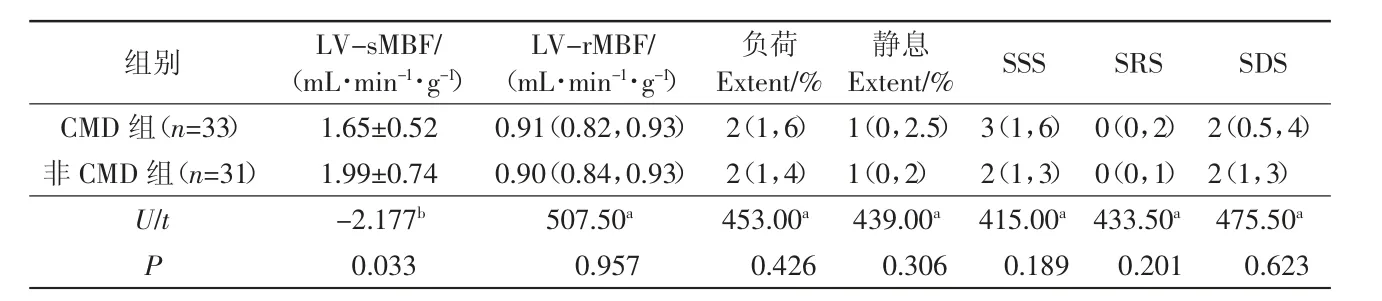
表3 PCI术后CMD组与非CMD组定量、半定量血流参数比较
3 讨论
目前,临床上有20%~40%的CAD患者在成功完成PCI血运重建术后,尽管复查显示冠状动脉管腔通畅,但胸痛症状仍不能得到明显缓解或时常再发[2]。有研究表明,CMD是引起PCI术后CAG阴性患者心绞痛和心肌缺血的主要原因[2-3,10]。CMD的病理生理学机制、诊断和相关治疗已成为当前临床研究的热点[11-12]。CMD患者微血管功能异常主要包括以下2种情形:(1)微血管舒张功能受损,即在扩张血管类药物负荷下,微血管不能充分舒张以提高血流而导致MFR减低;(2)血管内皮功能不良导致收缩反应增强,应用乙酰胆碱刺激则出现微血管痉挛[13],目前临床上缺乏无创性诊断CMD的有效手段。
针对上述问题,本研究选取PCI术后CAG阴性的胸痛患者,依据同期的CZT-SPECT定量血流资料,并结合患者个体和临床的相关资料,对CMD产生的可能原因进行初步探索和研究。研究结果发现,与非CMD组相比,CMD组的LV-sMBF明显减低(P<0.05),而2组间LV-rMBF未见明显差异,提示部分PCI术后胸痛患者的MFR减低是由负荷状态下心肌需氧量增加,但微血管舒张功能不足所导致的[2-3,10];同时,本研究发现在PCI术后CAG阴性胸痛患者中,约有51.6%的患者MFR减低,提示CMD可能在这类人群中有较高的发病率。Li等[14]纳入39名PCI术后6~12个月、复查CAG结果阴性的胸痛患者,以12名PCI术后无症状患者作为对照,得出PCI术后胸痛患者较无症状患者的MFR减低的结论,与本研究结果类似。Konst等[13]对86名非阻塞性CAD的心绞痛患者测定一氧化氮活性、充血微血管阻力、静息心肌血流、负荷心肌血流,发现功能性CMD的特征是一氧化氮活性增强、静息血流量升高;结构性CMD患者则因内皮功能障碍导致负荷血流量升高,不足以达到正常参考值(静息血流量的3~5倍)[12]。通过CZT-SPECT心肌血流定量显像有助于甄别CMD产生的原因和类型,并通过危险因素管理、优化药物治疗等改善预后[15]。有研究表明,尼可地尔、雷诺嗪等新型药物对于CMD患者可能有益[16-17]。因此,对于PCI术后胸痛患者而言,通过CZT-SPECT心肌血流定量显像无创性诊断CMD有助于优化治疗、改善预后,可作为临床研究中各种新型药物效果评估的无创、客观性手段。本研究尚存在一定的局限性:(1)本研究为单中心回顾性研究,样本量相对较小;(2)受临床可及性的限制,未能进行乙酰胆碱激发试验筛出微血管痉挛患者,这有可能是PCI术后MFR正常患者的胸痛原因。
总之,本研究发现PCI术后CAG阴性胸痛患者中约半数出现MFR减低,主要是sMBF减低所致,提示冠状动脉微血管舒张功能异常可能是引起此类患者胸痛的主要原因。PCI术后CAG阴性胸痛患者病因的客观性诊断和严重程度的评估是临床面对的主要难题,CZT-SPECT心肌血流定量测定MFR为PCI术后CAG阴性胸痛患者的诊断和评估提供了临床上切实可行的影像学方法,能够解决其中一部分CMD患者的诊断和评估难题。对于PCI术后胸痛患者而言,通过CZT-SPECT心肌血流定量显像无创性诊断CMD甚至甄别CMD产生的原因和类型,有助于通过危险因素管理、优化药物治疗等改善预后,但尚需进一步扩大样本进行深入研究。
