不同ω-3多不饱和脂肪酸对斑马鱼阿尔茨海默病模型记忆损伤和神经病理学变化影响
2022-07-14钟绮媚张晶晶杨志友邓淑怡王佳佳张永平
钟绮媚,张晶晶,杨志友,邓淑怡,王佳佳,张 才,张永平,宋 采
(1.广东海洋大学食品科技学院,广东 湛江 524088;2.广东海洋大学深圳研究院,广东 深圳 518120;3.广东省水产品加工与安全重点实验室,广东 湛江 524088;4.广东医科大学附属医院,广东 湛江 524088)
阿尔茨海默病(Alzheimer's disease,AD)是常见的进行性神经退行性疾病,临床上以认知障碍、记忆衰退等表现为特征。AD 发病因子包括细胞外沉积的β 淀粉样蛋白(β-amyloid,Aβ)、磷酸化tau(ptau)形成的胞内神经元纤维缠结和乙酰胆碱(acetyl‐choline,ACh)缺乏。目前针对这些因子的药物疗效极微。近年来,笔者团队和其他研究者提出并证明神经炎症在AD 发病中的重要角色。神经炎症以小胶质细胞和星形胶质细胞激活为主要特征。神经元老化和活性氧产生增加,外周免疫炎症反应均可能激活胶质细胞的炎症反应[1]。其中小胶质细胞的激活分为促炎M1 和抗炎M2 亚型。小胶质细胞和中枢神经系统相关的巨噬细胞(CAMs)功能十分相似,前者过度激活是诱导情感和神经退行性疾病的原因之一。最新研究比较小胶质细胞和CAMs的特征,确定己糖胺半乳糖苷酶亚基β(Hexb)是稳定表达的小胶质细胞核心基因[2]。在突变Hexb 和APP转基因小鼠中,皮质和海马中的Aβ 斑块减少[3]。此外,在AD 患者大脑中还发现Hexb 增加[4],Hexb 被认为与M1型激活相关,因此,本研究选择Hexb作为小胶质M1亚型激活标记物。与此相似,星形胶质细胞的极化亦可产生促进炎症级联反应和神经保护的作用(如释放BDNF)。由于胶质纤维酸性蛋白(gli‐al fibrillary acidic protein,GFAP)作为整体星形胶质细胞标志物,在AD 患者中表达增加[5],本研究选择GFAP 和BDNF 作为星形胶质细胞标志物。外周炎症激活脑内的胶质细胞引起神经炎症,环境毒素如铝造成外周炎症过度反应,促炎因子通过血脑屏障,激活脑内胶质细胞并释放促炎症因子,促进Aβ 产生,神经元纤维缠结和乙酰胆碱酯酶活性增强,加速神经元变性死亡[6]。由于目前尚无药物能阻止或逆转AD 进程,且大部分临床药物毒副作用显著。因此,探索AD 神经免疫学机制,寻找天然具有抗炎作用的活性物质或药物成为治疗AD热点。
ω-3 PUFAs包括二十碳五烯酸(Eicosapentaenoic acid,EPA)、二十二碳五烯酸(Docosapentaenoic acid,DPA)和二十二碳六烯酸(Docosahexaenoic acid,DHA),主要来源于海洋生物或深海鱼类等。红细胞ω-3 PUFAs含量的降低与神经细胞衰老和大脑认知功能减退成正比[7]。笔者团队曾首次和多次报道EPA 的抗炎机制,如抑制促炎细胞因子的合成,促使巨噬细胞/小胶质细胞向M2 表型极化[8],刺激星型胶质细胞A2 的激活,增加BDNF 的产生[9],逆转IL-1β 对记忆神经递质ACh 释放的抑制,进而改善记忆[10]。近年来,笔者团队发现EPA 可能通过增加DPA 含量发挥抗炎和改善记忆的作用,其机制为DPA 激活神经元BDNF/TrkB-PI3K/AKT 通路,保护神经元免受炎症诱导的损伤[11]。但DPA 在抑制中枢神经炎症和胶质细胞功能,以致改善认知的作用尚不明晰。而脑内含量最高的PUFAs DHA 被报道具有更显著的抗衰老和改善记忆的作用。例如,红细胞DHA 含量的降低与神经细胞衰老和大脑认知功能减退成正比[7]。目前,尚未见三种ω-3 PUFAs在预防和改善AD 认知和记忆障碍差异和各自优势,以及其对神经炎症治疗机制的研究报道。
斑马鱼(Danio rerio)因脑区功能与哺乳动物具有较大的同源性,如端脑负责记忆功能与哺乳动物海马区功能相似[12],而被逐步用于研究神经退行性疾病。铝离子能够诱导AD 相似的神经免疫学变化,文献[13]报道铝能够成功地诱导斑马鱼AD 模型。因此,本研究采用铝诱导斑马鱼AD 模型并检测其认知和记忆行为、脑内Aβ、p-tau、AChE、IL-1β浓度和小胶质细胞标志物Hexb、星形胶质细胞标志物GFAP、BDNF的mRNA变化,比较研究EPA、DPA和DHA对AD模型的影响,以期为海洋天然产物ω-3 PUFAs保健产品应用和开发提供支持。
1 材料与方法
1.1 材料与试剂
6-8 月龄野生型斑马鱼(上海佳誉水族馆);棕榈油(广州果漾生物科技有限公司,批号FC-0320);EPA(纯度85%,批号20180705)、DPA(纯度60%,批 号TZSW210402-1)和DHA(纯 度85%,批 号20171105)均购自西安通泽生物科技有限公司;六水合氯化铝(西陇科学股份有限公司,批号7784-13-6);斑马鱼AChE(批号202110)、p-tau(批号202101)、Aβ1-42(批号201911)和IL-1β(批号202110)试剂盒均购自深圳子科生物科技有限公司;Trizol RNA 抽提试剂(湖南艾科瑞生物工程有限公司);反转录试剂盒(批号R223-01)和SYBR Green 荧光染料(批号Q311-02)均购自南京诺维赞生物科技有限公司;引物由上海生物工程股份有限公司合成。
1.2 实验方法
1.2.1 铝激活转基因幼鱼脑内小胶质细胞 应用小胶质细胞被荧光蛋白标记的转基因斑马鱼Tg(coro1α:eGFP)(由广东医科大学附属医院临床研究中心斑马鱼平台提供)产卵,将受精后3 d(days post-fertilization,dpf)的具有荧光标记的幼鱼随机分组,在盛有胚胎水的24 孔板(孔径15.6 mm)中进行实验,每天定时记录存活率。通过前期毒性筛选,确定分组为对照组,使用pH 计(上海力辰仪器科技有限公司)调节溶液酸碱度至6.0±0.2,含铝质量浓度40、45 mg/L为模型组,使用质量浓度0.002%三卡因麻醉和羧甲基纤维素固定后,在共聚焦显微镜(日本奥林巴斯有限公司)20 倍镜下采集经铝诱导4 d 后的幼鱼相同位置的小胶质细胞激活情况,激发波长为488 nm,曝光时间1 s,所有图像均在相同条件下进行采集[14]。使用Image J 软件进行荧光强度统计。
1.2.2 实验分组与处理 野生型斑马鱼随机分成5组:对照组、模型组及EPA、DPA和DHA治疗组。参照文献[13]的AD模型建立方法,其中模型组及治疗组斑马鱼暴露在pH 为6.0 ± 0.2 含铝离子质量浓度为100 µg/L 水中,同时模型组喂食含质量分数1%的棕榈油饲料,EPA、DPA 和DHA 治疗组对应地喂食含饲料质量分数1%的EPA、DPA和DHA饲料[15];对照组仅在pH 为6.0±0.2的水中养殖;每天测量并使用盐酸调节酸碱度。实验周期为30 d。
1.2.3 行为学实验 行为学实验分为新物体识别实验和奖赏记忆实验,行为结果由欣软软件(上海欣软信息科技有限公司)分析。
新物体识别实验检测成年斑马鱼认知水平,参照Cognato 等[16]的测试方法。T 迷宫由透明有机玻璃制成,外部各臂粘有黑色塑料自黏膜,黑色塑料自黏膜上被裁出正方形、三角形和圆形的视觉提示卡片。实验时长共2 d,训练期:测试前一天将每组斑马鱼从开始臂放入,关闭新臂,让其在开始臂、训练臂自由活动30 min;测试期:打开新臂,逐一把斑马鱼从开始臂放入,使其自由探索迷宫5 min,记录到达新臂的潜伏期(第一次进入新臂的时间)和在新臂活动的时长。
奖赏记忆实验参考Darland等[17]的方法,略有修改,应用食物奖励使斑马鱼对投食臂具有偏好性,以评价其记忆能力。训练期:将投食环放置在左右末端处,把每组斑马鱼从开始臂放入,每10 min 向奖励臂端投食环中放入少量饲料,自由活动30 min。测试期:训练结束后24 h,撤去投食环,把鱼从长臂放入,使其探索迷宫5 min,记录到达喂食臂的潜伏期(第一次进入奖励臂的时间)和在喂食臂活动的时长。测试完毕后,当天按训练模式放置投食环进行强化记忆训练,每组20 min,每10 min 在投食环中放入少量鱼食。第3、4、5 天重复第2 天的实验步骤,第5天测试完毕后不再强化记忆训练。
1.2.4 Aβ、p-tau、AChE、IL-1β 浓度检测 根据Elisa试剂盒说明书检测斑马鱼脑组织AChE、p-tau、Aβ1-42和IL-1β蛋白质量分数。
1.2.5 荧光定量PCR 检测 提取斑马鱼脑组织mRNA,根据反转录试剂盒说明书反转录得cDNA,进行RT-PCR 检测小胶质细胞标志物Hexb、星形胶质细胞标志物GFAP 和BDNF 的mRNA 变化(引物序列见表1),将目的基因相对于管家基因Actin的表达进行△△CT校正[18]。

表1 荧光定量PCR引物序列Table1 Primer sequence of qPCR
2 数据处理
本研究数据均采用Graph Pad Prism 8.0.2 统计软件处理,方差齐性数据采用单因素方差分析(One-way ANOVA),进行LSD 检验,其中小胶质细胞荧光强度和奖赏记忆行为结果使用t检验。P<0.05被认为具有显著的统计学差异。
3 结果与分析
3.1 铝质量浓度对斑马鱼幼鱼脑内小胶质细胞的影响
由图1可见,与对照组相比,铝处理后转基因斑马鱼Tg(coro1α:eGFP)幼鱼脑中,荧光标记的小胶质细胞数量显著增多,在一定浓度范围内,小胶质细胞荧光强度随铝质量浓度升高而增强,证明斑马鱼幼鱼小胶质细胞被铝激活。
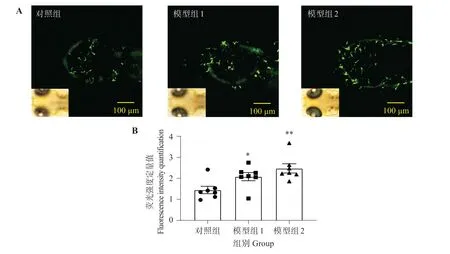
图1 铝对Tg(coro1α:eGFP)斑马鱼小胶质细胞的影响Fig.1 Effect of aluminum on Tg(coro1α:eGFP)zebrafish microglia
3.2 EPA、DPA和DHA对铝致斑马鱼认知障碍的影响
由图2可见,与对照组相比,铝显著延长斑马鱼到达新臂的潜伏期(P<0.05)并显著降低在新臂的活动时间(P<0.01);与模型组相比,EPA、DPA 和DHA 显著增加斑马鱼在新臂的活动时间(P<0.01),但对到达新臂的潜伏期无显著影响。这表明EPA、DPA 和DHA 均可部分改善铝致斑马鱼的新物体识别障碍。
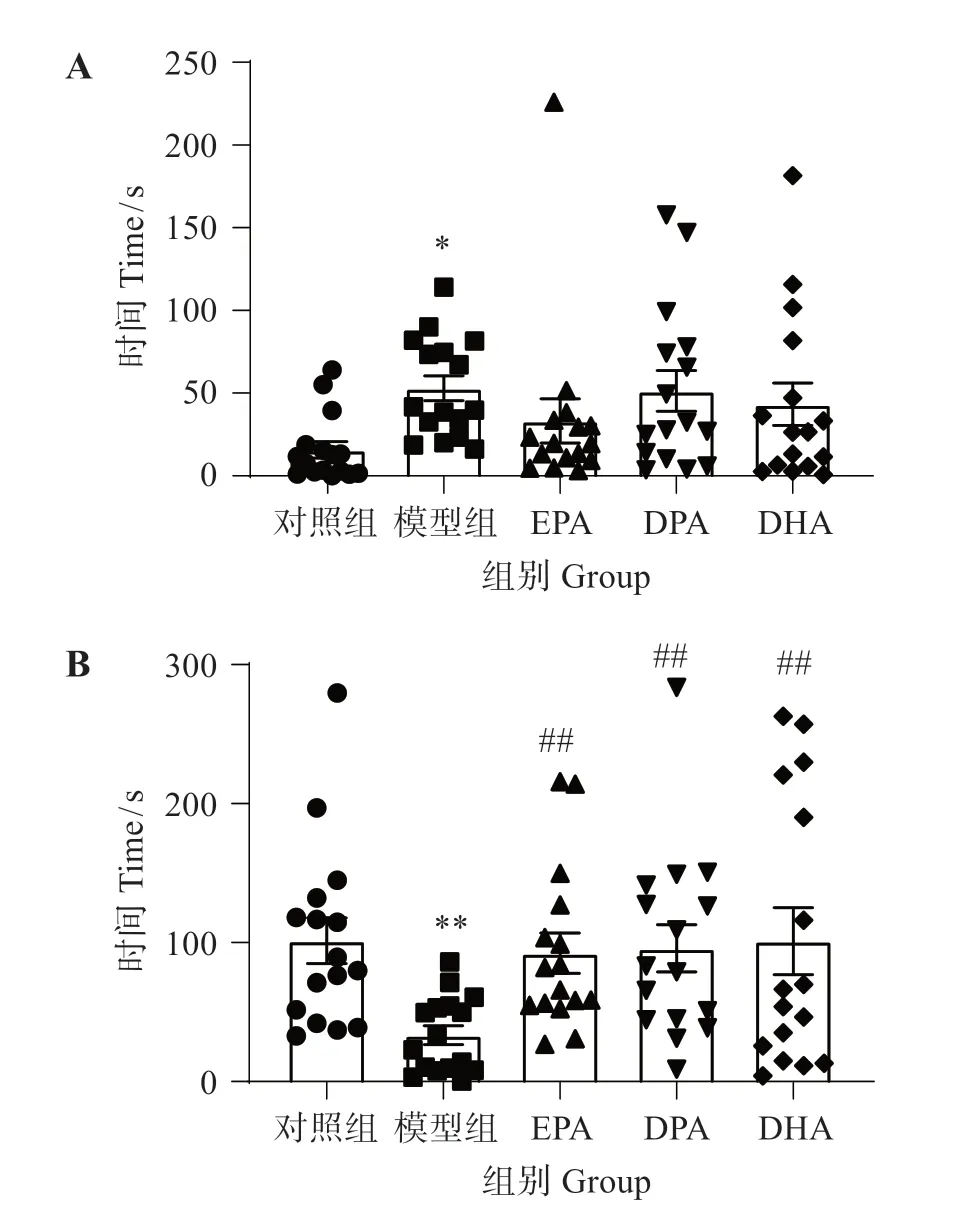
图2 EPA、DPA和DHA对铝致斑马鱼认知障碍的影响Fig.2 Effects of EPA,DPA and DHA on aluminum-induced cognitive impairment in zebrafish
3.3 EPA、DPA和DHA对铝致斑马鱼记忆障碍的影响
由图3可见,与对照组相比,铝显著增加斑马鱼到达奖励臂的潜伏期(D1:P<0.05,D4:P<0.001);与模型组相比,EPA、DPA 和DHA 均显著降低模型组到达奖励臂的潜伏期(D1:P<0.05)。与对照组相比,模型组显著减少奖励臂的活动时间(D1:P<0.05,后三天均为P<0.001);与模型组相比,EPA(前三天均为P<0.05,D4:P<0.01)、DPA(D1:P<0.05,D3:P<0.01,D4:P<0.05)和DHA(D4:P<0.01)治疗组均显著增加在奖励臂的活动时间。这表明,EPA、DPA 和DHA 均可部分改善铝导致斑马鱼的记忆障碍。其中,EPA 的改善效果最佳,DHA次之,DPA较差。
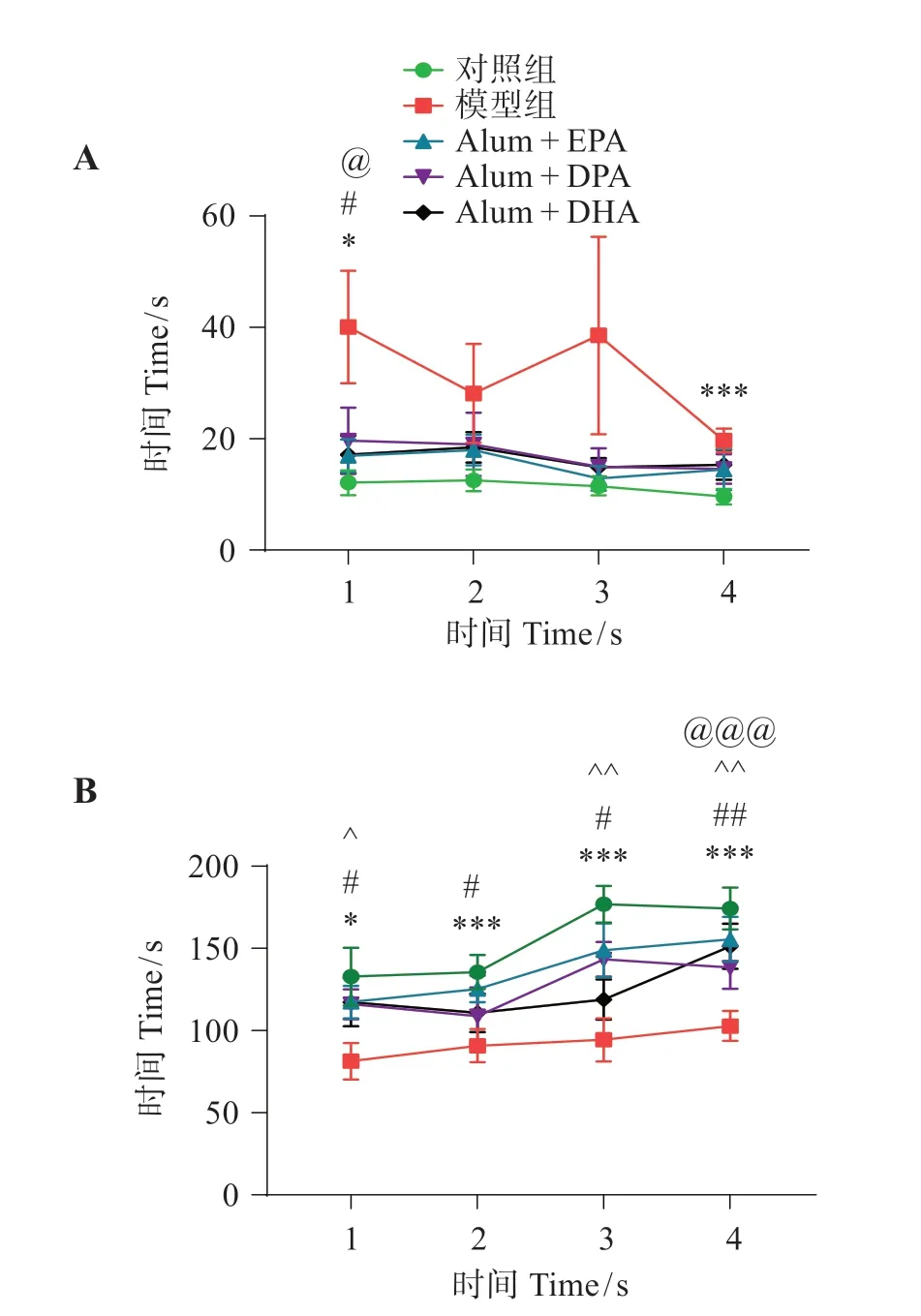
图3 EPA、DPA和DHA对铝致斑马鱼记忆障碍的影响Fig.3 Effects of EPA,DPA and DHA on memory impairment caused by aluminum in zebrafish
3.4 EPA、DPA 和DHA 对铝致斑马鱼Aβ1-42蛋白质量分数的影响
由图4可见,与对照组相比,模型组斑马鱼脑内Aβ蛋白质量分数极显著增加(P<0.001);与模型组相比,EPA、DPA 和DHA 均显著降低Aβ 蛋白的浓度(P<0.001)。这表明三种ω-3 PUFAs 均有抑制Aβ沉积的效果。
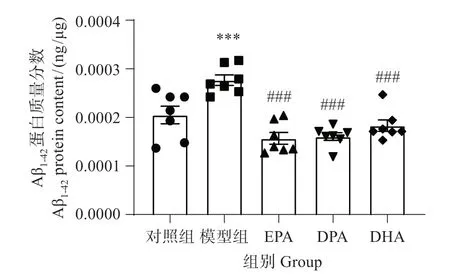
图4 EPA、DPA和DHA对铝致Aβ1-42蛋白质量分数的影响Fig.4 Effects of EPA,DPA and DHA on the amount fraction of Aβ1-42 protein caused by aluminum
3.5 EPA、DPA 和DHA 对铝致斑马鱼p-tau 蛋白质量分数的影响
由图5可见,与对照组相比,模型组斑马鱼脑组织p-tau蛋白质量分数显著增加(P<0.01);EPA(P<0.001)和DPA(P<0.01)均显著降低p-tau 质量分数,DHA 无显著影响。这表明EPA 降低p-tau 的作用最佳,DPA次之,DHA较差。
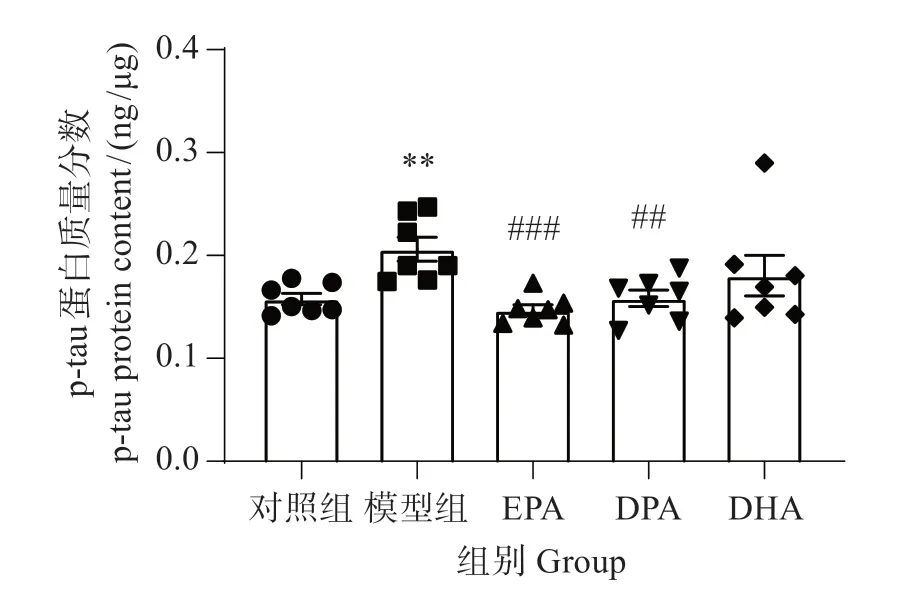
图5 EPA、DPA和DHA对铝致p-tau蛋白质量分数的影响Fig.5 Effects of EPA,DPA and DHA on the amount fraction of p-tau protein caused by aluminum
3.6 EPA、DPA 和DHA 对铝致斑马鱼AChE 蛋白质量分数的影响
由图6可见,与对照组相比,模型组斑马鱼脑组织的AChE 蛋白质量分数显著增加(P<0.01);与模型组相比,EPA(P<0.05)、DHA(P<0.01)显著降低AChE 蛋白质量分数,DPA 治疗组与模型组比较无显著影响。这表明DHA 降低AChE 的作用最佳,EPA次之,DPA的效果较差。
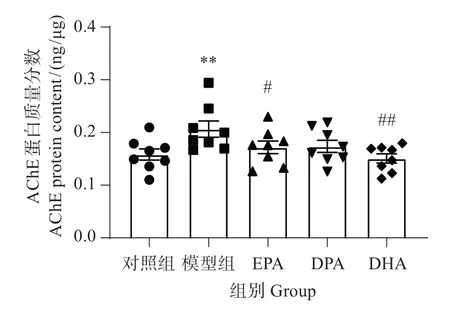
图6 EPA、DPA和DHA对铝致AChE蛋白质量分数的影响Fig.6 Effects of EPA,DPA and DHA on the amount fraction of AChE protein caused by aluminum
3.7 EPA、DPA 和DHA 对铝致斑马鱼IL-1β 蛋白质量分数的影响
由图7可见,与对照组相比,模型组斑马鱼脑组织IL-1β 蛋白质量分数显著增加(P<0.01);与模型组相比,EPA 显著降低IL-1β(P<0.05);DPA 和DHA与模型组比较,无显著影响。这表明EPA抗中枢炎症的作用最佳。
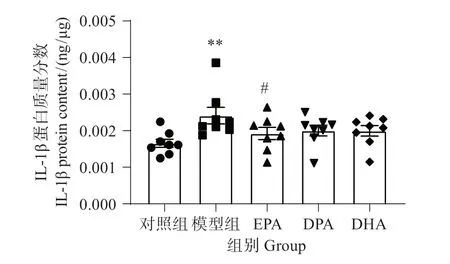
图7 EPA、DPA和DHA对铝致IL-1β蛋白质量分数的影响Fig.7 Effects of EPA,DPA and DHA on the fraction of IL-1β protein caused by aluminum
3.8 EPA、DPA 和DHA 对铝致Hexb mRNA 表达的影响
由图8可见,与对照组相比,模型组斑马鱼脑组织总的小胶质细胞标志物Hexb 的mRNA 表达显著增加(P<0.05);在EPA治疗组,Hexb的mRNA表达显著降低(P<0.01),DPA 和DHA 组无显著影响。表明EPA抑制小胶质细胞激活的作用最佳。
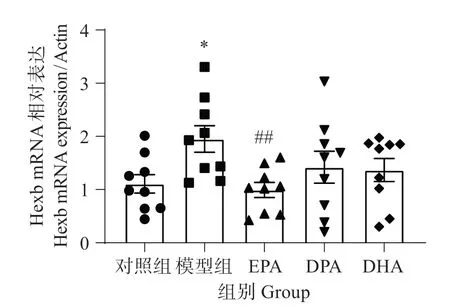
图8 EPA、DPA和DHA对铝致Hexb mRNA表达的影响Fig.8 Effects of EPA,DPA and DHA on Hexb mRNA expression caused by aluminum
3.9 EPA、DPA 和DHA 对铝致GFAP mRNA 表达的影响
由图9 可见,与对照组相比,铝诱导后,斑马鱼脑组织星形胶质细胞标志物GFAP的mRNA表达显著增加(P<0.01);EPA、DPA 和DHA 均显著降低其表达(P<0.01),表明EPA、DPA 和DHA 均有抑制星型胶质细胞激活的作用。
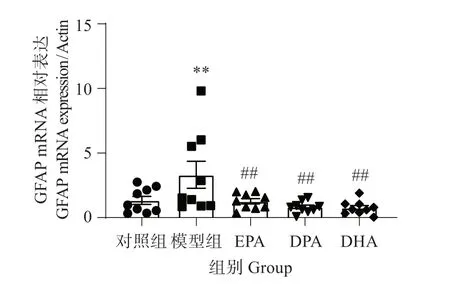
图9 EPA、DPA和DHA对铝致GFAP mRNA表达的影响Fig.9 Effects of EPA,DPA and DHA on GFAP mRNA expression caused by aluminum
3.10 EPA、DPA 和DHA 对铝致BDNF mRNA 表达的影响
由图10 可见,与对照组相比,模型组斑马鱼脑组织BDNF 仅有轻度下降;EPA(P<0.05)干预显著增加BDNF 的mRNA 表达。DPA 和DHA 组与模型组比较无显著影响。
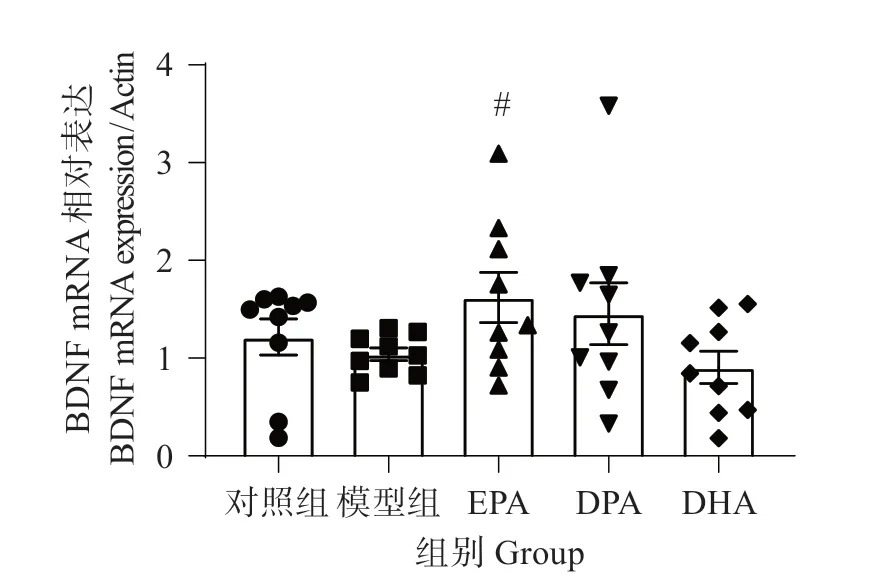
图10 EPA、DPA和DHA对铝致BDNF mRNA表达的影响Fig.10 Effects of EPA,DPA and DHA on aluminuminduced BDNF mRNA expression
4 讨论
本研究证明在荧光标记小胶质细胞的转基因斑马鱼Tg(coro1α:eGFP)幼鱼脑中铝激活小胶质细胞并随铝质量浓度升高而加剧。与之对应,成年斑马鱼脑内小胶质细胞标志物Hexb 的mRNA 水平上升,增加释放促炎因子IL-1β,这与铝引起大鼠小胶质细胞激活的结果一致[19]。但由于喂食斑马鱼幼鱼ω-3 PUFAs 较为困难,则在成年野生型斑马鱼比较研究ω-3 PUFAs 对铝致斑马鱼认知、记忆损伤和病理变化的改善作用。
本研究结果显示铝诱导的斑马鱼模型出现认知和记忆障碍,且脑内Aβ、p-tau、AChE 和IL-1β 显著增高,以神经炎症为标志的小胶质细胞和星形胶质细胞被显著激活,这些变化均符合AD 患者的病理变化,表明此AD斑马鱼模型成立。
临床实验表明,长期摄入ω-3 PUFAs 能够改善衰老和早期AD 引起的认知和记忆衰退[20],本研究的行为结果进一步支持该临床研究发现。在新物体识别实验中,EPA、DPA 和DHA 均可部分改善铝致斑马鱼的新物体识别障碍,三者效果相似。在奖赏记忆实验中,EPA、DPA 和DHA 均可部分改善铝致斑马鱼的记忆障碍,EPA 改善效果最佳,DHA 次之,DPA 较差。针对AD 的有关病理标志物,本研究发现EPA、DPA和DHA改善作用机制各不相同。
从ω-3 PUFAs 合成代谢途径来看,EPA 在体内通过产生中间代谢物DPA 形成DHA,DPA 在肝脏和大脑中可部分转化为EPA[21]。然而,大脑中DHA 的内源性合成高于EPA 和DPA,三者的含量和代谢合成途径均不相同。笔者团队和其他学者在临床和其它动物模型曾报道EPA 和DHA 在改善抑郁症和记忆障碍方面的差异[22-27]。在大鼠的慢性应激抑郁模型中,EPA 比DHA 更好地抑制小胶质细胞激活和相关的神经炎症以及NF-kB 信号,EPA 在改善星形胶质细胞活性降低,促进GDNF、NGF、BDNF 神经营养素表达方面优于DHA[28]。本研究在斑马鱼的AD 模型中再次证实EPA 在抗炎和恢复BDNF 表达方面比DHA 更有优势。由于EPA 在体内含量极低及代谢迅速,但功能显著,被认 为EPA相当于第二信使[29]。而DPA 是EPA 向DHA 转化的中间产物。笔者团队最新发现在抑郁的细胞模型DPA 可平衡小胶质细胞M1 和M2 极化,并激活神经元-BDNF/TrkB-PI3K/AKT 通路,发挥保护神经元的作用[11]。在其他疾病干预中,DPA功能亦为独特。例如,在葡聚糖硫酸钠诱导的溃疡性结肠炎的小鼠模型中,DPA 表现出比EPA和DHA 更强的抗炎能力,其作者认为可能源于DPA抑 制PGE2 和LTB4基质的合成[30]。DPA在功能上也与DHA 具有更大的相似性,在心肌梗死发病后和出现症状之前,血浆中DPA 和DHA 衍生保护蛋白增加[31]。但在脑内,本研究首次研究DPA 对AD样病理变化的作用,其结果与其他学者在外周疾病的研究结果不尽相同,有待进一步的探究。本研究使用的DPA 纯度为60%,EPA 和DHA 的纯度均为85%,在计算ω-3 PUFAs 占饲料质量分数1%时,均除以其对应纯度,因此,喂食的ω-3 PUFAs 三者总量一致。此外,在厂家提供的检测报告中,酸价(≤2.0 mg/g)、过氧化物(≤1.5 mmol)和胆固醇(≤2.0 mg/g)等含量极低,且在已有研究报道中,未发现以上浓度会影响DPA 功效和对中枢学习记忆具有改善作用[32]。
针对AD 最重要的标记物Aβ,本研究发现ω-3 PUFAs 显著降低斑马鱼脑内Aβ 蛋白,这和被喂食含ω-6/ω-3 比值较高的饲料的APP/PS1 转基因小鼠大脑中Aβ增加的发现一致[33];支持Grimm等[34]发现的EPA 和DHA 促进Aβ 降解的结果,其机制可能与增加神经元和小胶质细胞中胰岛素降解酶相关。而本研究结果提示Aβ 降低也可能与EPA 的抗炎作用有关,因为笔者团队曾报道EPA 能够抑制IL-1β诱导的Aβ 前体APP 的表达[35]。本研究结果进一步证明EPA 降低IL-1β,抑制小胶质细胞激活进而降低Aβ 蛋白浓度。据报道,膳食补充DHA 可通过不同机制减少Aβ的生成,包括调节APP 的定位,增加α-裂解和抑制β-裂解等[36]。然而DPA 抑制脑内Aβ浓度的作用机制未见报道,需进一步探究。
另一重要AD 病理标记物,过度磷酸化tau 亦被ω-3 PUFAs 所改善。本研究发现,EPA 和DPA 可以显著逆转铝升高的脑内p-tau 浓度,Wen 等[37]也曾发现EPA 能够抑制tau 过度磷酸化;而DHA 在哺乳动物中可以抑制p-tau 浓度[38],本研究首次在斑马鱼AD 模型中研究DHA 对p-tau 浓度的作用,未发现DHA 显著的变化,可能与实验动物种属有关或需设计不同的实验。
针对AD 脑内ACh 缺失,本研究发现EPA 和DHA均可以降低此代谢酶的浓度。这与De Oliveira等[39]报道摄入EPA 和DHA 可恢复脑内AChE 浓度一致。笔者团队曾报道外周和中枢炎症能够增加Aβ、p-tau 的表达,降低ACh 的释放,本研究证明铝离子引起促炎因子IL-1β 升高。EPA 降低IL-1β 蛋白浓度并抑制小胶质细胞和星形胶质细胞的激活作用,但其他两种ω-3 PUFAs 没有显著的作用。这与笔者团队前期在抑郁症和AD 模型上的多项发现相似,即EPA 在抗炎、抑制胶质细胞炎症亚型方面具有显著的功能。在星形胶质细胞方面,A1型星形胶质细胞促炎,加速AD 进程,而A2 型则产生BDNF,发挥神经保护作用。BDNF 显著改善AD 大鼠(Rattus norvegicus)的空间学习和记忆能力,增加海马(Hippocampus)中乙酰胆碱的释放和乙酰胆碱转移酶的表达,降低Aβ 蛋白浓度,抑制神经元凋亡,促进神经发生[40]。GFAP 增加是星形胶质细胞激活的标志之一,可触发神经炎症,而抑制炎症可使GFAP 表达降低,促进A2 型星形胶质细胞分泌BDNF[41]。此外,本研究发现三种ω-3 PUFAs均能抑制铝激活的星形胶质细胞,在斑马鱼的AD 模型上进一步确认其他学者的发现,即缺乏ω-3 PUFAs 的饮食造成星形胶质细胞增生和激活[42]。有研究显示,在3×Tg AD 小鼠中,GFAP 的蛋白表达显著下降[43],这可能与斑马鱼强大的神经再生功能发挥保护作用有关[44]。本研究证明EPA 促进BDNF 表达,这可能来自EPA 独特的强大抗炎作用。一方面,EPA是Δ5去饱和酶的抑制剂,抑制AA(炎症物质的前体)合成,并作为产生替代性花生四烯酸的底物;另一方面,EPA 还通过一组促分解介质,即E系列溶解素发挥抗炎作用[29]。
本研究首次在转基因斑马鱼上直观地验证铝对小胶质细胞的激活作用,并在AD 模型上比较和研究EPA、DPA和DHA对记忆损伤和神经病理学的改善作用,但其具体细胞和分子机制还需进一步探讨。
5 结论
EPA 在改善铝致斑马鱼认知和记忆损伤、降低脑内Aβ、p-tau和AChE蛋白浓度及炎症反应中有最佳作用;DPA 可改善铝致斑马鱼认知和记忆损伤、抑制Aβ、p-tau 和星形胶质细胞激活的效果显著;DHA 可改善铝致斑马鱼认知和记忆障碍,在降低Aβ、AChE 和星形胶质细胞激活方面有较大优势。这些发现首次为ω-3 PUFAs 在AD 中的应用提供依据。
