化学分散剂对深圳大鹏湾海水石油降解及细菌群落结构的影响
2022-07-14颜辰瑶吴一超钱永明
颜辰瑶,彭 超,吴一超,李 顺,刘 丹,钱永明,路 璐
(西华师范大学1.生命科学学院/2.环境科学与工程学院,四川 南充 637009;3.中国科学院城市环境研究所,福建 厦门 361021)
化学分散剂可以降低石油在海面上的累积及迁移速度,减少大片油污迁移至海岸带的机率[1]。其中,美国环境保护署核准的化学分散剂Corexit是目前国际上应对海洋石油污染常用的分散剂之一。然而,化学分散剂作为一种有机混合液,对海洋环境也存在潜在危害。已有研究表明,Corexit 对浮游植物[2]、海洋动物[3]及微生物[4]可产生毒性。微生物降解石油则是更为清洁高效的溢油清除途径,也被认为是彻底消除海洋溢油的唯一途径[5]。在墨西哥湾溢油事件中,超过50%的溢油是通过微生物降解途径移除[6]。然而在海洋原位环境中,石油组分疏水性强、生物利用性低等特点成为限制微生物降解污染溢油效率的主要因素[7]。加入化学分散剂大大提高了石油在海水中的溶解度和生物可利用性,大量前期研究也证实投加分散剂可显著促进石油的微生物降解过程[8-11]。但是,很多研究也发现化学分散剂对石油微生物降解存在抑制作用[12,13]。因此,化学分散剂对石油降解微生物的影响效应在国际学术界一直颇具争议[14]。在我国,投加化学分散剂对石油降解微生物及其降解过程的效应研究尚处于起步阶段。化学分散剂如何影响海洋微生物的群落组成及主导石油降解菌群仍知之甚少[15]。
大鹏湾位于深圳市东南部,港口集装箱运输产业和航运业发达,是溢油事件发生的高风险区域。本研究以深圳大鹏湾为例,旨在揭示Corexit对海水中细菌群落结构、石油降解菌相对丰度及石油降解速率的影响,为评估分散剂的施用效果及其对环境微生物生态的影响提供理论支撑。
1 材料和方法
1.1 样品采集
本研究的海水样品采自于深圳市东南部大鹏湾(22°33′20″N,114°21′41″E)。样品使用卡盖式采水器采集深度0~2 m 的表层海水60 L,置于冷藏箱中,温度保持在4~6 ℃,24 h 内开展室内培养实验。海水的pH 为7.90±0.02,溶解有机碳为(6.40±0.05)mg/L,溶解氧为9.11 μmol/L,盐度为32±1。
1.2 主要仪器与试剂
旋转蒸发仪(RV10,IKA,德国),气相色谱-质谱联用仪GC-MS(7890A-240MS,Agilent,美国),烷烃标准品(C7-C40)和16种多环芳烃(PAHs,Polycyclic Aromatic Hydrocarbons)标准品购自Sigma-Aldrich公司,系列浓度用色谱纯正己烷配置。原油产自渤海湾的绥中原油,密度为0.962 g/mL。
1.3 室内模拟海水石油污染实验的设置
1.3.1 污染物储备液的制备 实验设置3 个实验组和1 个对照组,分别为石油可溶性组分(Water accommodated fraction,WAF)、石油和化学分散剂Corexit 混合物可溶性组分(Chemically enhanced water-accommodated fraction,CEWAF)、化学分散剂(Dispersant-only)及生物对照组(Biotic)。WAF、CEWAF 和Dispersant-only 的制备参考Kleindienst等[12]方法。步骤:1)用0.22 μm的滤膜过滤新鲜海水,将滤液置于65 ℃水浴锅中进行巴氏灭菌2~3 h,重复3次,获得灭菌海水。2)WAF:将850 mL灭菌海水置于1 L 玻璃瓶中,再加入150 mL 石油。CEWAF:向850 mL 灭菌海水中先加入150 mL 石油,再加入15 mL 的Corexit。Dispersant-only:取850 mL 灭菌海水,向其加入15 mL 的Corexit。3 个处理组以恒定转速(500 r/min)避光磁力搅拌48 h后,置于分液漏斗中静置,直至油水两相分离。将下层液相收集至玻璃瓶中,即分别获得WAF、CEWAF和Dispersant-only的储备液。
1.3.2 培养实验设置 将新鲜海水分装于1 L 无菌玻璃瓶中,每瓶750 mL;向玻璃瓶中分别加入WAF、CEWAF 和Dispersant-only 储备液,每个处理组设置3 个重复。Ziervogel 等[16]研究表明,当石油污染发生时,表层水体中的可溶有机碳(Dissolved Organic Carbon,DOC)在前21 d平均增加2倍,即约增加200~300 μmol/L。因此,为模拟海洋表层海水的石油污染,在各实验组中分别加入相当于300 μmol/L DOC 的石油/分散剂污染物,Biotic 处理组为相应体积的灭菌海水。样品瓶在25 ℃,转速50 r/min 恒温摇床中培养,培养过程中定时每隔3 d 开瓶通气,保证培养瓶中有氧环境。分别在0、3、7和21 d四个时间点取样。每个样品瓶中250 mL 海水用于测定石油烃组分总烷烃和总多环芳烃(Polycyclic aromatic hydrocarbon,PAHs);400 mL 海水过滤于0.22 μm 微孔滤膜(Millipore,USA)上,用于总微生物DNA提取。
1.4 烷烃和PAHs的萃取和分析
对于待测石油组分的样品,向250 mL海水中加入15 mL二氯甲烷液液萃取,震荡10 min,静止10 min,收集有机相,并重复3 次;向萃取液中加入1 g 无水硫酸钠去除水分,在旋转蒸发仪上浓缩至2 mL,浓缩液经硅镁吸附柱纯化后,浓缩并定容至1 mL待测。
石油烷烃和PAHs 组分采用外标法在GC-MS上定量测定。标准品烷烃(C7-C40)和PAHs(16种)做标准曲线,用色谱纯正己烷配置梯度浓度为1、5、10、20、30、40、50、100 μg/mL,各化合物的相关性均在0.998 以上。载气(He)流速1 mL/min;不分流进样。色谱柱为DB-5 石英毛细柱(30 m×0.25 mm×0.25µm);进样口温度:250 ℃。总烷烃测定升温程序为:初始温度35 ℃,以10 ℃/min温度升温至250 ℃保持2 min,以20 ℃/min 升至320 ℃,保持23 min。PAHs测定升温程序为:80 ℃保持2 min,以80 ℃/min温度升至180 ℃保持5 min,以4 ℃/min 升到290 ℃保持5 min。石油组分判定根据不同碳数烷烃和不同PAHs 的保留时间进行检索,并同时与标准物比对进行定性。
1.5 总烷烃和总PAHs降解率的计算
不同处理组中的总烷烃和总PAHs 随时间的降解率计算公式:
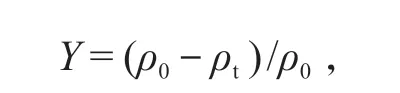
Y:不同培养时间点上海洋样品中总烷烃和总PAHs的降解率(%);ρt:培养td 后样品中总烷烃和总PAHs 的质量浓度(μg/L);ρ0:0 h 时样品中总烷烃和总PAHs的质量浓度(μg/L)。
1.6 海水样品微生物群落的分析
1.6.1 微生物总DNA 提取 将滤膜在无菌环境下剪切为碎片,采用FastDNA® Spin Kit for Soil (MP Biomedicals company)试剂盒提取海水总DNA。DNA 浓度和质量在NanoDrop 分光光度计(Nano‐drop Technologies Inc.,德国)上测定和评估,OD260/OD280在1.8~2.0 之间,通过琼脂糖凝胶电泳检测DNA 提取质量,主条带明亮,无弥散现象,提取的DNA保存于-20 ℃以备后续分析。
1.6.2 Ilumina Miseq 测序分析及实时荧光定量PCR分析 高通量测序分析采用barcode 序列等修饰后的细菌通用引物515F和907R,扩增微生物V4-V5区的16S rRNA基因进行扩增[17],50 μL PCR体系包括:25 μL 2XPCRMaster Mix,前、后引物各5 μL,2 μL DNA 模板,剩余用无菌水补齐。PCR 反应条件为:95 ℃预变性3 min,95 ℃变性30 s,55 ℃复性45 s,72 ℃延伸1 min,37 个循环,最后72 ℃延伸8 min。琼脂糖凝胶电泳检测PCR产物,纯化后的PCR 产物等摩尔数混合,在Illumina Miseq平台测序。序列上传至NCBI数据库,序列号为PRJNA810723。
实时荧光定量PCR (qPCR)扩增使用在宝生物工程(大连)有限公司的SYBR® Premix EX TaqTM(Tli RNaseH Plus)试剂盒,在CFX96 Optical Real-Time PCR System (Bio-Rad Laboratories,Hercules,CA)荧光定量仪上进行分析。qPCR 的标准曲线采用向载体质粒中导入含有细菌16S rRNA 基因的克隆子制备,将含有目标基因的克隆子在液体培养基中培养过夜,使用MiniBEST Plasmid Purification Kit(Takara)试剂盒进行质粒提取和纯化,使用NanoDrop 2000 分光光度计测定DNA 的浓度结合其分子质量计算标线的原始拷贝数。对质粒标线按10 倍梯度稀释,得到7 个数量级的标准曲线。定量PCR 的反应体系为20 μL,包括10 μL SYBR®Premix EX TaqTM(Tli RNaseH Plus),1 μL DNA模板,正向、反向引物分别为0.1 μl(10 μmol·L-1)和7.8 μL的灭菌双蒸水。阴性对照采用灭菌双蒸水代替样品DNA。
1.7 统计分析
所有数据分析采用Excel 2010 和SPSS 27.0 进行处理分析,处理之间的平均值差异采用one-way ANOVA 单因素方差分析,显著性水平α=0.05 表示差异,Origin 2018 作微生物群落结构组成图,cytoscape作网络分析图。
2 结果
2.1 化学分散剂Corexit对海水中烷烃和PAHs降解率的影响
图1 可知,添加Corexit 对总烷烃和总PAHs 降解的影响有所差异。对总烷烃的降解分析发现,培养3 d,添加Corexit 没有显著提高总烷烃的降解率(P>0.05);培养7 d 时,WAF 处理组中总烷烃的降解率显著高于CEWAF处理组(P<0.05)。培养21 d时,CEWAF 处理组的总烷烃降解率显著高于WAF处理组(P<0.05),CEWAF 处理组的烷烃降解率(57.3%±0.06%)比WAF 处理组(42.8%±0.04%)高1.34 倍,添加Corexit显示出促进作用。对PAHs降解的数据分析表明,在培养的前7 d,WAF和CEWAF处理组的PAHs降解率无显著差异(P>0.05);培养21 d时,CEWAF 处理组中总PAHs 的降解率(48.5%±0.02%)才显著高于WAF 处理组(39.8%±0.02%)(P<0.05),是WAF处理组降解率的1.22倍,表明添加Corexit在培养后期促进了总PAHs的降解。

图1 WAF和CEWAF处理组中降解率随时间的变化Fig.1 Degradation rates of in WAF and CEWAF treatments across the incubation time
2.2 细菌16S rRNA基因拷贝数分析
从图2 看出,与Biotic 比较,在WAF 处理组中,从3 d 至21 d,其微生物拷贝数都显著高于对照组,且在7 d 时丰度最高。CEWAF 处理组在不同培养时间点,微生物丰度均显著高于WAF 处理组(P<0.05)。在仅添加分散剂的处理组中微生物丰度与0 h时相比也显著增加。
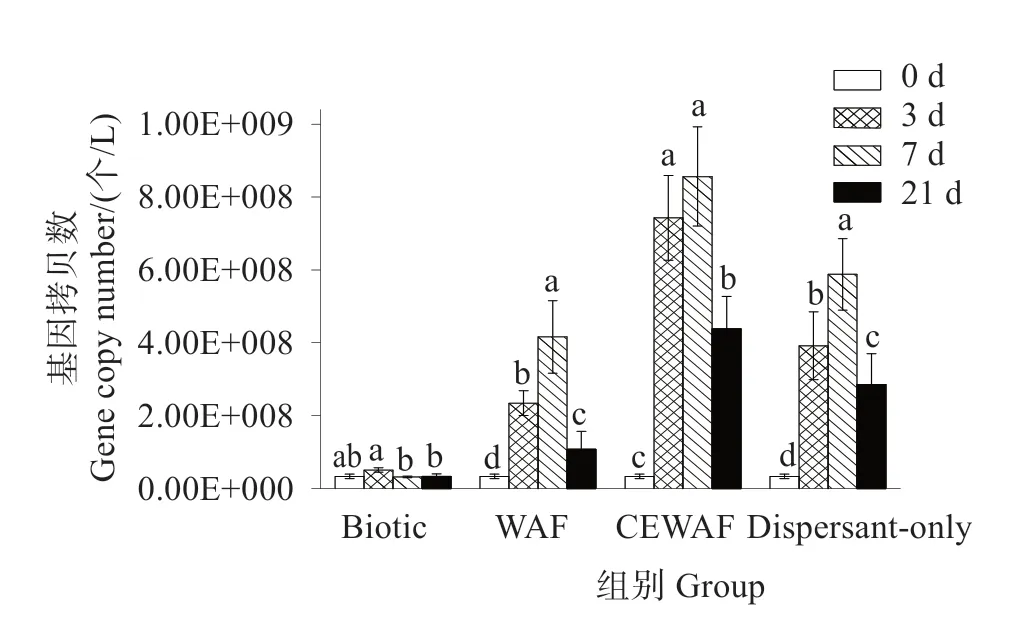
图2 细菌16S rRNA基因拷贝数Fig.2 Copy numbers of bacterial 16S rRNA genes
2.3 化学分散剂Corexit 对海水中细菌群落结构的影响
16S rRNA 基因Miseq 高通量测序结果揭示不同处理组中细菌群落结构的变化(图3)。与Biotic处理组相比,WAF、CEWAF、Dispersant-Only 三个处理组中,主导细菌菌群发生了改变,不同实验组中细菌群落结构显著差异(P<0.01),且不同培养时间菌群结构有所差异。添加WAF 促进了海水原位石油降解菌的增加,培养3 d 时,Neptuniibacter、Aestuariibacter、Lutimaribacter、Pseudomonas(假单胞菌属)、Aquibacter(水杆菌属)和Planctomyces的相对丰度相比于WAF 处理组的0 h 时增加388、34.3、11.0、7.6、5.7 和4.7 倍。其中,Lutimaribacter增加的相对丰度最高,增加了10.47%。培养7 d 时,WAF 处理组中主导菌群为Lutimaribacter(31.3%)、Acinetobacter(24.3%),占总菌群群落的55.6%。而培养21 d 时,主导菌群变为Planctomyces(35.4%),此外,相比于0 h,Haliea和Winogradskyella也有显著增加,分别增加了28.2和21.6倍。
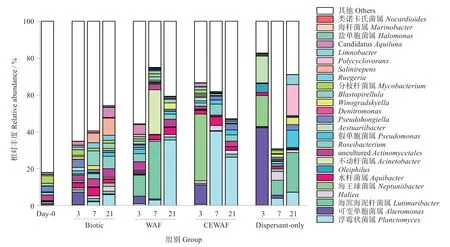
图3 不同处理组中属水平的细菌群落结构随培养时间的变化情况Fig.3 Changes in the bacterial community structure at the genus level across the incubation time in different treatments
添加分散剂的CEWAF 处理组的主导菌群组成与WAF 处理组不同,表明添加分散剂Corexit 改变了石油降解菌群。CEWAF 处理组3 d 时,Neptunii‐bacter(36.3%)和Alteromonas(10.6%)为主导菌群,相对丰度相比于0 h 增加了36 636 和13.4 倍。其中,Neptuniibacter的相对丰度比WAF 处理组3 d 时高91.2 倍。而在培养7 和21 d 后,主导菌群均为Planctomyces,相对丰度分别达到40.1%和26.0%,相比于0 h 增加了294.3 和190.3 倍。其中,7 d 时,Planctomyces在CEWAF 处理组中相对丰度比WAF处理中高出37.4%,是WAF 处理中的13.5 倍。CEWAF 处理中Haliea和Pseudomona增加的相对丰度也高于WAF处理组。在仅添加Corexit的dispersantonly 处理组中,培养3 d,主导菌群为Alteromonas(41.9%)、Neptuniibacter(16.8%),Aestuariibacter(14.6%),其中Alteromonas和Aestuariibacter的丰度比CEWAF处理组3 d时高3.0和7.5倍。在dispersantonly处理组培养7和21 d 时,Lutimaribacter、Oleiphilus、Haliea、Pseudomonas等菌都有显著富集。21 d 时,Dispersant-only 处理组中主导菌群为Lutimaribacter(21.5%)、Polycyclovorans(16.8%)和Pseudomonas(9.4%),其中Polycyclovorans相比于0 h增加16 848 倍,且比WAF 处理组21 d 时Polycyclov‐orans的相对丰度高28.2倍。
2.4 海水菌群相关性网络关联分析
基于不同处理组以及不同时间点的细菌群落OTU 组成,分析所有样品中OTU 相对丰度变化的相关性,将显著相关(P<0.01)的OTU呈现于网络图中(图4)。此网络显示有强相关性的OTU 有273个,它们之间存在586 种联系。网络互作关系中负相关的连线占比为53.1%,正相关比例为46.9%。通过对不同微生物类群节点数量进行统计,发现此网络中α-变形菌纲(Alphaproteobacteria)和γ-变形菌纲(Gammaproteobacteria)的节点数最多,占总节点数的24.1%和23.9%,其次是黄杆菌纲(Flavobacteriia)、拟杆菌纲(Bacteroidia)和浮霉菌纲(Planctomycetota),比例分别为9.3%、6.6%和4.4%;网络中连通度相对较高的关键OTU 有13 个(表1)。其中有石油降解菌Thalassotalea、Planctomyces、Oleibacter 等。Planctomyces 在不同处理组中都随时间显著富集,为海洋中常见石油降解菌[18]。
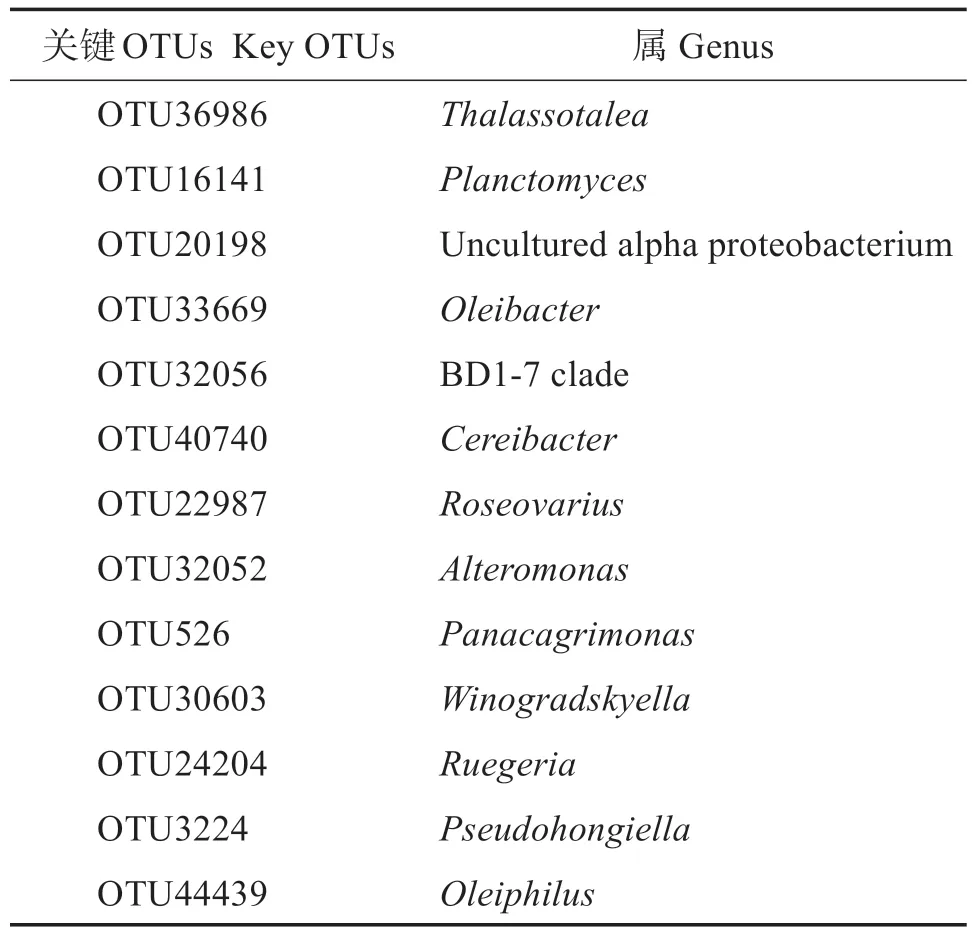
表1 基于OTU的细菌群落网络分析中的关键OTUsTable 1 The key OTUs of the bacterial network based on the microbial OTU composition

图4 基于不同处理组中的细菌群落OTU组成的分子生态网络分析Fig.4 Network analysis depicting the co-occurrence pattern among the OTU compositions of bacterial communities for different treatments
3 讨论
3.1 分散剂Corexit对石油不同组分的降解率影响
加入分散剂的CEWAF 处理组中,Corexit 显著提高了石油组分的降解率,这一结果与在墨西哥湾[8]、挪威海峡[19]及北冰洋[20]等海域的研究结果一致。然而,在该培养实验前7 d,Corexit 对总烷烃和总PAHs 的降解并未有促进作用,甚至3 d 时对总烷烃的降解呈抑制作用,该现象在对美国基普拉德霍湾的海水研究中也有发现,Foght等[21]在对美国基普拉德霍湾的海水研究发现Corexit 成分中的磺基琥珀酸钠二辛酯能抑制烷烃的微生物降解。纯菌水平也发现Corexit 中的表面活性剂成分(如Span 20、Tween 80 和Tween85 等)能显著抑制Acinetobacter calcoaceticus和Rhodococcussp.str.094 降解烷烃的能力[22]。此外,在该实验培养初期,Corexit 未促进石油组分降解还可能是由于Corexit 本身优先于石油被微生物所降解,间接对石油降解过程产生影响。Lindstrom 等[23]研究发现海洋微生物群落降解Corexit 的速率显著高于降解原油的速率,同时Corexit 的加入可能促使海洋微生物选择性地降解特定碳氢化合物。也有研究发现很多有机物降解微生物能同时降解石油和分散剂[24-25],最终也促进石油组分降解。此外,在WAF 处理组培养初期,总烷烃的降解率高于总PAHs 的降解率,这与海水中石油降解微生物有选择性地降解不同碳氢化合物有关。石油降解微生物菌群会偏好性地优先降解直链烷烃及低分子质量碳氢化合物(C2-C5),随后对PAHs 及高分子质量碳氢化合物(C5-C20)等进行降解[26]。综上,在深圳大鹏湾海水中,投加Corexit 能促进石油组分的降解,且在不同时间尺度上对石油不同组分的降解率影响也有差异。
3.2 深圳大鹏湾海水中的石油降解菌群落结构
石油进入海洋,海洋环境中的石油降解微生物能迅速通过提高代谢速率和繁殖速度来分解石油组分[27]。石油组分的添加显著促进海水中石油降解菌增加,主导的石油降解菌随着培养时间变化显著。在WAF处理组中,培养3 d时,多种石油降解菌相对丰度增加3.39~388 倍,其中,Neptuniibater[28]、Pseudomonas[29]、Aquibacter[30]等都为海水中常见的石油烃降解菌。7d时的主导石油降解菌为Lu‐timaribacter和Acinetobacter,在波斯湾溢油污染后,发现Lutimaribacter显著增加,为海水中天然石油降解菌[31]。Acinetobacter的不同菌属能高效降解烷烃和多环芳烃[32-33],在渤海湾的石油污染水域也有大量富集[34]。Lutimaribacter和Acinetobacter在培养中期显著富集,也与该时刻总烷烃和总PAHs 的高降解率相耦合。WAF 处理组培养后期,Planctomy‐ces成为主导石油降解菌,该菌在深海石油泄漏区域的海水也被发现有显著富集[35]。同时,该菌在海洋溢油的PAHs降解中有很多报道,在墨西哥湾及Exxon Valdez 溢油海域,均发现其参与PAHs 的降解[36],说明该菌为降解海水中持久性的石油组分有贡献。
此外,综合分析石油烃降解率和细菌群落变化的数据发现,虽然石油烃的降解主要发生在前7 d,但培养21 d时,海水中的主导石油降解菌却与前7 d的菌群有差异显著。该现象可能与随着培养时间推进,海水中营养成分(如氮和磷)被迅速消耗,造成微生物丰度减少和石油降解效率降低有关[12];其次,培养后期选择出的石油降解菌,如Planctomyces,可能参与了降解高分子量的石油烃或降解醇类等石油降解中间产物[37]。
3.3 投加分散剂Corexit 改变海水原位石油降解菌群落结构
分散剂作为外源有机物,对海水中微生物群落结构会产生影响[15]。本研究CEWAF 处理组中,石油降解菌菌群变化与WAF 处理组有显著差异,Kleindienst 等[12]、Stephen 等[8]对墨西哥湾海水中微生物对Corexit 的响应研究发现,Corexit 促进了能同时降解分散剂和石油的碳氢化合物降解菌Colwellia的生长,而抑制原位天然石油降解菌Marinobacter的生长,进而影响石油烃的降解规律。值得注意的是,WAF 和CEWAF 处理组中的微生物群落结构虽然有显著差异,但是在培养21 d 时,CEWAF处理组中石油烃降解率才显著高于WAF处理组。该结果可能由于CEWAF 组增溶的石油烃组分促进了微生物的生长(图1),也促进了多样性更高和降解效率各异的石油降解菌群,进而提高CEWAF 处理组中降解率[27]。其次,CEWAF 处理组中的一些石油降解菌也可能同时参与分散剂降解,进而影响培养初期石油烃的降解效率[12]。
在添加Corexit 后,主导的石油降解菌由WAF中的Lutimaribacter、Acinetobacter,Planctomyces变为Neptuniibacter、Planctomyces、Alteromonas。培养的第3 d,CEWAF相比于WAF处理组Neptuniibacter显著富集,抑制了Lutimaribacter的生长。Doyle等[38]在美国加尔维斯顿港附近海水中也发现在同时加入石油和Corexit 的处理组中,Neptuniibacter在海水微生物群落中的相对丰度显著升高。在Dispersant-only 处理组中,Neptuniibacter也有富集,表明该菌可能同时参与了石油和分散剂的降解。在培养7 d 和21 d 后,CEWAF 的主导菌均为Planctomyces,在仅加入分散剂的Dispersant-only 处理组中Planctomyces相比于0 h 也富集了294.3 和190.3 倍。Planctomyces作为海洋中常见的石油降解菌[18],在Couto 等[39]对巴西格米亚海滩附近海水的研究中发现,石油污染时,加入分散剂促进了Planctomyces生长,表明Planctomyces可能同时参与石油和分散剂降解。该菌在网络分析中为关键菌属,与菌群中多种微生物互作关系紧密,在不同处理组中,可能均参与多种有机物降解。此外,CEWAF 处理组中,加入Corexit 促进了Haliea和Pseudomonas等石油降解微生物的富集,这些菌在海洋石油的微生物降解过程中都起重要作用[40]。
相比于WAF 处理组,CEWAF 处理组中细菌群落结构的显著变化可能有如下几个原因:1)某些石油降解菌因为其自身亲水亲油性,易吸附在油/水界面上,Corexit 的加入乳化浮油形成油滴溶于水,为这些菌提供更多吸附界面,定向促进一些石油降解菌生长。如海洋中隶属于Alteromonaldaceae的菌群更易聚集于各种界面环境(海水表面、可溶性颗粒物等)[41]。2)CEWAF 处理组中,由于加入分散剂,促进石油中不可溶组分的水溶性,虽然本实验中WAF 和CEWAF 处理组中加入同等量的DOC,但其中的石油组分组成不同[12]。溢油污染发生后,海水中石油降解菌的菌群结构的变化很大程度上取决于石油组分的组成[28]。3)分散剂可能对某些微生物有较强毒性,或可作为一些微生物的底物进行降解行为,进而导致微生物丰度增加和细菌群落结构的变化。如Campo 等[42]研究发现从海水中分离的两株石油降解菌可高效降解Corexit。在Dispersant-only 处理组中,石油降解菌Alteromonas、Neptuniibacter、Pseudomonas等均显著富集,表明这些菌可能参与Corexit 的降解。
4 结论
化学分散剂对海洋溢油降解过程和海洋细菌群落的影响随分散剂类型、石油种类及环境条件的不同而有所差异。因此,研究不同海域分散剂对石油降解及微生物的影响能为分散剂的选择和使用提供依据。本研究发现:1)加入Corexit促进海水中微生物的生长,培养21 d 时促进了石油降解效率;2)加入石油和Corexit 改变了海水原位的石油降解微生物菌群,由主导的石油降解Lutimaribacter、Acinetobacter和Planctomyces转变为Neptuniibacter、Planctomyces和Alteromonas;(3)在仅加入Corexit的处理中,Alteromonas和Lutimaribacter的富集表明了其可能同时具有降解石油和分散剂的能力。基于本研究,未来可针对不同海域进一步开展化学分散剂对海洋微生物石油降解效率和代谢机制的研究,为海洋溢油事故中化学分散剂的使用提供指导依据。
