姜黄素对阿霉素肾病大鼠Notch信号通路相关蛋白的影响
2022-07-13曹慧慧王悦彤赵仁伟席少卿李晓琪王漱非
曹慧慧,王悦彤,屈 凯,赵仁伟,席少卿,李晓琪,沈 霞,王漱非
(1.陕西中医药大学,陕西 咸阳 712046;2.西安市长安区中医医院,陕西 西安 710100;3.陕西省中医医院,陕西 西安 710003)
慢性肾脏病(Chronic kidney disease,CKD)是指各种原因引起的慢性肾脏结构和功能障碍[1]。目前CKD的治疗主要有透析和肾移植,不仅肾源有限[2],而且费用昂贵,故延缓CKD进展尤为重要[3]。肾小球硬化是慢性肾脏病进展的主要病理因素,肾小球的主要生理结构有肾小球系膜细胞和系膜基质[4],肾小球基底膜增厚和细胞外基质的过度沉积是肾小球硬化的主要病理变化,因此抑制肾小球基底膜增厚和细胞外基质的过度沉积可延缓肾小球硬化进展。姜黄素为中药姜黄的根茎提取的多酚类单体,具有抗炎、抗氧化[5]、抗肿瘤[6]、降脂和降糖[7]等药理作用,且不良反应小。有研究表明姜黄素可减轻糖尿病肾病小鼠的肾损伤和肾纤维化[8-9]、改善肾小球细胞外基质的过度沉积[10]。进一步研究表明,姜黄素对血管疾病、神经根疼痛[5]、肾脏病[3]、视网膜病变和胰腺疾病[11]均具有一定的疗效。近年来,多项研究表明Notch信号通路不仅在肾脏的发育中扮演重要角色,而且参与多种肾脏疾病的发生[12-13]。本实验拟建立阿霉素肾病大鼠模型,观察姜黄素通过调控Notch信号通路下神经源性基因Notch同源蛋白1(Neurogenic locus notch homolog protein 1,Notch1)、转化生长因子β1(Transforming growth factor β1,TGF-β1)、单核细胞趋化蛋白-1(Monocyte chemotactic protein-1,MCP-1)的蛋白表达延缓阿霉素大鼠肾小球硬化的进程,并初步探讨其作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:健康清洁级雄性SD大鼠60只,2~3月龄,体重(200±20)g,购于四川省成都市达硕实验动物有限公司,动物许可证号:SCXK(川)2015-030。适应性喂养1周,实验室温度20~25 ℃,湿度55%~65%,大鼠均按标准要求给予颗粒饲料喂养,自由饮水和自然昼夜节律光照。实验室的管理与操作符合相关法律及伦理规定。
1.1.2 实验药物与试剂:盐酸贝那普利片(国药准字H20030514);注射用盐酸阿霉素(国药准字C4125316-40-9);柠檬酸抗原修复液(批号G1202)、3%过氧化物酶封闭液(批号G0115)、苏木素染液(批号G1004)、HRP标记山羊抗兔(批号G23303)均购自武汉Servicebio公司;Plus RNA提取试剂盒购自日本TaKaRa公司;反转录试剂盒购自日本TaKaRa公司;Platinum SYBR Green qPCR SuperMk-UDG试剂盒购自美国Invitrogen公司;引物购自美国国立生物技术信息中心;Notch1、TGF-β1、MCP-1均购自英国Abcam公司;ECL辣根过氧化物酶发光液购自北京普利莱公司;DEPC试剂、不同梯度乙醇、PBS缓冲液等由陕西省中医医院病理实验室提供。
1.1.3 实验仪器:AL104电子天平(上海梅特勒)、低温高速离心机(美国Beckman公司)、-20 ℃冰箱(青岛海尔)、-80 ℃超低温冰箱(美国Thermo公司)、AU2700全自动生化分析仪(日本Olympus公司)、LX20生化分析仪(美国Beckman公司)、ABI 9700PCR扩增仪(美国Thermo公司)、Nano-200超微量核酸分析仪(美国GE公司)、罗氏480荧光定量PCR仪(德国Roche公司)、显微镜(日本Olympus公司)、H-600电子显微镜(日本日立公司)等。
1.2 实验方法
1.2.1 动物分组:将60只SD雄性大鼠按体重大小从1到60编号,从随机数字表中的任一行任一列开始依次读取2位数作为一个随机数录于编号下,然后将60个随机数从小到大编序号,将序号记录在对应的每个随机数下面;规定序号1~10为空白组、序号11~20为模型组、序号21~30为对照组、序号31~40为姜黄素低剂量组、序号41~50为姜黄素中剂量组、序号51~60为姜黄素高剂量组。
1.2.2 造模及给药:适应性喂养结束后,除空白组外其余各组分别于第1、7天给予盐酸阿霉素4 mg/kg尾静脉注射,建立阿霉素肾病大鼠模型,14 d后检测24 h尿蛋白≥150 mg,说明造模成功。造模成功后对照组以10 mg/kg盐酸贝那普利灌胃;姜黄素低、中、高剂量组分别予50、100、200 mg/kg姜黄素灌胃;空白组和模型组分别予等剂量的0.9%氯化钠溶液灌胃,各组均持续灌胃6周。
1.2.3 24 h尿蛋白定量及血生化指标检测:于灌胃6周末收集各组大鼠24 h尿液,以3500 r/min离心10 min,尿液分析仪检测尿蛋白含量。采用Beckman LX20生化分析仪自动分析血清尿素氮(Blood urea nitrogen,BUN)、血肌酐(Serum creatinine,Scr)水平。
1.2.4 电镜观察肾脏组织病理改变:用3%戊巴比妥钠30 mg/kg腹腔注射麻醉大鼠,摘除其右侧肾脏,将肾脏包膜及周围组织分离去除,用4%多聚甲醛磷酸缓冲液固定,分别以70%、80%、95%、无水乙醇梯度脱水,二甲苯透明,60 ℃浸蜡60 min,迅速包埋,切成5~6 μm的薄片,用抗荧光淬灭封片液封片,电镜下观察肾脏组织病理改变,以上过程均在无菌条件下进行。
1.2.5 RT-PCR法检测肾组织Notch1、TGF-β1、MCP-1 mRNA表达:于-80 ℃冻存管中取2.5 mm×2.5 mm×2.5 mm肾脏组织,经研磨、匀浆提取RNA,紫外分光光度计测定样品中RNA总量。用PCR扩增仪反转录制备cDNA,核酸分析仪分析cDNA浓度,确保纯度良好。引物由美国国立生物技术信息中心提供,Notch1:上游引物5’-AGAGCAGCCTACATTGAGACCT-3’,下游引物5’-CCACATTCCAGCACACTCAAGGCA-3’,长度101 bp;TGF-β1:上游引物5’-ACTACGCCAAAGAAGTCACC-3’,下游引物5’-CACTGCTTCCCGAATGTCT-3’,长度125 bp;MCP-1:上游引物5’-AAACCAGCCAACTCTCACT-3’,下游引物5’-GTAGTTCTCCAGCCGACTC-3’,长度200 bp。退火温度60 ℃,30个循环。PCR产物上样经1.7%琼脂糖凝胶核酸电泳后,用BIO-RAD计算机凝胶成像分析系统、Quantity-one软件进行半定量分析。
1.2.6 免疫组化法检测肾组织Notch1、TGF-β1、MCP-1蛋白表达:石蜡切片常规脱蜡、水化,3%过氧化氢灭活封闭内源性过氧化物酶。将切片放入0.01 mol/L柠檬酸钠缓冲液后,置于微波炉进行微波热修复,以暴露抗原决定簇。3%过氧化物酶封闭液阻断内源性过氧化物酶,滴加3%BSA均匀覆盖组织,室温封闭30 min;滴加一抗,37 ℃ 2 h,4 ℃过夜,37 ℃复温45 min;二抗孵育37 ℃ 30 min;滴加DAB显色液,镜下控制反应时间;苏木素复染,70%~100%酒精梯度脱水,二甲苯Ⅰ、Ⅱ各透明2 min,中性树胶封片。显微镜采集图像,并采用图像分析系统进行分析。

2 结 果
2.1 各组大鼠一般情况比较 造模前,各组大鼠毛发整齐光滑,活动正常,反应灵敏。造模2~3 d后,造模大鼠开始出现毛发凌乱、活动减少,5~6 d后部分大鼠出现便溏、反应迟钝、精神不振,模型组症状明显。对照组和姜黄素低、中、高剂量组大鼠精神状态有所改善,其中姜黄素高剂量组症状改善程度最明显。
2.2 各组大鼠肾功能指标比较 见表1。与空白组比较,模型组24 h尿蛋白定量、BUN、Scr水平显著升高(P<0.05);与模型组比较,对照组、姜黄素各剂量组24 h尿蛋白定量、BUN、Scr水平显著降低(P<0.05);与对照组比较,姜黄素中、高剂量组24 h尿蛋白定量、BUN、Scr水平显著降低(P<0.05),姜黄素低剂量组血肌酐水平显著降低(P<0.05)。

表1 各组大鼠肾功能指标比较
2.3 各组大鼠肾脏组织病理结构比较 空白组大鼠肾脏组织结构未见明显异常,模型组大鼠肾小球中央出现玻璃样小体,周围部分纤维化,肾小管萎缩,间质内小动脉管腔变窄,系膜外基质呈轻、中度增生,淋巴细胞、浆细胞浸润,可见蛋白管型,足细胞损伤较重;姜黄素各剂量组及对照组上述病理改变减轻,其中姜黄素高剂量组减轻最明显(图1)。

表1 各组大鼠肾功能指标比较
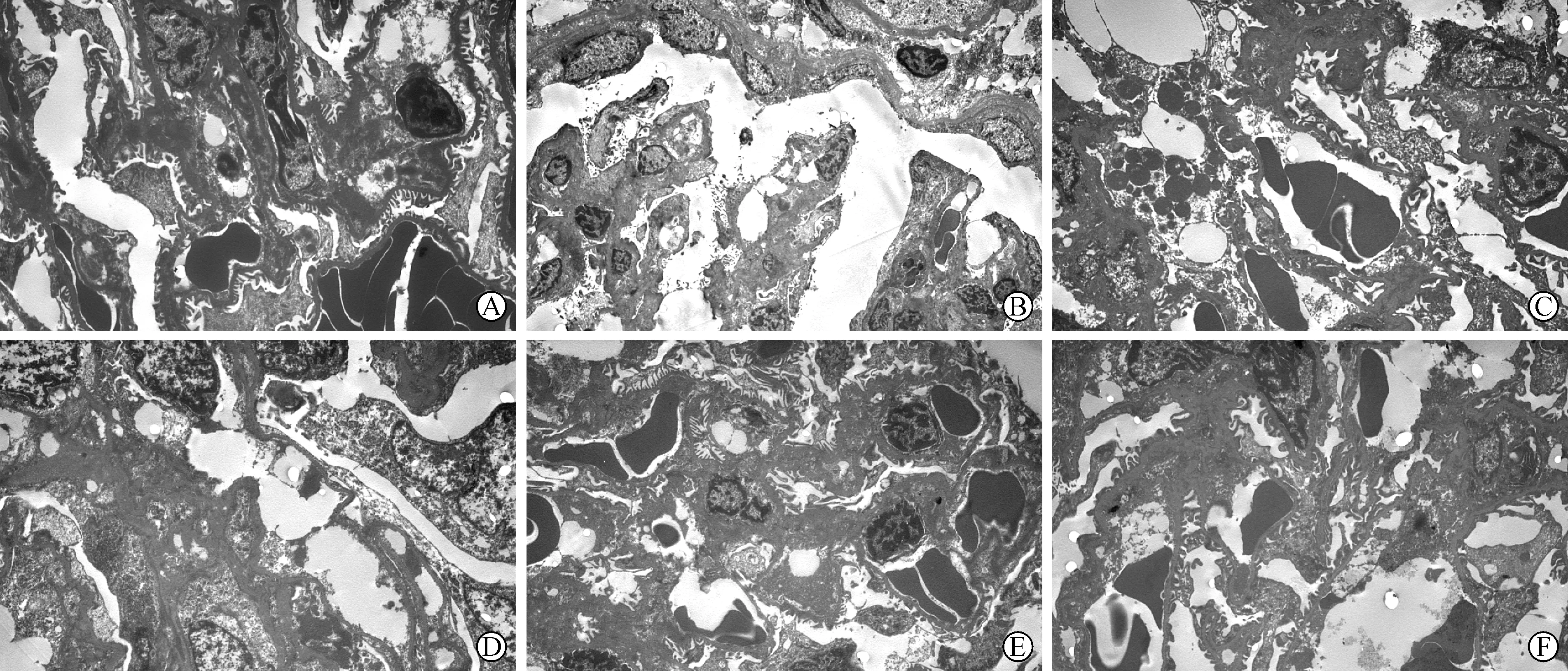
A:空白组;B:模型组;C:对照组;D:姜黄素低剂量组;E:姜黄素中剂量组;F:姜黄素高剂量组
2.4 各组大鼠Notch1、TGF-β1、MCP-1 mRNA表达比较 见表2。与空白组比较,模型组、对照组、姜黄素各剂量组大鼠肾脏组织Notch1、TGF-β1、MCP-1 mRNA表达均升高(P<0.05);与模型组比较,对照组、姜黄素各剂量组大鼠肾脏组织Notch1、TGF-β1、MCP-1 mRNA表达降低(P<0.05),其中姜黄素高剂量组表达最低(P<0.05);与对照组比较,姜黄素高剂量组大鼠肾脏组织Notch1、MCP-1 mRNA表达降低,姜黄素中、低剂量组TGF-β1 mRNA表达降低(P<0.05)。

表2 各组大鼠Notch1、TGF-β1、MCP-1 mRNA表达比较
2.5 各组大鼠Notch1、TGF-β1、MCP-1蛋白表达比较 见表3(图2~4)。正常情况下,Notch1、TGF-β1、MCP-1在肾组织少量表达。空白组Notch1、TGF-β1、MCP-1仅微量表达,几乎不可见,着色极淡;模型组Notch1、TGF-β1、MCP-1呈强阳性表达,表现为黄棕色或淡黄色,着色较重;对照组、姜黄素各剂量组Notch1、TGF-β1、MCP-1表达量介于空白组和模型组之间,姜黄素各剂量组均能有效下调Notch1、TGF-β1、MCP-1表达,其中以姜黄素高剂量组最明显。提示姜黄素可能通过降低Notch 1、TGF-β1、MCP-1表达量起到延缓肾小球硬化的作用。

表3 各组大鼠Notch1、TGF-β1、MCP-1蛋白表达比较
3 讨 论
肾小球硬化是CKD进展至慢性肾衰竭的主要病理基础。有效延缓肾小球硬化,并探讨其发病机制是目前临床医学亟待解决的重要问题之一。肾小球硬化的病因较多,西医病理学认为肾小球硬化是由肾小球基底膜增厚、系膜细胞增殖、足细胞融合等导致,由多种细胞因子和生物活性物质参与,致使肾小球基底膜增厚和细胞外基质过度积聚,最终导致肾小球硬化[14]。
相关研究发现,TGF-β1、MCP-1、Notch1参与了肾小球硬化的发生发展过程。TGF-β1是转化生长因子超家族中的成员,参与多种器官纤维化的过程,是目前公认的诱导纤维化能力最强的生长因子[15],是肾纤维化的主要驱动因子。MCP-1是一种对单核细胞具有趋化和激活活性的细胞因子,已证实MCP-1与多种肾脏疾病关系密切,在感染、缺血、损伤等条件下,肾脏系膜细胞大量分泌释放MCP-1,使炎症细胞活化和积聚,加重肾脏损伤[16]。Notch1是Notch信号通路的同源受体,在维持肾小管上皮细胞功能中发挥重要作用[17]。有研究表明Notch信号通路能调节足细胞分化,特定条件下激活Notch1损伤足细胞损伤[18],而足细胞损伤是肾小球硬化的主要病理过程之一。
肾虚日久,致瘀血阻肾络是肾小球硬化的主要病机[4]。中医药可有效延缓肾小球硬化的进程。本课题组前期初步证实,益肾散结复方及拆方可有效改善肾功能,防治肾小球硬化[19],但复方由多种药物配伍而成,拆方亦由数味功效相似的药物组成,其配伍机制有待进一步研究。因此,课题组进一步开展复方中单味中药的研究。姜黄素为益肾散结复方药物姜黄的提取物,实验通过建立阿霉素大鼠肾病模型,低、中、高剂量姜黄素灌胃治疗后,发现其可减少大鼠24 h尿蛋白定量,降低BUN、Scr水平。同时,肾脏病理结构方面,接受姜黄素治疗后的大鼠肾脏肾小球系膜外基质增生和足细胞损伤程度明显改善,这与课题组前期研究益肾散结复方及拆方可改善阿霉素大鼠肾功能、控制蛋白尿的结论相一致[20]。Notch1、TGF-β1、MCP-1在阿霉素大鼠肾脏组织高表达,说明其参与肾小球硬化的发生发展,姜黄素灌胃后,其表达量显著下降,说明姜黄素可下调其表达以抑制肾小球硬化的进程,且高剂量姜黄素对肾小球硬化的临床疗效优于盐酸贝那普利组。
综上所述,姜黄素可通过下调Notch1、TGF-β1、MCP-1在肾脏组织的表达抑制肾小球基底膜增厚和细胞外基质过度沉积,进而延缓肾小球硬化进程。
