MPTP在七氟烷诱导大鼠海马神经元损伤中的作用及其机制
2022-07-13强婷婷胡宪文
强婷婷,张 丽,胡宪文
七氟烷是儿科手术中使用最广泛的全身麻醉药之一,然而Ing et al[1]研究表明,七氟烷长时间麻醉可造成发育期儿童长期的语言功能缺陷和认知障碍;Zhu et al[2]研究表明,早期七氟烷暴露可导致发育期大鼠广泛的海马神经细胞凋亡,从而造成远期空间学习障碍。但是七氟烷暴露引起神经损伤和认知障碍的具体机制仍不清楚。
研究[3]表明,吸入麻醉药暴露导致的突触发育障碍与线粒体损伤相关。线粒体通透性转换孔(mitochondrial permeability transition pore,MPTP)是线粒体膜上的一个非选择性通道,亲环素D(cyclophilin D,CypD)是MPTP的阳性调节因子,而环孢素A(cyclosporin A,CsA)是MPTP的特异性抑制剂[4]。在阿尔茨海默病动物模型中,CypD的表达增加,MPTP开放增多,而CsA能够下调CypD的表达,抑制MPTP开放,维持线粒体功能稳定进而改善老年小鼠的认知功能[5]。然而,CypD介导的MPTP开放在七氟烷暴露导致发育期大脑神经毒性中的作用尚不清楚。该研究利用原代培养海马神经元建立七氟烷损伤模型,重点研究MPTP及其调节蛋白CypD在七氟烷暴露引起神经毒性中的作用和机制。
1 材料与方法
1.1 材料
1.1.1实验动物 孕(18±1)d SD大鼠由安徽医科大学实验动物中心提供,生产许可证编号:SCXK(皖)2017-001。
1.1.2主要试剂 DMEM/F12培养基、L-丙氨酰-L-谷氨酰胺(Glutamax)、青-链霉素、0.25%胰蛋白酶-EDTA、B-27、Neurobasal培养基购自美国Gibco公司;5-氟-2′脱氧尿苷(FUDR)、多聚-L-赖氨酸(PLL)购自美国Sigma公司;胎牛血清(fetal bovine serum,FBS)购自乌拉圭Lonsera公司;4′,6-二脒基-2-苯基吲哚(DAPI)、免疫印迹(Western blot)一抗稀释液、CCK-8检测试剂盒、TUNEL凋亡试剂盒、MPTP检测试剂盒、线粒体膜电位检测试剂盒购自北京碧云天生物技术公司;Triton X-100购自北京索莱宝科技有限公司;β-actin抗体、突触后致密蛋白95(postsynaptic density protein,PSD-95)抗体、突触蛋白1(Snapsin-1)抗体购自美国CST公司;CypD购自上海Abcam公司;突触素(Snaptophysin)、脑源性神经营养因子(brain-derived neurotrophic facto,BDNF)购自武汉Proteintech公司;辣根过氧化物酶标记山羊抗兔二抗和辣根过氧化物酶标记山羊抗小鼠二抗购自北京中杉金桥生物技术有限公司;ECL显影液购自美国Thermo公司。
1.1.3主要仪器设备 CO2细胞培养箱、多功能酶标仪(美国Thermo公司);倒置相差荧光显微镜(德国蔡司公司);凝胶成像仪(德国耶拿公司);便携式细胞氧环境控制小室(加拿大Stem Cell公司);气体浓度监测仪(深圳迈瑞生物公司);七氟烷挥发罐(德国Drager公司)。
1.2 方法
1.2.1SD大鼠胎鼠海马神经元培养 取孕(18±1)d SD大鼠,七氟烷麻醉孕鼠,75%乙醇消毒孕鼠腹部,然后快速取出胚胎,将胎鼠断头取脑,放入装有预冷的PBS缓冲液的培养皿中,置于解剖显微镜下分离海马组织。用0.25% 胰酶(37 ℃预热)消化海马组织10 min,然后用10% FBS终止消化,1 500 r/min,离心5 min后弃去上清液,再加入适量含10%FBS的DMEM/F12细胞培养液,轻柔吹打1 min,重新悬浮细胞并使之变成单细胞悬液。细胞接种密度调整为2×105~3×105个/ml,放入CO2细胞培养箱培养。培养24 h后,全量换液为Neurobasal细胞维持液,并加入50 μmol/L FUDR。每隔3 d更换1次细胞培养液,换液1/2。将原代培养的海马神经元细胞培养至7 d时,建立七氟烷暴露模型。
1.2.2七氟烷暴露模型的建立及实验分组 原代培养的SD大鼠胎鼠海马神经元随机分为:对照组(Con组)、环孢素A组(CsA组,0.1、0.5、1 μmol/L)、3%七氟烷组(Sevo组)、3%七氟烷+环孢素A处理组(Sevo+CsA组,0.1、0.5、1 μmol/L)。CsA组、Sevo+CsA组细胞在培养至6 d时加入相应浓度的CsA预处理24 h。7 d时,Con组、CsA组放入充满95% 空气+5% CO2的控制小室中,然后置于CO2细胞培养箱处理6 h;Sevo组、Sevo+CsA组放入充满3%七氟烷的控制小室中处理6 h。处理结束后进行后续检测。
1.2.3CCK-8检测细胞活力 将细胞悬液调整浓度后种植于96孔板内,每孔100 μl细胞悬液,约3×104个细胞,每组设6个复孔。造模结束后弃去96孔板中的培养基,重新加入100 μl/孔预热过的Neurobasal细胞维持液。每孔加入10 μl CCK-8溶液,放入37 ℃、5% CO2细胞培养箱中孵育2 h。酶标仪测定450 nm处的吸光度值(OD值)。实验重复4次。
1.2.4TUNEL染色检测细胞凋亡 弃去培养基,加入4%多聚甲醛固定细胞30 min,然后用PBS洗涤1次,再加入0.3% Triton X-100室温通透细胞5 min,用PBS洗涤2次,加50 μl TUNEL检测液,37 ℃避光孵育1 h,孵育结束后用PBS洗涤3次,滴加含DAPI的抗荧光淬灭封片液封片后置于荧光显微镜下观察并拍照,实验重复4次,每次每组选取5个视野计算细胞凋亡比例。
1.2.5Western blot检测 造模结束后弃去培养基,用PBS洗涤1次,加入细胞裂解液后用超声波细胞破碎仪破碎细胞,接着置于4 ℃超速离心机下14 000 r/min离心15 min,留存上清液,按照BCA法测定蛋白浓度,再加入上样缓冲液,煮沸10 min使蛋白充分变性。每个样本取10 μg,配制10% SDS- PAGE分离胶,电泳分离蛋白,250 mA恒流转膜,接着用5%脱脂牛奶封闭2 h,TBST洗涤1次后分别加入配置好的不同的浓度的一抗稀释液于4 ℃摇床上过夜孵育(β-actin 1 ∶10 000、BDNF 1 ∶1 000、PSD-95 1 ∶1 000、Snaptophysin 1 ∶20 000、Snapsin-1 1 ∶1 000、CypD 1 ∶5 000)。一抗孵育结束后用TBST洗涤3次,与辣根过氧化物酶偶联的相应种属的二抗(1 ∶1 000)在室温下孵育1 h,TBST洗涤4次后采用ECL化学发光法检测蛋白表达量。
1.2.6线粒体膜电位检测 线粒体JC-1染色,线粒体膜电位较高时形成聚合物(JC-1 aggregates)产生红色荧光,线粒体膜电位较低时为JC-1单体(JC-1 monomers)产生绿色荧光。原代培养细胞在造模结束后立即吸除培养液,用PBS洗涤细胞1次,然后每孔加入1 ml Neurobasal细胞维持液,再加入1 ml JC-1染色工作液,轻轻混匀后放入细胞培养箱中育20 min,孵育结束后吸除上清液,用预冷的JC-1染色缓冲液洗涤2次,每孔加入2 ml细胞培养液后立即在荧光显微镜下观察,1 h内观察完毕,实验重复4次。
1.2.7MPTP开放程度检测 造模结束后吸除培养液,用PBS洗涤1次,后加入适当体积的钙黄绿素乙酰甲酯(Calcein AM)染色液,轻轻晃动使之混匀,放入培养箱中避光孵育40 min,孵育结束后更换成新鲜的37 ℃预热的Neurobasal细胞维持液,然后再次避光孵育40 min,用PBS清洗3次,滴加DAPI后于荧光显微镜下观察、拍照,实验重复4次。

2 结果
2.1 七氟烷对原代海马神经细胞活力的影响检测结果显示,与Con组相比,Sevo组的细胞活力下降(F=12.81,P<0.05);与Con组相比,CsA组用不同浓度的CsA(0.1、0.5、1 μmol/L)预处理24 h对细胞活力的影响差异无统计学意义;与Sevo组相比,Sevo+CsA(0.1、0.5、1 μmol/L)组可以降低七氟烷对细胞的损伤作用,其中CsA 的浓度为0.1 μmol/L时细胞活力最高(F=23.15,P<0.01)。因此,该研究选择0.1 μmol/L CsA进行后续实验。见图1。
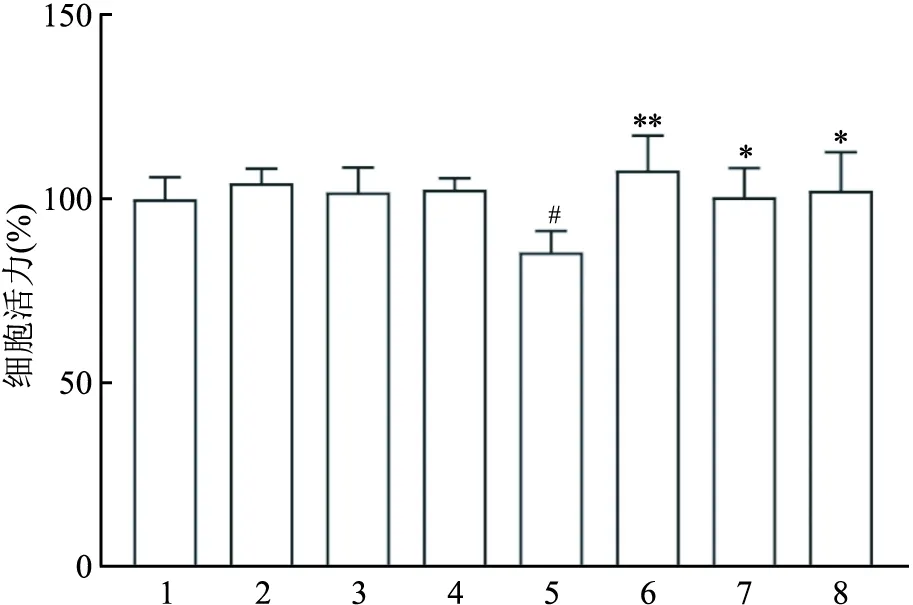
图1 不同浓度CsA对原代海马神经细胞活力的影响
2.2 七氟烷对原代海马神经细胞凋亡的影响与Con组相比,Sevo组细胞TUNEL阳性细胞比例增高,表明七氟烷持续暴露6 h可诱导细胞凋亡(F=35.51,P<0.01);与Sevo组相比,Sevo+0.1 μmol/L CsA预处理可以降低七氟烷持续暴露造成的高细胞凋亡率(F=26.61,P<0.01)。见图2。
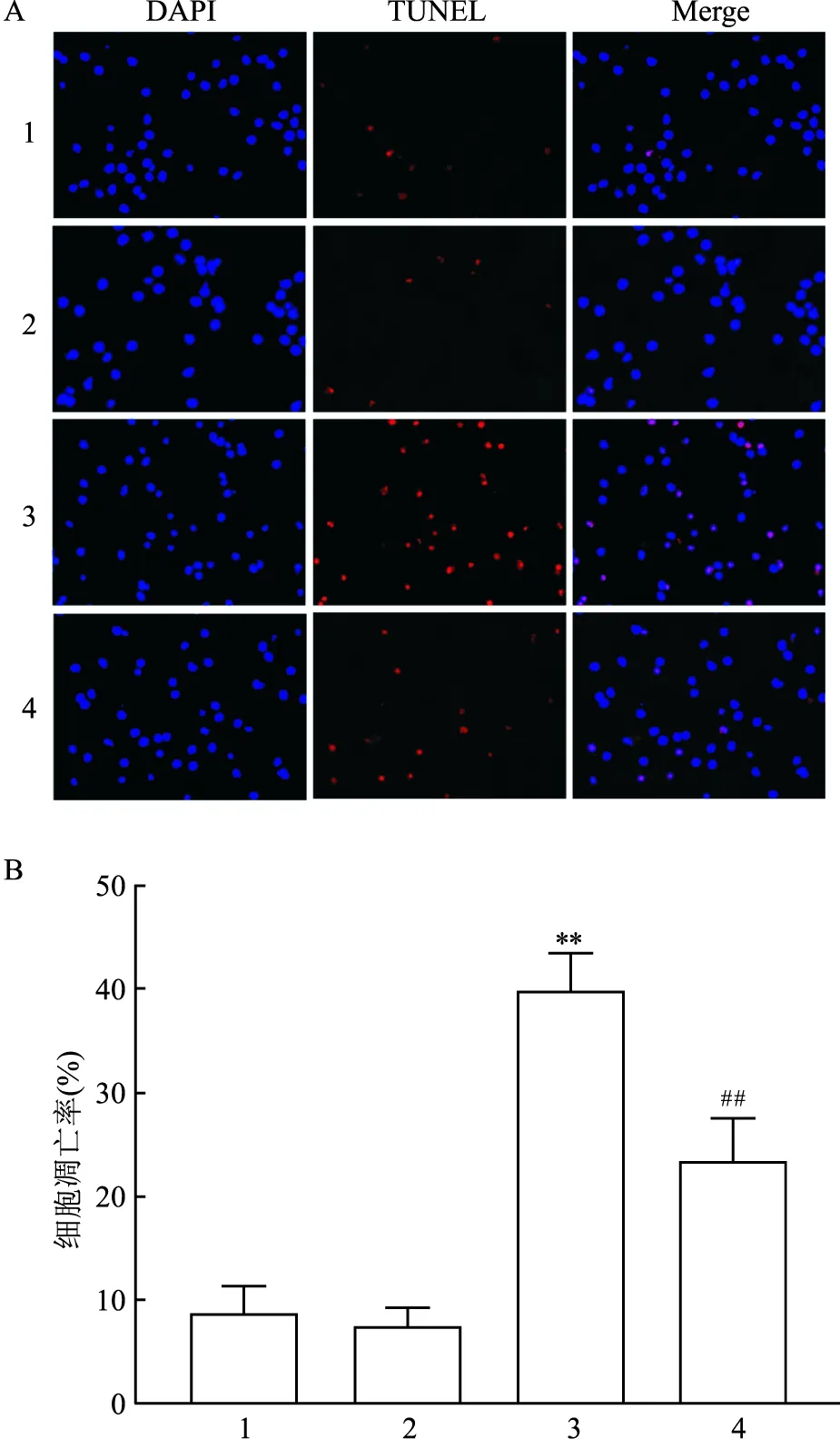
图2 TUNEL染色检测细胞凋亡
2.3 七氟烷对BDNF及突触蛋白表达的影响与Con组相比,Sevo组BDNF、Snaptophysin、Snapsin-1、PSD-95等突触相关蛋白的表达量下降(F=13.57、14.63、17.90、16.21,P<0.05);与Sevo组相比,Sevo+CsA组BDNF、Snaptophysin、Snapsin-1、PSD-95表达上调(F=10.98、12.79、13.77、14.05,P<0.05)。见图3。
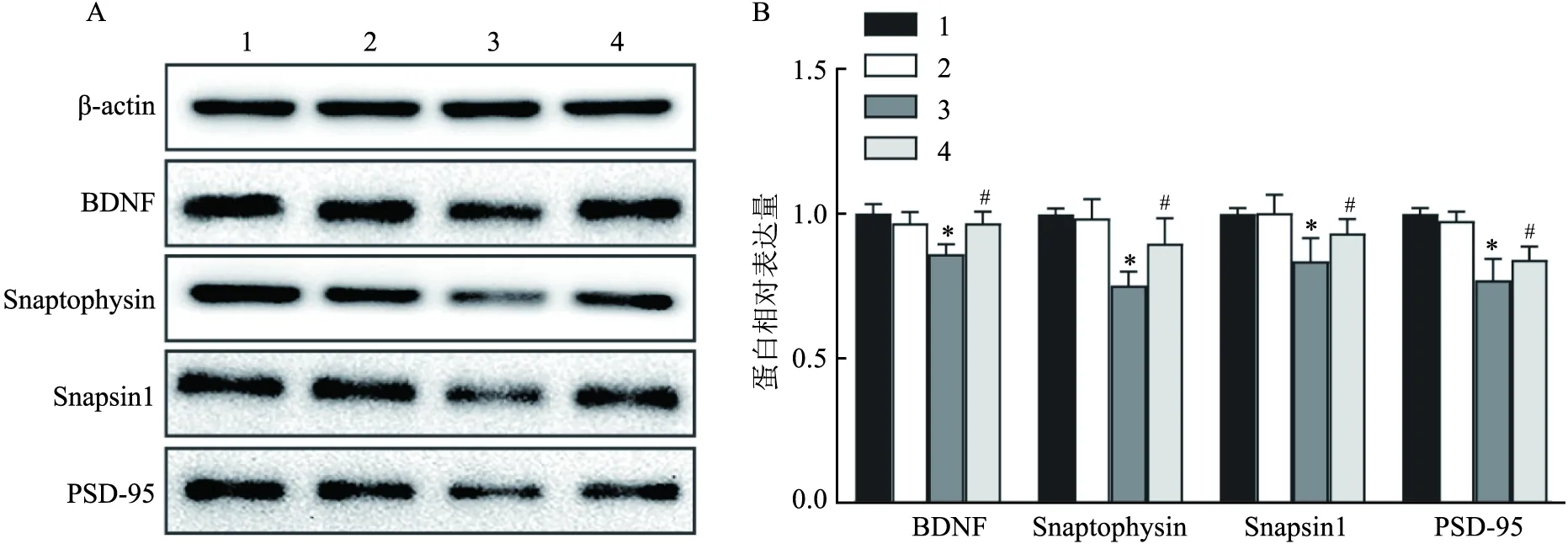
图3 BDNF及突触蛋白表达量
2.4 七氟烷对神经元线粒体膜电位的影响与Con组相比,原代海马神经细胞经七氟烷处理后,JC-1聚合物荧光强度与JC-1单体荧光强度的比值降低,表明线粒体膜电位下降(F=29.74,P<0.01);与Sevo组相比,CsA可以减轻七氟烷引起的线粒体膜电位的降低(F=16.84,P<0.05)。见图4。
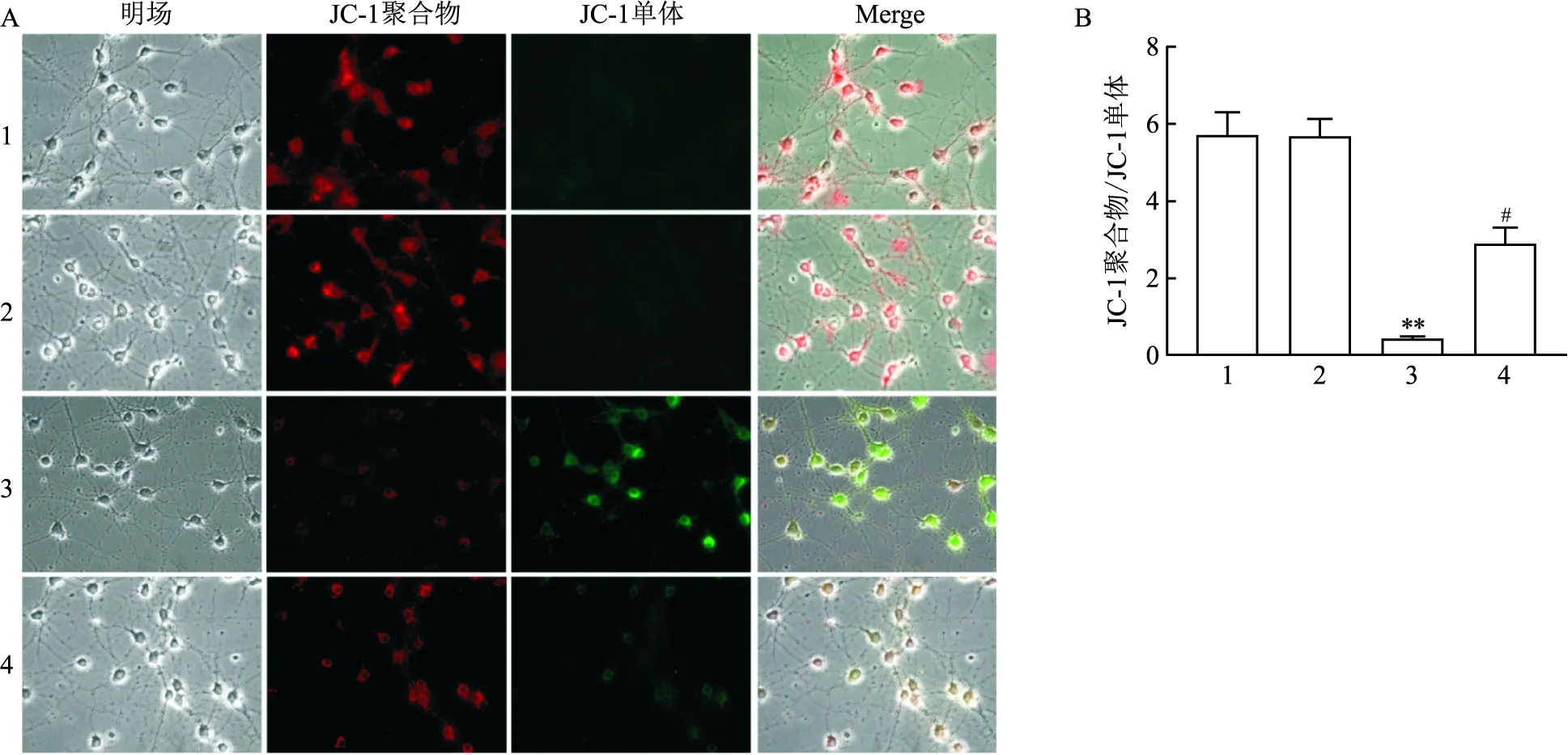
图4 线粒体膜电位
2.5 七氟烷对神经元MPTP开放的影响与Con组相比,Sevo组线粒体上面的荧光强度有所降低,表明MPTP通道开放致使线粒体荧光发生淬灭(F=27.46,P<0.01);与Sevo组相比,Sevo+CsA组的线粒体荧光强度增高(F=15.05,P<0.01),提示MPTP的开放程度减低。见图5。

图5 MPTP开放程度
2.6 七氟烷对CypD蛋白表达的影响与Con组相比,Sevo组CypD蛋白的表达上调(F=18.17,P<0.01);与Sevo组相比,Sevo+CsA组CypD蛋白的表达下降(F=16.69,P<0.01)。见图6。

图6 CypD蛋白表达量
3 讨论
七氟烷暴露对发育期大脑具有一定的神经毒性[1,6]。但其具体机制目前仍不清楚。3%是儿科手术中使用七氟烷维持麻醉深度的常用浓度[5],该研究将原代培养的SD大鼠海马神经元暴露于3%七氟烷6 h,观察其神经细胞凋亡、突触蛋白表达、线粒体功能等指标的变化,以探讨MPTP及其阳性调节蛋白CypD在七氟烷暴露导致发育期神经细胞损伤中的分子机制。
该研究检测3%七氟烷暴露6 h后的海马神经细胞的活性,结果显示神经细胞活力下降;利用TUNEL染色法检测神经元凋亡,结果显示七氟烷暴露6 h后神经细胞凋亡率增加。表明该研究已成功构建了七氟烷细胞损伤模型。
除了七氟烷暴露会引起广泛的海马神经细胞凋亡之外[7],Ju et al[8]研究表明七氟烷暴露会导致啮齿动物远期认知功能障碍,其机制与七氟烷抑制神经元突触可塑性密切相关。神经元发育至第7~10天是突触生长的关键阶段[9],因此该实验选择在神经元培养至第7天时检测影响突触功能的相关蛋白质的表达含量。BDNF是影响神经元的生长、发育、分化和存活的重要神经营养因子,成熟的BDNF能够结合并激活TrkB信号传导通路,参与突触可塑性的调节[10]。Snaptophysin、Snapsin-1分布在神经元突触前膜中突触囊泡中,影响突触前可塑性,而PSD-95位于突触后致密区,影响突触后可塑性[11]。该研究中,培养的神经元在七氟烷暴露6 h后BDNF、Snaptophysin、Snapsin-1、PSD-95表达下调,提示七氟烷对海马神经元的突触前、突触后可塑性均有抑制作用。
线粒体是维持能量平衡的重要细胞器,参与细胞凋亡、突触发育和突触可塑性的调节。Yang et al[12]研究表明抑制线粒体膜电位的下降可以降低细胞凋亡发生率。在突触形成关键期进行吸入麻醉药暴露可引起线粒体融合和分裂失衡,造成氧自由基过量生成,诱发新生突触的能量代谢障碍,最终对树突棘以及突触的形成、稳定和正常功能造成损害[13]。线粒体功能异常可能是七氟烷麻醉引起神经细胞凋亡和突触受损的共同靶点。该研究中七氟烷暴露使线粒体JC-1发生从红色荧光到绿色荧光的转变,表明线粒体膜电位下降,线粒体功能受损。
Bernardi et al[14]在心肌缺血再灌注模型中证明了MPTP的正常开闭在维持线粒体功能稳定中发挥至关重要作用。MPTP开放有两种状态,生理性(低电导)MPTP开放可以维持线粒体功能,而病理性(高电导)MPTP开放则会造成线粒体膜电位崩溃、线粒体肿胀和线粒体外膜破裂,随之释放膜间线粒体促凋亡蛋白,包括细胞色素C和凋亡诱导因子等,这些物质进入胞质后引发细胞凋亡。MPTP主要由电压依赖性阴离子通道(VDAC)、腺嘌呤核苷酸转位酶(ANT)以及CypD构成。而ANT和VDAC基因敲除(KO)动物/细胞模型的研究[15-16]表明VDAC、ANT不参与MPTP开放的调节,CypD是调节MPTP开放的主要调控因子。该研究显示,与对照组相比,七氟烷处理细胞后,线粒体内绿色荧光发生淬灭,表明MPTP开放增多,同时MPTP调节因子CypD的表达增加。
中风、创伤性脑损伤和阿尔茨海默病等动物模型的研究表明低浓度的CsA具有神经保护作用[5,7],而高浓度的CsA可能造成肝肾功能受损和神经系统的不良反应[17]。该研究检测了不同浓度的CsA对原代培养海马神经元的影响,结果表明最低浓度0.1 μmol/L CsA的保护效果相对较好。运用0.1 μmol/L CsA处理细胞可以适当恢复细胞活力,降低细胞凋亡率,增加突触相关蛋白的表达,维持细胞膜电位稳定,下调CypD蛋白表达。
综上所述,细胞凋亡增加、突触可塑性降低及线粒体功能损伤参与七氟烷引起神经毒性的过程,其机制可能与促进MPTP开放,上调CypD表达有关。CsA能够通过抑制MPTP开放发挥神经保护作用,有可能为预防七氟烷暴露导致神经损伤提供一种新的保护思路。
