miR-1180基因沉默介导Wnt通路增强人结肠癌耐药细胞株THC8307/L-OHP化疗的敏感性
2022-07-12苍宏宇郝灵芳梁润
苍宏宇,郝灵芳,梁润
结肠癌是世界范围内最为常见的恶性肿瘤之一,据国际癌症研究机构发布的最新癌症数据显示,结肠癌发病率仅次于乳腺癌和肺癌居第3位,死亡率仅次于肺癌居第2位[1]。对于中晚期结肠癌患者多采用手术结合放化疗为主的综合治疗方案,奥沙利铂(L-OHP)是目前临床常用的铂类化疗药物,但长期使用易导致患者产生化疗耐药性,严重影响化疗效果[2]。因此探讨结肠癌化疗耐药性的形成机制并寻求有效提高肿瘤化疗敏感性的方法有重要意义。Wnt信号通路是调控细胞增殖分化的关键通路,Wnt的异常激活与多种恶性肿瘤的发生发展有密切关系[3]。β-连环蛋白(β-catenin)是Wnt通路的关键基因,Wnt可通过活化β-catenin促进其下游的细胞周期蛋白D1(CyclinD1)、多药耐药基因1(MDR1)等靶基因的表达,上述过程在多种肿瘤细胞的发生转移和化疗耐药中发挥促进作用[4-5]。微小核糖核酸-1180(miR-1180)是近几年新发现的一种小分子非编码RNA,异常表达于多种恶性肿瘤,呈现一定的肿瘤特异性。例如,miR-1180在卵巢癌和肝癌中表达上调发挥促癌作用[6-7],但在肾癌和胰腺癌中却呈低水平表达,发挥抑癌作用[8-9]。有研究发现,miR-1180还可以通过调节Wnt信号通路促进卵巢癌细胞的增殖和糖酵解[10],但其对结肠癌化疗敏感性的作用尚无相关报道。因此,本研究通过体外实验观察miR-1180基因沉默介导Wnt通路增强人结肠癌耐药细胞株THC8307/L-OHP化疗敏感性的作用。
1 材料与方法
1.1 材料
1.1.1 细胞
人结肠癌耐药细胞株THC8307/L-OHP(武汉普诺赛生命科技有限公司,生产批号CL-0118)。
1.1.2 药物与试剂
L-OHP(湖北齐飞医药化工有限公司,生产批号为QF2006);二甲基亚砜(DMSO)(上海源叶生物科技有限公司,生产批号为S24295);噻唑蓝(MTT)(上海脉铂医药科技有限公司,生产批号MED17868);Annexin V-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒(北京百奥莱博科技有限公司,生产批号KFS186);Trizol试剂盒(美国Thermo Fisher公司,生产批号15596-018);2,2′-联喹啉-4,4′-二甲酸二钠(BCA)蛋白定量试剂盒(北京索莱宝科技有限公司,生产批号PC0022);兔抗人Wnt、β-catenin、CyclinD1、MDR1、抗凋亡因子(Bcl-2)、甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体(武汉三鹰生物技术有限公司,生产批号MA5-15511、MA5-15046、701857、39-0300、PA1-9118、PA5-19149);山羊抗兔Wnt、β-catenin、CyclinD1、MDR1、Bcl-2、GAPDH多克隆抗体(武汉三鹰生物技术有限公司,生产批号MA5-11757、13-8800、MA1-26233、14-1028-82、MA5-15046、PA5-34316);双荧光素酶报告载体Wnt-WT和Wnt-Mut均由上海吉玛制药技术有限公司构建;miR-1180 inhibitor、NC inhibitor均由宝生物工程(大连)有限公司设计合成。
1.1.3 实验仪器
BOI-50型恒温培养箱(上海三腾仪器有限公司);NSOM型普通光学显微镜(以色列Nanonics公司);QLS-scope型荧光显微镜(西班牙Planelight公司);SuPerMax 3000FA型多功能酶标仪(上海闪谱生物科技有限公司);CMVC U-M型超低温高速离心机(德国CMVC公司);Northern Lights 1L-3L型流式细胞仪(美国Cytek Biosciences公司);CG-05型荧光定量聚合酶链反应(PCR)仪[力新仪器(上海)有限公司];Capel-105M型电泳仪(加拿大LUMEX公司);TY-201-01型M-Blot快速转膜仪(南京中科通仪科技有限公司);Biosens 850型凝胶成像系统(上海山富科学仪器有限公司)。
1.2 方法
1.2.1 细胞培养、传代和分组
将人结肠癌耐药细胞株THC8307/L-OHP以含10%胎牛血清、100 U/mL青霉素和链霉素的DMEM培养基培养,于37 ℃、5% CO2的恒温培养箱中进行常规培养。取对数生长期的THC8307/L-OHP细胞,按1.0×105个/孔接种于96孔板。采用脂质体转染法将miR-1180 inhibitor(正义链序列5′-CCAGUACGAUUAGCGAU-3′,反义链序列5′-UGAAGUCGGA-UGACGC-3′)、NC inhibitor(正义链序列5′-AAGUCCGUAGA-UCCUGC-3′,反义链序列5′-AAUGCCAAGCCGUAGC-3′)慢病毒载体分别转染THC8307/L-OHP细胞并记为沉默组和对照组,另取未转染细胞记为空白组,每组6个复孔。转染48 h后,分别在普通光学显微镜和荧光显微镜下拍照计数,计算沉默组和对照组细胞转染效率,转染效率=(荧光镜下发光细胞数/光镜下细胞数)×100%。
1.2.2 MTT法检测各组细胞活力和对L-OHP的半数抑制浓度(IC50)
将各组细胞以1.0×104个/孔接种至96孔板,分别在细胞培养液中加入0、3.13、6.25、12.5、25、50 μmol/mL的L-OHP作用48 h。每孔加入20 μL的MTT溶液,37 ℃条件下在培养箱中孵育4 h。吸去培养液,加入150 μL的DMSO,继续孵育10 min。用酶标仪在490 nm波长处检测各孔光密度(OD)值,以此代表细胞活力,用SPSS 25.0软件计算各组细胞的半数抑制浓度(IC50,μg/mL)。
1.2.3 流式细胞术检测各组细胞凋亡率
分别取各组细胞加入胰蛋白酶进行消化处理,以1×106个/孔接种至96孔板中,磷酸盐缓冲液(PBS)冲洗,1000 rpm(离心半径6 cm)离心5 min,用提前预冷的75%的酒精固定细胞2 h,PBS再次冲洗细胞,离心弃上清,加缓冲液重悬细胞。加入5 μL的细胞染色剂Annexin Ⅴ-FITC和2 μL的PI原液混匀,避光孵育15 min,上流式细胞仪检测,FlowJo软件分析计算细胞凋亡率。
1.2.4 实时定量聚合酶链反应(RT-qPCR)检测各组细胞miR-1180表达及Wnt、β-catenin、CyclinD1、MDR1、Bcl-2信使核糖核酸(mRNA)表达
Trizol法提取其各目的基因的总RNA,逆转录合成互补脱氧核糖核酸(cDNA),以cDNA为模板进行PCR扩增。引物由宝生物工程(大连)有限公司设计合成,其中miR-1180上游引物5′-TAGGTACGTACAGTACA-3′,下游引物5′-CCGTAGTACGATCA-3′,产物长度188 bp;Wnt上游引物5′-CTGGATCAGTACGC-3′,下游引物5′-GATGTAACGTACGAT-3′,产物长度193 bp;β-catenin上游引物5′-AACTGAGG-TAGCCGCA-3′,下游引物5′-TGTTGACCTAGCAGC-3′,产物长度204 bp;CyclinD1上游引物5′-GCCGATAGCTAGCAAC-3′,下游引物5′-TTGCCAAGTACCCGTAA-3′,产物长度179 bp;MDR1上游引物5′-AATGCTCGATCGCCCAG-3′,下游引物5′-CCGTATTCGCAACGATAC-3′,产物长度215 bp;Bcl-2上游引物5′-TAAGTCCGTAAGCTAGATC-3′,下游引物5′-AATCGCT-AGTCGATACCGG-3′,产物长度162 bp;U6上游引物5′-GAATGCTCGTACCTAG-3′,下游引物5′-ATGTGTACCGATCA-3′,产物长度133 bp;GAPDH上游引物5′-CAGGTCGCTAGAT-CGCTAACC-3′,下游引物5′-AAGCTCGTACGAGGCGT-3′,产物长度281 bp。反应体系:2 μL cDNA,上下游引物各0.5 μL,2.5 μL 10×PCR Buffer,2.5 μL三磷酸碱基脱氧核苷酸(dNTPs),加入超纯无酶双蒸水至25 μL,反应条件:94 ℃预变性30 s、变性94 ℃ 5 s、退火及延伸72 ℃ 1 min。共计40个循环。miR-1180以U6为内参,Wnt、β-catenin、CyclinD1、MDR1、Bcl-2以GAPDH为内参,采用2-ΔΔCt法计算miR-1180表达及各基因mRNA的相对表达量,其中ΔCt=Ct平均值(目的基因)-Ct平均值(内参基因),ΔΔCt=ΔCt(实验组)-ΔCt(对照组)。
1.2.5 蛋白质免疫印迹法(WB)检测各组细胞Wnt、β-catenin、CyclinD1、MDR1、Bcl-2蛋白表达
分别取各组细胞1×107个,加入500 μL预冷的PBS冲洗3次,冰浴60 min。加入放射免疫沉淀法(RIPA)裂解液裂解细胞30 min,弃上清液,加入等体积蛋白上样缓冲液,100 ℃加热10 min使蛋白质充分变性。以20 μg/孔样品液加样于加样孔内,电泳分离,分离蛋白转移法将胶转到聚偏氟乙烯(PVDF)膜上,用5%脱脂奶粉封闭1 h,加入兔抗人Wnt、β-catenin、CyclinD1、MDR1、Bcl-2、GAPDH单克隆抗体(稀释倍数为1∶1000),4℃孵育过夜。次日加入对应的山羊抗兔Wnt、β-catenin、CyclinD1、MDR1、Bcl-2、GAPDH多克隆抗体(稀释倍数为1∶2000),室温下孵育30 min,电化学发光液进行曝光显影,Biosens 850型凝胶成像系统分析处理,以目标蛋白与GAPDH灰度值的比值代表目标蛋白的相对表达水平。
1.2.6 双荧光素酶活性实验验证miR-1180靶向调控Wnt
采用TargetScan靶基因预测软件预测miR-1180的靶基因。将双荧光素酶报告载体Wnt-WT、Wnt-MuT与miR-1180 mimics、miR-NC共转染THC8307/L-OHP细胞。根据双荧光素酶报告基因检测试剂盒说明书的操作步骤检测miR-1180 mimics组和miR-NC组中Wnt荧光素酶相对活性,以萤火虫荧光素酶活性与海肾荧光素酶活性的比值为荧光素酶相对活性。
1.3 统计学分析

2 结果
2.1 转染效率比较
对照组和沉默组转染效率分别为(93.51±1.89)%、(94.09±2.26)%,均在90%以上,见图1。

图1 转染效率图(×200)
2.2 MTT法检测各组细胞活力和IC50值
在同一浓度下,与空白组和对照组比,沉默组细胞活力下降,差异均有统计学意义(P<0.05);各组细胞活力均随L-OHP浓度的升高而降低,差异有统计学意义(P<0.05),且空白组和对照组在不同L-OHP浓度下细胞活力差异无统计学意义(P>0.05),见图2。空白组、对照组和沉默组细胞的IC50值分别为(22.59.06±4.12)μmol/L、(23.05±4.18)μmol/L和(7.74±1.40)μmol/L,与空白组和对照组比,沉默组IC50值降低,差异有统计学意义(P<0.05),且空白组和对照组IC50值差异无统计学意义(P>0.05)。
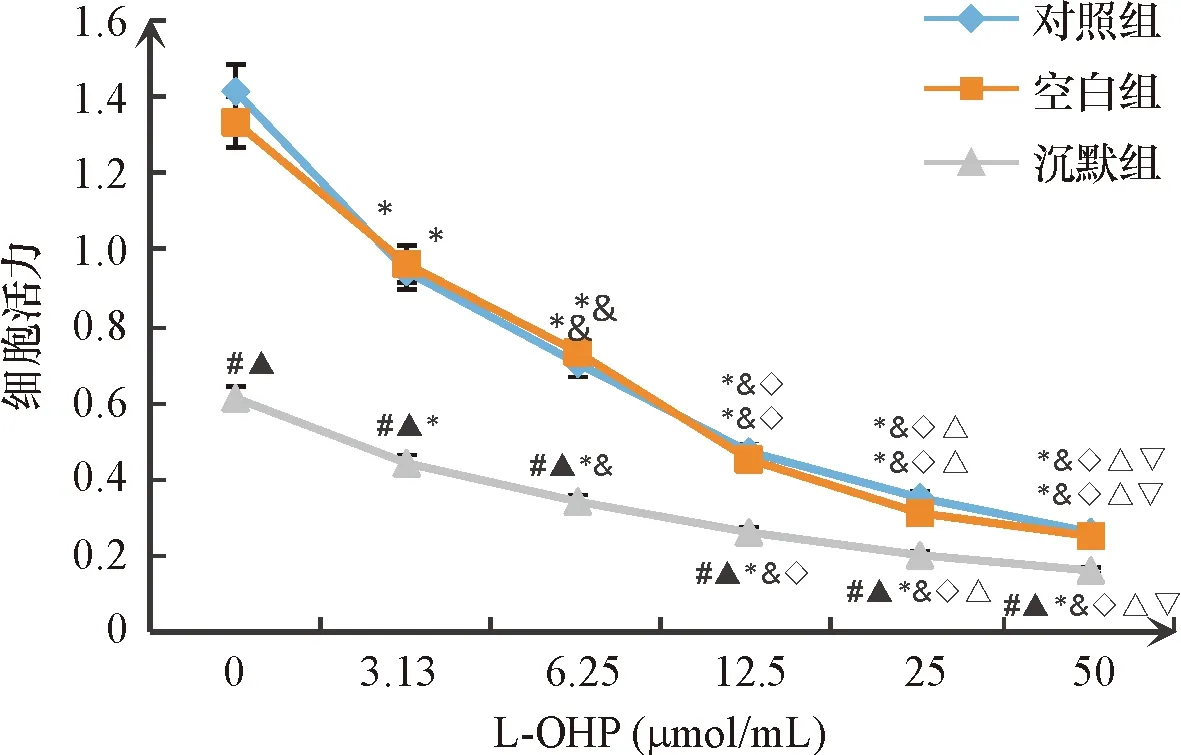
图2 各组细胞活力图 与空白组比,#P<0.05,与对照组比▲P<0.05;与本组0 μmol/mL L-OHP比,*P<0.05;与本组3.13 μmol/mL L-OHP比,&P<0.05;与本组6.25 μmol/mL L-OHP比,◇P<0.05;与本组12.5 μmol/mL L-OHP比,△P<0.05,与本组25 mol/mL L-OHP比,▽P<0.05
2.3 流式细胞术检测各组细胞凋亡率
空白组、对照组和沉默组细胞凋亡率分别为(15.52±2.89)%、(17.74±3.05)%和(45.48±8.44)%,与空白组和对照组比,沉默组细胞凋亡率升高,差异有统计学意义(P<0.05),且空白组和对照组细胞凋亡率差异无统计学意义(P>0.05),见图3。
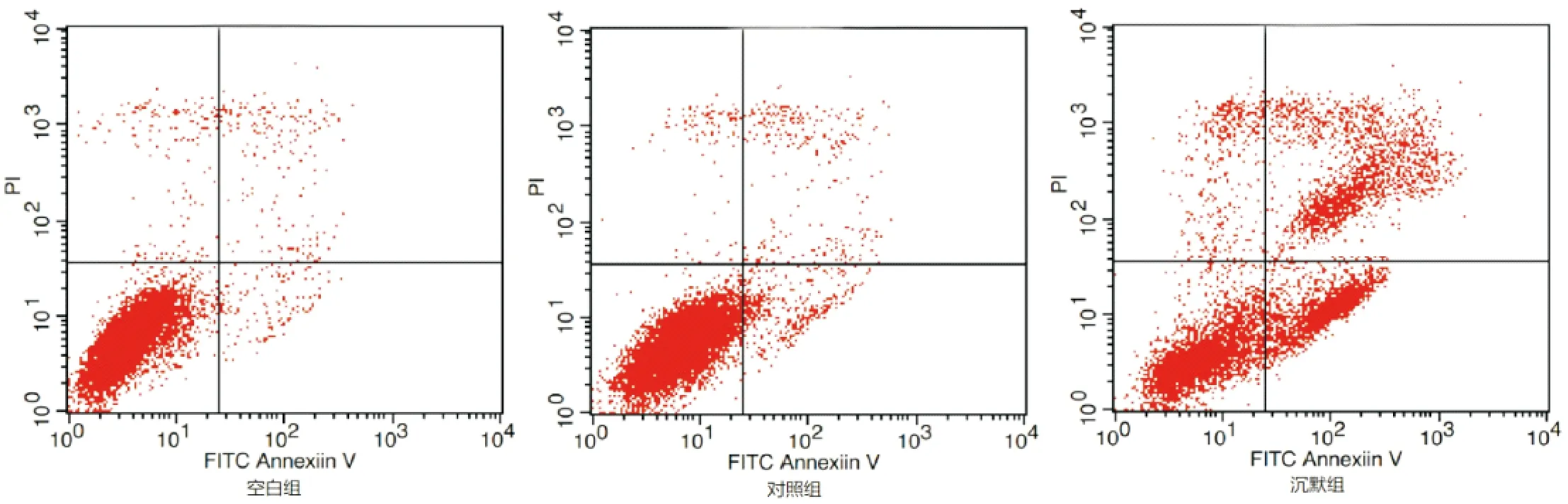
图3 各组细胞凋亡率检测(流式细胞术)
2.4 RT-qPCR检测各组细胞miR-1180表达及Wnt、β-catenin、CyclinD1、MDR1、Bcl-2mRNA表达
与空白组和对照组比,沉默组miR-1180表达及Wnt、β-catenin、CyclinD1、MDR1、Bcl-2mRNA表达均降低,差异均有统计学意义(P<0.05),空白组和对照组上述差异均无统计学意义(P>0.05),见表1。
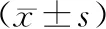
表1 各组细胞miR-1180表达及Wnt、β-catenin、CyclinD1、MDR1、Bcl-2 mRNA表达
2.5 WB检测各组细胞Wnt、β-catenin、CyclinD1、MDR1、Bcl-2蛋白表达
与空白组和对照组比,沉默组Wnt、β-catenin、CyclinD1、MDR1、Bcl-2蛋白表达均降低,差异均有统计学意义(P<0.05),空白组和对照组上述差异均无统计学意义(P>0.05),见图4,表2。
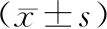
表2 各组细胞Wnt、β-catenin、CyclinD1、MDR1、Bcl-2蛋白表达
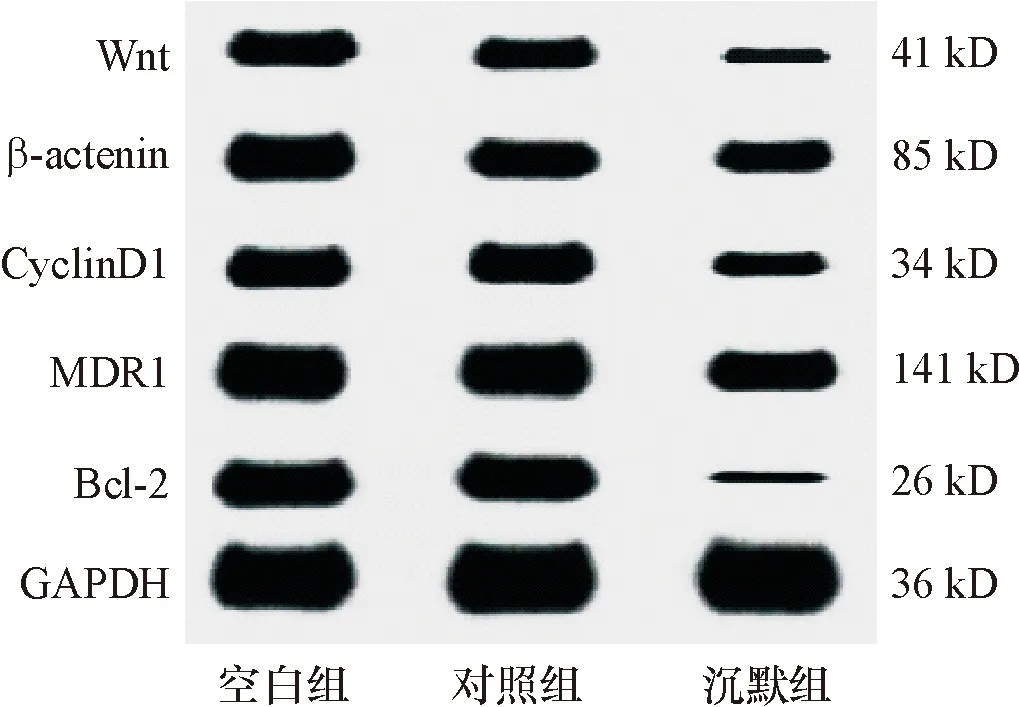
图4 各组细胞Wnt、β-catenin、CyclinD1、MDR1、Bcl-2蛋白表达
2.6 双荧光素酶活性实验验证miR-1180靶向调控Wnt
经TargetScan数据库分析发现,Wnt的3′UTR序列中含有miR-1180的结合位点,表明Wnt可能是miR-1180的靶基因。在转染Wnt-WT细胞中,miR-1180 mimic组细胞荧光素酶相对活性低于miR-NC组细胞,差异有统计学意义(P<0.05);在转染Wnt-Mut细胞中,miR-1180 mimic组与miR-NC组细胞荧光素酶相对活性差异无统计学意义(P>0.05),见图5。

图5 miR-1180靶基因预测及荧光素酶相对活性检测 (与miR-NC组比,*P<0.05)
3 讨论
结肠癌的确切发病原因尚未完全阐明,目前已知的与结肠癌发病有关的因素有遗传、饮食、环境、生活习惯等[11]。对于早中期患者临床上多采用手术切除治疗,而对于晚期结肠癌患者则主要以化疗为主,但是化疗耐药性的产生使得部分患者疗效有限[12-13]。因此,了解化疗耐药性的发生机制并提高化疗敏感性已成为近些年的研究热点。
L-OHP是第3代铂类化疗药物,在安全性和抗肿瘤效果等方面均较顺铂有较大提升,是消化道肿瘤治疗的常用药物[14]。L-OHP主要是通过抑制肿瘤细胞增殖,促进肿瘤细胞凋亡发挥抗肿瘤作用,但耐药性的产生严重影响了化疗效果[15]。miRNAs是内源性短链非编码RNAs,通过结合目标mRNA参与转录后基因调控[16]。近年来研究发现[17],miRNAs与肿瘤化疗敏感性密切相关。Pandey等[18]报道指出,miRNAs可通过靶向调控耐药基因的表达提高肿瘤细胞的化疗敏感性,逆转化疗耐药并诱导肿瘤细胞凋亡。miR-1180是近年来新发现的一种与多种恶性肿瘤的发生发展关系密切的多功能miRNA,在不同的恶性肿瘤中发挥不同作用。本研究结果显示,空白组和对照组细胞转染效率均在90%以上,与空白组和对照组比,沉默组细胞活力及IC50值降低,而凋亡率升高,说明已成功转染THC8307/L-OHP,从而抑制了miR-1180的表达,导致细胞活力IC50值降低,细胞凋亡率提高,化疗敏感性增强。有报道显示[19],下调miR-1180的表达可通过调控细胞周期促进胃癌细胞凋亡,并抑制其增殖活力,本研究结果与该报道相一致。
本研究中,与空白组和对照组比,沉默组Wnt、β-catenin、CyclinD1、MDR1、Bcl-2mRNA及蛋白表达均降低,说明miR-1180基因沉默可抑制THC8307/L-OHP 细胞株Wnt通路及其下游基因的表达。双荧光素酶实验结果证实了miR-1180可靶向调控Wnt,因此推测miR-1180可能是通过靶向调控Wnt的表达增强了THC8307/L-OHP细胞株化疗敏感性的。Wnt信号通路是广泛存在于生物体内的一条经典癌症相关调控通路,异常激活的Wnt信号通路已被证实有助于癌症的发生、复发转移和化疗耐药[20-21]。β-catenin是细胞间黏附连接的重要组分,是Wnt信号通路的调节中心,在Wnt激活后作为转录激活因子进入细胞核启动下游靶基因的转录表达[22]。Bcl-2基因是Bcl基因家族的主要成员,作为一种抗凋亡因子抑制多种组织细胞凋亡。近年来发现,Bcl-2基因及其蛋白有着更加广泛的功能,其过表达不但参与细胞增殖和的凋亡调控,而且在肿瘤的多药耐药中也发挥着至关重要的作用[23]。以往研究显示[24],Wnt可通过激活β-catenin并促进其下游的CyclinD1、多药耐药基因MDR1、抗凋亡因子Bcl-2等靶基因的表达,促进肿瘤细胞增殖、抗凋亡和转移,从而促进化疗耐药产生。有报告指出[25],来自骨髓间充质干细胞的miR-1180能够通过上调Wnt信号通路的表达,激活转录因子β-catenin进入细胞核,并促进CyclinD1、MDR1、Bcl-2的表达,增强卵巢癌细胞的化疗耐药性,进一步佐证了本研究的猜想。
综上所述,miR-1180基因沉默可能是通过靶向Wnt信号通路,抑制Wnt、β-catenin、CyclinD1、MDR1、Bcl-2的表达,增强THC8307/L-OHP细胞株的化疗敏感性。本研究进一步阐释了miR-1180基因沉默对人结肠癌耐药细胞株化疗敏感性的作用及机制,为结肠癌的靶向治疗提供了新的思路。
