铁饱和度对乳铁蛋白抑菌活性的影响
2022-07-12王振杰张康梁莉熊晴晴杜华华
王振杰,张康,梁莉,熊晴晴,杜华华
(浙江大学饲料科学研究所,浙江省饲料与动物营养重点实验室,杭州 310058)
铁不仅是动物体内重要的营养物质,而且是病原微生物生长繁殖的必需营养素。在生猪养殖过程中,由于出生时仔猪体内铁的贮备量少、母猪乳汁中铁含量低和快速生长需要铁量较多等矛盾易引起仔猪的缺铁症,所以给初生仔猪补铁是被普遍认可和接受的缺铁症预防或治疗手段。然而,在感染情况下,补铁却引起了断奶仔猪的肠道菌群紊乱,加重了仔猪的腹泻病情,给养猪业造成了更大的经济损失[1]。
铁稳态平衡是动物机体健康的保证。在哺乳动物中,超过70%的铁以血红蛋白的形式储存在红细胞中,其余的铁则储存在巨噬细胞和肝脏中。铁在体内主要以结合态存在,其主要储存形式包括铁蛋白、含血红素的蛋白质(如细胞色素)、含铁硫簇的蛋白质(如琥珀酸脱氢酶)和其他含铁蛋白质(如2-氧戊二酸依赖性双加氧酶)[2]。健康动物机体在铁调素(hepcidin)的调节下能维持铁的稳态,但这种稳态可以被细菌或病毒感染打破。炎症信号能诱导铁调素的表达增加,从而使血浆中铁水平下降,引起机体低铁血症[3]。在动物机体内,细胞外的游离铁浓度(1×10-18μmol/L)远远低于细菌生长所需浓度(1×10-7μmol/L),感染期间游离铁浓度更低,因此,宿主细胞和病原菌之间经常存在铁竞争[4]。在此过程中,宿主细胞会分泌大量乳铁蛋白(lactoferrin,Lf)、转铁蛋白、嗜铁素等铁结合蛋白,结合体内游离铁以应对细菌的入侵[5]。
Lf最早于1939年在牛奶中被发现,其在牛奶中的含量特别丰富,也存在于细胞外分泌物如泪液、鼻液、唾液、胰液和胃肠道分泌物中[6]。Lf作为一种铁结合蛋白,不仅参与铁的转运,而且具有调节免疫、抗菌杀菌、抗癌等多种功能,是新生动物必需的一种安全可靠的营养调节物质。目前已有研究表明,Lf 是婴儿肠上皮发育的必需调节剂,在肠上皮细胞的增殖分化和肠道免疫活性中发挥着重要作用[7]。因此,Lf 已成为婴儿配方奶粉中的主要功能性添加成分,也是一种极具开发潜力的仔猪饲料添加剂。这其中可能的机制主要包括Lf 能通过促进机体对铁的吸收和转运,从而改善肠道中微生态环境,加强机体对营养物质的吸收,提高机体的抗氧化性能,增强机体的免疫力[8]。Lf 具有广谱抗菌能力,一般通过铁剥夺、膜渗透、酶抑制等途径抗菌[9],还能水解为Lf 肽发挥抗菌作用[10]。但对Lf 本身的铁饱和度是否影响抗菌能力的研究却鲜见报道。
根据Lf中的铁含量,可以将其分为2种形式,即铁不饱和乳铁蛋白(apolactoferrin,Apo-Lf)和铁饱和乳铁蛋白(hololactoferrin,Holo-Lf)。本试验旨在通过研究不同铁饱和度的猪Lf对细菌生长的影响,重点分析不同铁饱和度Lf抑菌的机制和结构基础,为基于Lf 新型抑菌剂的开发和在动物生产中的应用提供理论依据。
1 材料与方法
1.1 乳铁蛋白的准备
猪乳铁蛋白(天然乳铁蛋白)购于德国Hoelzel Diagnostika 公司。采用高效液相色谱法检测天然Lf 的纯度为98.0%,铁饱和度为22.6%。根据WANG 等[11]的方法制备Apo-Lf(铁饱和度为6.9%)和Holo-Lf(铁饱和度为100.0%)。将3 种不同铁饱和度的Lf 分别使用无菌水配制成质量浓度为500 μg/mL的母液,保存在4 ℃冰箱中,备用。
1.2 抑菌活性试验
大肠埃希菌K88(Escherichia coliK88)、金黄色葡萄球菌ATCC 25923(Staphylococcus aureusATCC 25923)、鼠伤寒沙门菌CMCC50013(Salmonella typhimuriumCMCC50013),均购自中国微生物菌种保藏中心(北京)。各细菌在Luria-Bertani(LB)液体培养基中、于37 ℃条件下培养过夜,以250 r/min离心收集。用无菌磷酸盐缓冲液(phosphate buffered saline,PBS)重悬,调整菌液浓度至1×106CFU/mL。采用分光光度法测定生物浊度以评估Lf 对细菌培养基中液体生长的影响[12]。在LB 液体培养基中连续稀释Lf,将制备好的Lf 工作液加入含有100 μL 细菌溶液的96 孔培养板中,使最终的Lf质量浓度达到400.0、200.0、50.0、25.0、12.5 μg/mL。使用酶标仪检测不同时间点的D(600 nm)值,以反映各菌株在37 ℃条件下的生长情况。为了证明铁在Apo-Lf抑菌活动中的作用,于24 h时,在Apo-Lf的LB 液体培养基中添加6.25 μmol/L 次氮基三乙酸铁,并在48 h时检测D(600 nm)值。
1.3 电子显微镜观察
分别用Apo-Lf溶液(50.0 μg/mL)和Holo-Lf溶液(50.0 μg/mL)培养浓度为1×103CFU/mL 的细菌24 h。离心得到的细菌用PBS洗涤,之后用2.5%戊二醛固定,再用梯度浓度(30%~100%)乙醇脱水,随后转移到乙醇/乙酸异戊酯体积比为1∶1 的混合溶液中脱水30 min,然后转移到乙酸异戊酯溶液中脱水1 h。在HCP-2 型临界点干燥仪(日本Hitachi公司)中用CO2对样品进行干燥,给处理好的样品涂上钯膜,用SU8010型扫描电子显微镜(日本Hitachi公司)观察细菌的形态。
1.4 细菌生长试验
为了确定细菌生长过程中对铁的需求,用添加或者不添加次氮基三乙酸铁(含6.25 μmol/L Fe)的低铁M9培养基(含1.8 μmol/L Fe)培养细菌。在24 h 时,通过测定D(600 nm)值反映各菌株的生长情况。
1.5 数据统计与分析
试验数据用平均值±标准差表示,利用SPSS 20.0软件中的单因子方差分析和t检验(t-test)进行统计分析,以P<0.05 表示差异有统计学意义,以P<0.01表示差异有高度统计学意义。
2 结果与分析
2.1 不同浓度的天然乳铁蛋白对细菌生长的影响
由图1 可知,Lf 对大肠埃希菌K88 的生长有显著抑制作用,并且这种抑制作用具有剂量依赖性。Lf 浓度越高,对大肠埃希菌的抑制作用越明显,其中质量浓度大于12.5 μg/mL 的Lf 从24 h 开始显著抑制了大肠埃希菌K88的生长(P<0.05),并在48 h时达到极显著水平(P<0.01)。
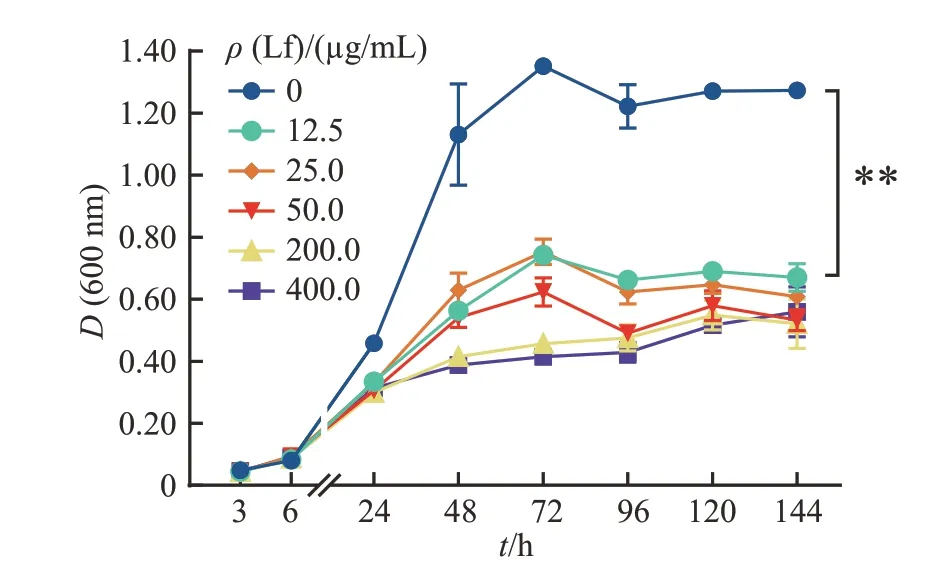
图1 不同浓度乳铁蛋白对大肠埃希菌K88生长的影响Fig.1 Effects of different concentrations of Lf on the growth of E.coli K88
2.2 不同铁饱和度的乳铁蛋白对细菌生长的影响
如图2所示,与对照组(CK)相比,50.0、200.0 μg/mL Apo-Lf 显著抑制了大肠埃希菌K88(图2A)和金黄色葡萄球菌(图2B)的生长(P<0.01),但对鼠伤寒沙门菌(图2C)没有显著影响(P>0.05)。而Holo-Lf对3种细菌的生长均没有显著影响(图2A~C)。为了更好地展示Lf对细菌生长的抑制作用,我们绘制了大肠埃希菌K88 和金黄色葡萄球菌的生长曲线图(图2D~E)。结果表明,50.0、200.0 μg/mLApo-Lf处理对大肠埃希菌K88的生长具有极显著的抑制作用(P<0.01),在120 h 内细菌基本不生长(图2D)。200.0 μg/mLApo-Lf处理也对金黄色葡萄球菌的生长有显著抑制作用(P<0.05),但在120 h内细菌缓慢生长(图2E)。然而,Holo-Lf对大肠埃希菌K88和金黄色葡萄球菌的生长同样没有抑制作用,反而有促进细菌生长的趋势(图2D~E)。这说明铁饱和度对Lf的抑菌作用至关重要,而且Apo-Lf抑制大肠埃希菌K88生长的效果比抑制金黄色葡萄球菌更显著。
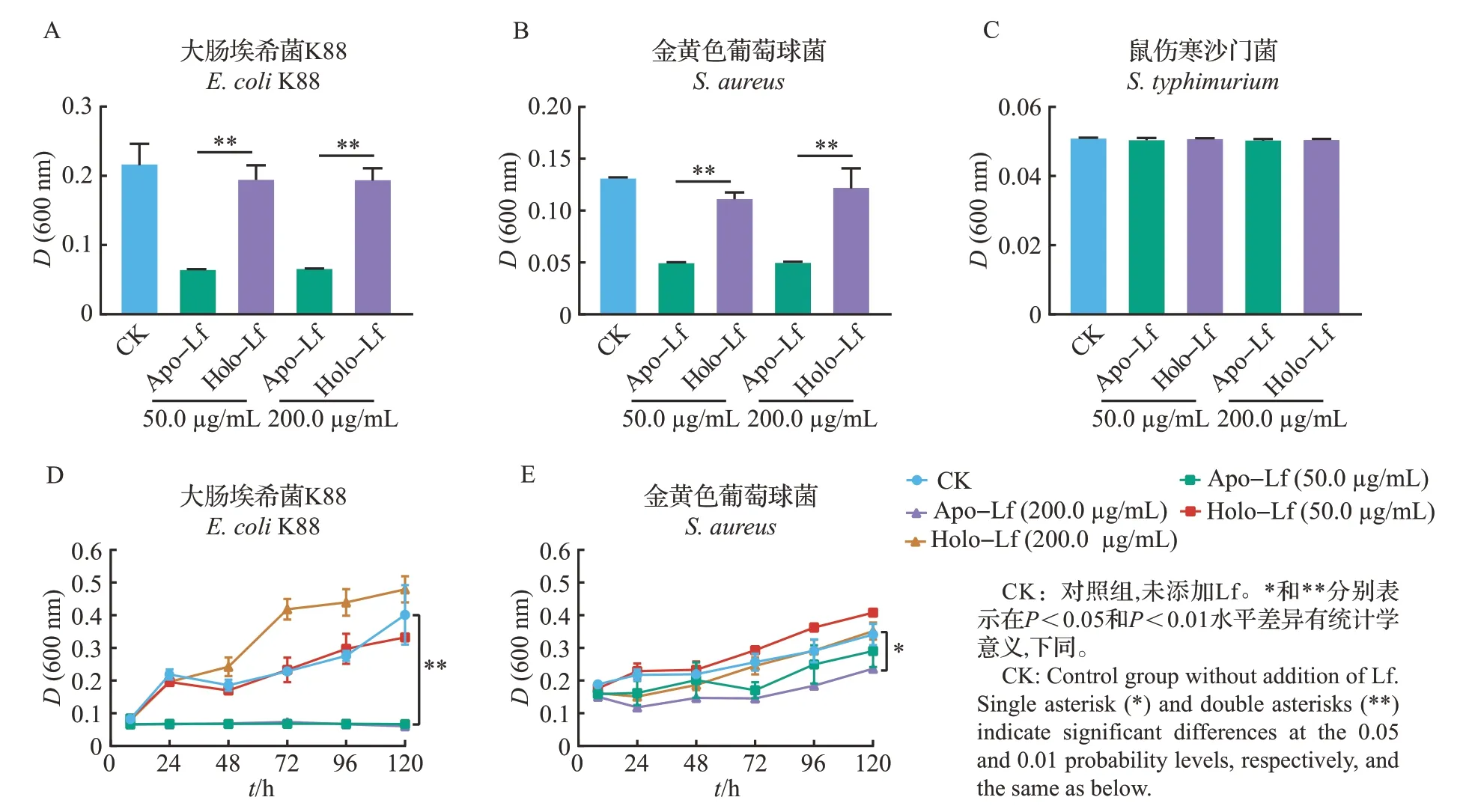
图2 Apo-Lf和Holo-Lf对细菌生长的影响Fig.2 Effects of Apo-Lf and Holo-Lf on the growth of bacteria
为了进一步确认铁在Apo-Lf抑制大肠埃希菌生长中的作用,接着开展了补铁试验。由图3可知,被Apo-Lf抑制的大肠埃希菌K88在补铁之后显著恢复了生长(P<0.01),24 h后其细菌含量甚至超过了对照组。这说明Apo-Lf的抑菌活性主要依赖于低铁。
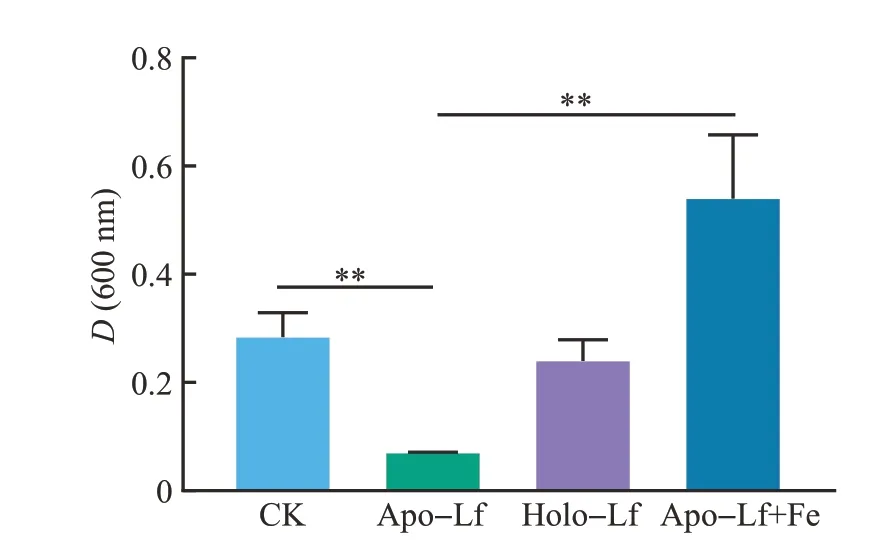
图3 补铁对Lf处理的大肠埃希菌K88生长的影响Fig.3 Effects of Fe supplement on the growth of Lftreated E.coli K88
由于Apo-Lf 对鼠伤寒沙门菌无显著影响(图2C),说明低铁对鼠伤寒沙门菌的生长影响有限,因此进一步开展了补铁试验进行验证。结果(图4)表明:在向低铁M9培养基中补充6.25 μmol/L Fe之后,大肠埃希菌K88和金黄色葡萄球菌的数量均显著增加(P<0.01)。但是,补铁对鼠伤寒沙门菌的生长无明显影响(P>0.05)。说明低铁M9 培养基中的铁水平已满足了鼠伤寒沙门菌的生长需要,所以铁补充对其生长无显著影响,也提示鼠伤寒沙门菌对铁的需求量要比大肠埃希菌K88 和金黄色葡萄球菌的更少。
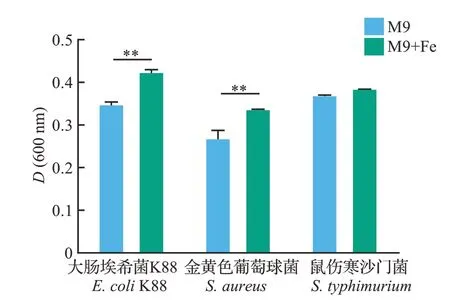
图4 培养基中的铁对细菌生长的影响Fig.4 Effects of Fe in the culture medium on the growth of bacteria
2.3 乳铁蛋白对细菌形态的影响
扫描电镜结果(图5)显示:用50.0 μg/mL Lf 处理细菌24 h 后,对照组细菌的表面光滑,形态特征正常。而用50.0 μg/mL Apo-Lf 处理的大肠埃希菌K88和金黄色葡萄球菌表面粗糙,受损严重,有些细菌表面甚至出现了裂痕和坑洼,但鼠伤寒沙门菌却没有受到明显影响。同样,50.0 μg/mL Holo-Lf 处理对3种细菌的表面结构没有显著影响。这些结果与之前的抑菌结果一致。
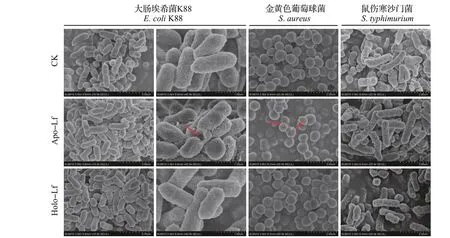
图5 50.0µg/mLApo-Lf和50.0µg/mL Holo-Lf对细菌形态的影响Fig.5 Effects of 50.0µg/mL Apo-Lf and 50.0µg/mL Holo-Lf on the morphologies of bacteria
2.4 乳铁蛋白的三维结构预测
由于Apo-Lf 和Holo-Lf 在抑制大肠埃希菌K88和金黄色葡萄球菌的生长方面表现出了巨大差异,本研究尝试从二者的结构方面进行解析。利用Uniprot(https://www.uniprot.org/align/)查得猪Lf 的氨基酸序列,使用SWISS-MODEL 构建其三维构型,得到Lf 的三维结构图。如图6 所示:Apo-Lf 在未结合铁时呈开放状态,该状态下Lf的活性部位更容易与细菌表面直接作用。结合铁后,Apo-Lf由开放状态变为闭合状态的Holo-Lf,该闭合状态不利于活性部位与细菌接触。
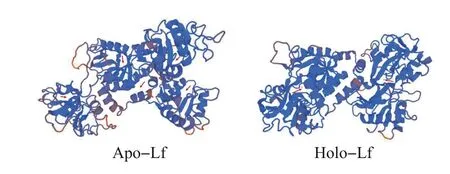
图6 Apo-Lf和Holo-Lf的三维结构预测Fig.6 Predicted three-dimensional structures of Apo-Lf and Holo-Lf
3 讨论与结论
Lf对铁具有很强的亲和力,本研究证明了不同铁饱和度的Lf 对细菌生长的抑制作用存在很大差异。Apo-Lf 能够有效抑制大肠埃希菌K88 和金黄色葡萄球菌的生长,而Holo-Lf 对这2 种细菌并无此作用。为证明缺铁可抑制细菌生长,本研究采用在低铁培养基中补充铁的试验,结果表明低铁培养基的确能够在一定程度上限制细菌生长。而且,在Apo-Lf 抑菌试验中添加铁能消除Apo-Lf 的抑制作用,说明Apo-Lf 具有较强的铁结合能力,其抑菌作用在很大程度上基于竞争性地结合了细菌生长所需要的铁元素。前人的研究也发现,天然Lf 和Apo-Lf 能不同程度地抑制19 种细菌的生长,而Holo-Lf 却不能抑制这些细菌[13]。Apo-Lf 能够抑制变形链球菌6715-13 的生长,但加入Holo-Lf 后抑菌效果消失[14]。本研究结果和前人的结论都表明,只有低铁饱和度的Lf能够抑制细菌生长,天然Lf和Apo-Lf 的铁结合能力要强于铁饱和的Holo-Lf。同时,在胞外游离铁被限制的情况下,许多细菌已经进化出从Holo-Lf中获取铁的机制。例如一些细菌表面的特异性Lf受体可以与Lf结合来获取Lf中的铁[15]。这也可能是Apo-Lf能够抑制这2种细菌,而Holo-Lf不能发挥抑菌作用的原因。但也有报道指出,牛Apo-Lf和Holo-Lf都可以抑制小鼠体内的金黄色葡萄球菌,并且不同铁饱和度的牛Lf的抑菌活性都是相似的[16]。这可能与Lf的种类、细菌的种类以及添加Lf的方式有关。
本研究通过扫描电镜发现,用Apo-Lf 处理过的大肠埃希菌K88 和金黄色葡萄球菌菌体表面均出现了不同程度的破损,而对照组和Holo-Lf 处理组则均未出现此情况。这说明Apo-Lf 能在一定程度上破坏大肠埃希菌K88 和金黄色葡萄球菌的表面结构,该结果与其有效抑制细菌生长的试验结果一致。BRANDENBURG 等[17]发现在细胞外铁过量的情况下,Lf 可以直接与一些细菌的表面结合,发挥不依赖于铁的抑菌作用。这种功能可能与Lf 自身的大量正电荷与细菌成分相互作用有关,也可能与Lf 利用N 端叶蛋白酶样活性裂解富含精氨酸区域的蛋白质从而减弱细菌毒力有关[18-19]。当然,本研究中Apo-Lf 表现出的破坏细菌膜的作用可能更大程度上依赖于其结构。通过对Lf 的三维结构进行预测发现,猪Lf在不同的铁饱和度情况下的结构有很大差异。与Holo-Lf 相对闭合的结构相比,Apo-Lf 的结构更开放、更延展。铁饱和时Lf 的构象变化可能会干扰Lf 杀菌区域与细菌表面的相互作用,减弱其抑菌活性,而Apo-Lf 开放的结构可能更容易展示其杀菌位点,可以更好地与细菌表面相互作用,这表明Apo-Lf 构象可能也是它发挥抗菌作用的关键。这一结果与ANDERSEN 等[20]报道的人Lf晶体结构研究结果一致。
本研究首次直接证明了猪Apo-Lf 一方面可以通过结合铁的方式抑制大肠埃希菌K88 和金黄色葡萄球菌的生长,另一方面也可以利用其开放的构象、有效破坏细菌膜的方式来抑菌,这为开发基于Lf 的抑菌制剂提供了理论依据。但本研究也存在一定的局限性,如Apo-Lf 未能抑制鼠伤寒沙门菌的原因还不清楚,不同铁饱和度的猪Lf在体内对细菌的抗菌作用仍有待继续探究。
综上所述,本研究发现低铁饱和度的Lf能够结合铁,竞争性地夺取细菌所需铁而发挥抑菌作用;低铁饱和度的Lf能够破坏细菌菌体的表面膜结构,而铁饱和的Lf则无此功能;低铁饱和度的Lf三维结构更开放,有利于展示其活性位点。
