弓形虫感染对雄性小鼠生殖系统影响的研究
2022-07-11关立增魏明吉刘涵笑冯子睿
徐 璐,关立增,魏明吉,张 晴,刘涵笑,冯子睿
(临沂大学农林科学学院,山东 临沂 276000)
弓形虫(T. gondii)是一种专性细胞内寄生虫,感染包括人在内的大部分温血动物,世界上约三分之一人口感染了弓形虫[1]。畜禽感染率高于人类,我国猪弓形虫感染率在30%~50%,在一些地区甚至高达70%;我国西北部和北部地区绵羊弓形虫感染率达20%;我国南部地区超过20%鸡感染弓形虫[2]。猪感染弓形虫后出现体温升高、精神萎靡、采食量下降、被毛蓬乱,严重者后肢无法正常站立、呼吸不顺、咳嗽、下痢等。怀孕母猪往往会流产或产出死胎。弓形虫对人类健康和畜牧业发展的潜在威胁引起越来越多的关注。
弓形虫感染导致宿主多器官损伤,脑和脊髓是弓形虫感染的主要靶器官[3]。弓形虫造成肝脏肿大、肝炎、肝脏肉芽肿、肝坏死、胆汁淤积性黄疸和肝硬化等临床症状[4]。在多项研究中,山羊、犬、兔子、猪、公牛和人类精液中可检测到弓形虫。最近一项关于男性不育患者弓形虫感染的调查显示,在100 例男性不育患者中,6%患者血清弓形虫IgG、IgM 和CAG呈阳性[5]。弓形虫感染造成雄性生殖损伤,但损伤作用机制尚不明确。本研究采用弓形虫RH 株感染雄性BALB/c 小鼠,探究弓形虫感染对雄性小鼠生殖功能的影响。
1 材料与方法
1.1 主要实验材料 弓形虫RH 株由日本带广畜产大学国家原虫病研究中心提供,由临沂大学兽医寄生虫实验室保存,在小鼠腹腔内连续传代;SPF 级雄性BALB/c 小鼠购自长春亿斯实验动物技术有限公司;睾酮(Testosterone,T)、黄体生成素(Luteinizing hormone,LH)和卵泡刺激素(Follicle stimulating hormone,FSH)ELISA 试剂盒购自南京建成生物有限公司;丙二醛(Malondialdehyde,MDA)、一氧化氮(Nitric oxide,NO)、谷胱甘肽(Glutathione,GSH)和超氧化物歧化酶(Superoxide dismutase,SOD)测定试剂盒自南京建成生物有限公司;肿瘤坏死因子α(Tumor necrosis factor α,TNF-α)、白细胞介素6(Interleukin-6,IL-6)和白细胞介素1beta(Interleukin-beta,IL-1β)ELISA 试剂盒购自Biolegend 公司;精子活体染色液购自北京索莱宝生物技术有限公司;RIPA 裂解液、TUNEL 细胞凋亡检测试剂盒(显色法)购自上海碧云天生物技术有限公司;兔抗鼠B 淋巴细胞瘤2(Bcl-2)单克隆抗体、兔抗鼠Bcl-2相关蛋白X(Bax)多克隆抗体、兔抗鼠β-Actin多克隆抗体、HRP标记山羊抗兔IgG(IgG-HRP)购自Cell Signaling Technology公司。
1.2 实验分组 将雄性BALB/c 小鼠分为2 组(n=12):弓形虫感染组和对照组,感染组小鼠腹腔注射弓形虫(RH株,103个/只),0.2 mL/只,对照组小鼠注射等量生理盐水。感染后7 d,眼球采血,颈椎脱臼迫杀小鼠,取睾丸及附睾用于后续试验。
1.3 小鼠生殖参数测定 取小鼠左附睾置于装有PBS(pH7.4)平皿上,剪碎,在37 ℃恒温箱中孵育30 min,伊红染液染色,测定精子密度。显微镜下观察精子形态,精子形态标准(图1):(1)正常精子:形似蝌蚪、精子头光滑、顶体清楚、精子各部分无明显畸形;(2)精子畸形包括:头部无钩、胖头、双头、无定形头、香蕉头,中部残余胞浆、弯曲畸形,尾部鞭毛缺失、双尾、短尾等。
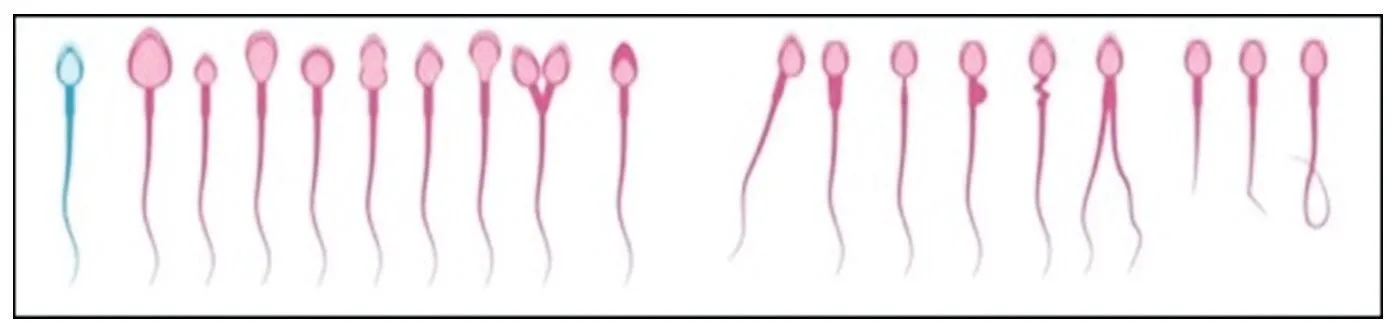
图1 精子畸形模式图Fig.1 Pattern of sperm malformation
1.4 小鼠睾丸组织病理学观察 各组小鼠睾丸组织置于10%中性福尔马林固定后,包埋,制备石蜡切片,HE 染色后经光学显微镜观察。
1.5 小鼠血清生殖激素和细胞因子测定 小鼠眼球采血后,分离血清,采用相应ELISA 试剂盒测定各组小鼠血清中T、LH、FSH、TNF-a、IL-6 及IL-1β表达量。
1.6 小鼠睾丸组织中氧化应激指标测定 取各组小鼠睾丸组织,研磨后,于8 000 r/min,4 ℃离心15 min,收集上清液,利用相应试剂盒测定各组小鼠睾丸组织中MDA、NO、GSH 及SOD 表达量。
1.7 小鼠睾丸细胞凋亡的TUNEL 检测 取小鼠睾丸组织按常规方法制做石蜡切片,滴加蛋白酶K,于37 ℃恒温箱中放置30 min,用PBS 将蛋白酶K 洗净。将3%过氧化氢溶液滴到石蜡切片上,覆盖样品,防止过氧化物酶造成干扰,用混匀后的生物素标记液(TdT 酶、Biotin-Dutp、生物素标记液)于37 ℃恒温箱中避光孵育样本。将TUNEL 检测液滴到石蜡切片上,覆盖样品,于37 ℃恒温箱中避光孵育样本,30 min 后用PBS 洗涤,加Streptavidin-HRP 孵育,DAB 显色,苏木素染细胞核,封片,利用显微镜观察睾丸细胞凋亡情况。
1.8 睾丸细胞凋亡蛋白表达的western blot 检测各组小鼠睾丸组织经RIPA 裂解后,分别以兔抗鼠Bax 多克隆抗体(1:1 000)、兔抗鼠Bcl-2 单克隆抗体(1:1 000)、兔抗鼠β-Actin 多克隆抗体(1:2 000)为一抗,山羊抗兔IgG-HRP(1:3 000)为二抗,ECL 显色,利用图像分析软件(Bio-Rad、Richmond、CA、USA)分析条带灰度,通过western blot 分析小鼠睾丸细胞中Bax 和Bcl-2 的表达水平。
1.9 实验数据统计分析 所有数据均采用SPSS 20.0统计分析软件(SPSS,Inc.,Chicago,IL,USA)进行单因素ANOVA 方差分析,LSD 法多重比较,P<0.05为差异显著,具有统计学意义。
2 结 果
2.1 弓形虫对雄性小鼠生值参数和组织学改变的影响 将弓形虫RH 株感染雄性小鼠7 d 后,迫杀取附睾,处理并染色后经显微镜观察精子状态。结果显示,对照组小鼠精子密度为(27.89±4.88)×106个/mL,精子畸形率为(3.36%±0.49)%,感染组小鼠精子密度为(14.57±2.36)×106个/mL, 精子畸形率为(5.22 ±0.86)%。与对照组比较,感染组小鼠精子密度显著下降(P<0.01),精子畸形率显著增加(P<0.05)。与对照组相比,弓形虫感染组小鼠睾丸组织发生显著变化,表现为睾丸细胞数量减少、变性、排列紊乱、细胞间隙增大等严重病理改变。对照组小鼠睾丸组织各层生精细胞均正常(图2)。结果表明,弓形虫降低了小鼠生精能力及造成小鼠睾丸组织的病理损伤。
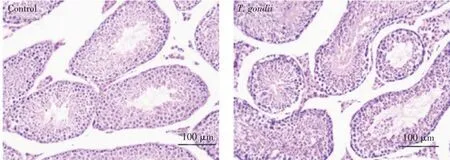
图2 弓形虫对雄性小鼠睾丸组织的病理损伤(200×)Fig.2 The effect of Toxoplasma gondii on the pathological damage of testis in male mice(200×)
2.2 弓形虫对雄性小鼠生殖激素影响 睾丸支持细胞分泌的FSH 在睾丸发育中起重要作用。LH 通过与促黄体生成素受体(LHR)结合,促进睾丸间质细胞增殖,增加T 分泌。结果显示,与对照组比较,弓形虫导致小鼠血清性激素(FSH、 LH、T)水平显著下降(P<0.05,P<0.01)(图3)。表明弓形虫感染造成小鼠血清性激素下降。

图3 弓形虫对雄性小鼠生殖激素的影响Fig.3 Effect of Toxoplasma gondii on reproductive hormones in male mice
2.3 弓形虫对雄性小鼠血清细胞因子分泌的影响TNF-α、IL-6 和IL-1β 等细胞因子在炎症的发生发展中起着重要作用,利用ELISA 法测定弓形虫感染后的小鼠血清中的这些细胞因子水平。结果显示,感染组小鼠血清TNF-α、IL-6 和IL-1β 水平较对照组极显著升高(P<0.01)(图4)。表明弓形虫感染引起小鼠血清内炎性细胞因子的增加。
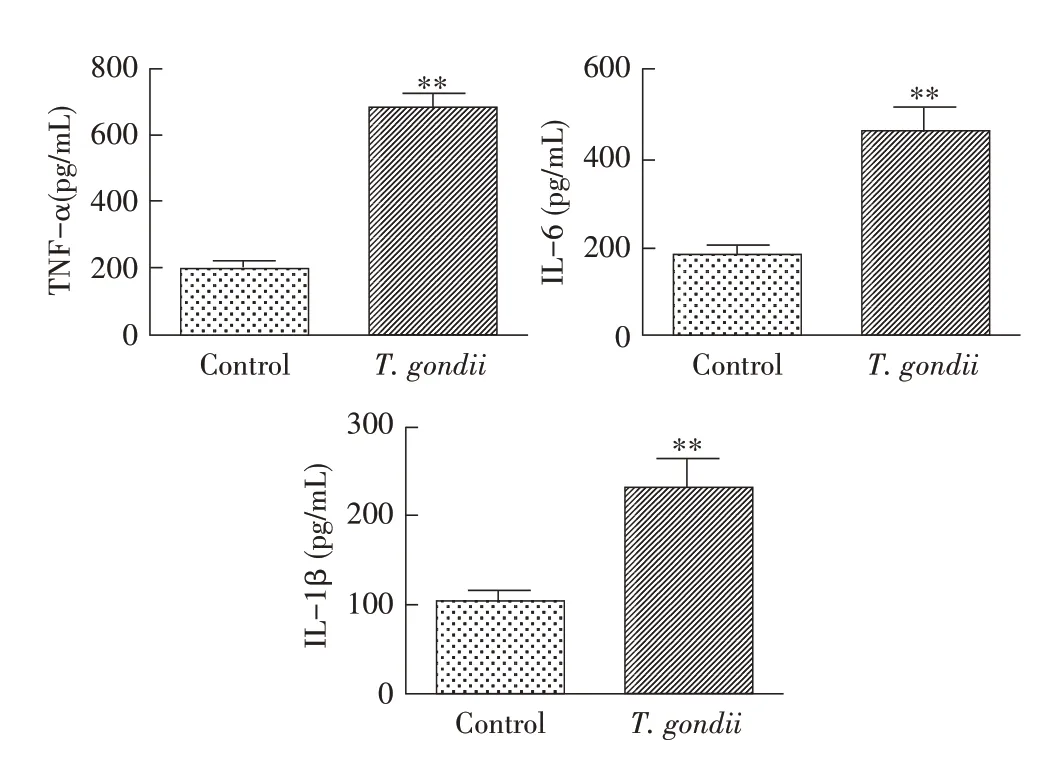
图4 弓形虫对雄性小鼠血清细胞因子影响Fig.4 Effect of Toxoplasma gondii on serum cytokines in male mice
2.4 弓形虫对小鼠睾丸组织氧化应激指标的影响氧化应激对精子的发生有重要影响。结果显示,与对照组相比,感染组小鼠睾丸组织内MDA、NO 表达量极显著增加(P<0.01),SOD、GSH 表达量极显著减少(P<0.01)(图5)。表明弓形虫感染导致小鼠睾丸细胞发生氧化应激。
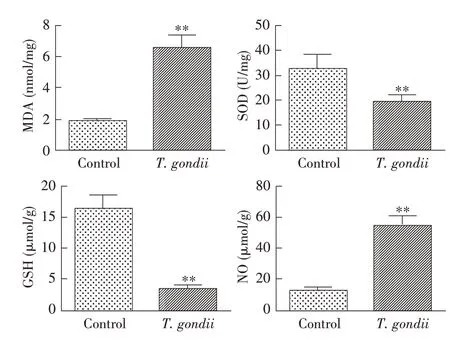
图5 弓形虫对小鼠睾丸组织MDA、SOD、GSH和NO影响Fig.5 Effects of Toxoplasma gondii on MDA,SOD,GSH and NO in testis of mice
2.5 弓形虫对小鼠睾丸细胞凋亡的影响 弓形虫感染导致宿主细胞发生凋亡,采用TUNEL 法检测睾丸细胞凋亡情况。结果显示,感染组小鼠睾丸细胞观察到大量TUNEL 阳性凋亡细胞(深棕色),且睾丸细胞凋亡率为(11.28±1.58)%,对照组小鼠睾丸细胞凋亡率为(2.32±0.37)%,二者差异极显著(P<0.01)(图6)。表明弓形虫感染导致小鼠睾丸细胞发生凋亡。
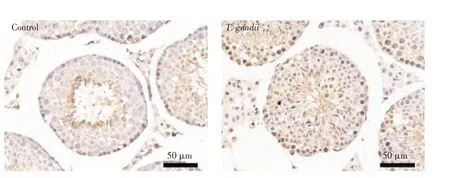
图6 弓形虫对雄性小鼠睾丸细胞凋亡的影响(400×)Fig.6 Effect of Toxoplasma gondii on testicular cell apoptosis in male mice(400×)
2.6 弓形虫对小鼠睾丸细胞凋亡蛋白表达的影响凋亡蛋白Bax 和Bcl-2 在细胞凋亡中具有重要调节作用。本研究采用western blot 法测定睾丸组织中Bax 和Bcl-2 的表达量来分析弓形虫造成小鼠睾丸细胞凋亡作用机制。结果显示,与对照组比较,感染组小鼠睾丸中Bax 蛋白表达量极显著增加(P<0.01),Bcl-2 蛋白表达量无显著性差异(P>0.05)(图7)。表明弓形虫能促进小鼠睾丸促凋亡蛋白分泌从而诱导细胞凋亡。

图7 弓形虫对雄性小鼠睾丸细胞凋亡蛋白表达的影响Fig.7 Effect of Toxoplasma gondii on the expression of apoptosis protein in testis of male mice
3 讨 论
精子是成年雄性睾丸中产生的高度特化单倍体细胞,精子形成过程是指精子在睾丸曲细精管腔内发生一系列复杂的成熟和转化过程。根据WHO标准,精子密度、运动性、活力和异形率等指标用于评估精子功能[6]。本研究发现弓形虫感染小鼠的精子密度降低和精子畸形率增加,说明弓形虫感染降低雄性小鼠的生精功能。
下丘脑-垂体-性腺轴调节雄性动物生殖活动的不同阶段,例如性行为、精子形成和精子成熟等。弓形虫对雄性动物生殖功能损害可能通过调节下丘脑-垂体-性腺轴从而影响睾丸和精细胞性激素产生[7]。弓形虫感染降低垂体对促性腺激素释放激素(GnRH)的刺激敏感性。GnRH 变化直接影响FSH 和LH 的合成和释放。FSH 由睾丸支持细胞分泌,在睾丸发育中起重要作用。LH 与受体结合促进睾丸间质细胞的增殖和增加T 的分泌[8]。这些雄性激素具有很多生理功能,例如维持精子发生、促进生殖器官发育、维持雄性动物正常性功能和诱导蛋白质合成等。弓形虫感染导致人类和啮齿动物的睾酮水平下降。急性弓形虫感染导致雄性和雌性小鼠血清T 含量下降[9]。在高剂量弓形虫感染的雄性大鼠中,大鼠血清和睾丸的T 短暂降低[10]。在急性弓形虫病期间,男性患者的总睾酮和游离睾酮、FSH 和LH 水平均降低[11]。本研究发现弓形虫感染的小鼠体内T、FSH 和LH 含量显著降低,与以上结果一致。弓形虫感染宿主过程中涉及促炎细胞因子和抗炎细胞因子表达的失衡。TNF-α、IL-1β 和IL-6 是常见的促炎细胞因子,高水平的TNF-α、IL-1β 和IL-6 表达提示炎症发生。该研究显示,弓形虫感染导致雄性小鼠炎性细胞因子表达增加。因而,纠正下丘脑-垂体-性腺轴功能障碍和抑制炎性细胞因子表达可预防弓形虫病导致的睾丸功能障碍。
睾丸氧化应激发生对精子发生和男性生育能力有不利影响,并伴随着一些促氧化和抗氧化生物标志物如MDA、SOD、GSH 和NO 的变化。MDA 是多不饱和脂肪酸发生脂质过氧化反应的主要产物[12]。弓形虫感染导致MDA 含量显著增加[13]。在感染弓形虫过程中,SOD 和GSH 是抗氧化损伤和产生活性氧的两种关键酶[12-13]。NO 是一种由一氧化氮合酶产生的多功能细胞因子,广泛分布于睾丸生精小管中[14]。在弓形虫感染过程中,睾丸内NO 表达的增高会增加其的氧化应激[15]。本研究表明,弓形虫感染导致小鼠睾丸MDA 和NO 升高,SOD 和GSH 降低。提示弓形虫感染导致小鼠睾丸细胞发生了氧化应激。
弓形虫感染能引起宿主细胞凋亡。有研究报道,弓形虫感染导致宿主CD4+T 淋巴细胞、巨噬细胞凋亡[16]。急性弓形虫感染导致小鼠脾脏发生细胞凋亡[17]。本研究发现弓形虫能引起睾丸细胞凋亡,其可能的机制是:雄性小鼠感染弓形虫后,睾丸内生精细胞和巨噬细胞等分泌TNF-α 从而启动细胞凋亡;睾丸内游离氧化自由基与多聚不饱和脂肪酸发生氧化反应从而引发细胞氧化应激,氧化应激过程中产生的过氧化物等可以引发睾丸生精细胞凋亡;弓形虫感染过程中雄性激素(T、LH 和FSH)含量降低从而导致睾丸生精细胞凋亡。在细胞凋亡过程中,Bcl-2 家族起重要作用[18]。线粒体依赖性凋亡通路激活由Bcl-2 家族蛋白调控。Bcl-2 基因主要功能是增强细胞抵抗外界凋亡刺激因素[19]。Bax 基因从细胞质到线粒体易位诱导细胞色素c 释放,从而促进细胞凋亡。Bcl-2 与Bax 能形成同源或异源二聚体从而介导细胞凋亡[20]。Western blot 结果显示,感染组小鼠睾丸组织Bax 蛋白表达量较对照组显著增加,而Bcl-2 蛋白表达量无显著性差异。说明弓形虫感染造成的小鼠生精细胞凋亡可能由于通过促进Bax 蛋白表达,导致Bcl-2 和Bax 同源二聚体比例增加,异源二聚体比例降低。
本研究首次证实了弓形虫感染可引起雄性小鼠生殖参数改变、炎性细胞因子表达量增加、睾丸细胞氧化应激、睾丸细胞凋亡等。由于小鼠是弓形虫研究的最佳模型,本研究结果为弓形虫感染导致人及动物生殖障碍机制研的究奠定基础。
