现用重组AIV(H5+H7)三价灭活疫苗对近期H5和H7亚型AIV分离株的免疫效力研究
2022-07-11刘艳晶潘舒心和新文邓国华李雁冰施建忠包红梅毛胜刚胡井雷刘景利郭兴福田国彬曾显营陈化兰
刘艳晶,麻 琦,潘舒心,和新文,王 燕,邓国华,李雁冰,施建忠,包红梅,毛胜刚,胡井雷,路 通,刘景利,郭兴福,田国彬*,曾显营*,陈化兰*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/国家禽流感参考实验室/国家禽类实验动物资源库,黑龙江 哈尔滨 150069;2.哈尔滨维科生物技术有限公司,黑龙江 哈尔滨 150069)
高致病性禽流感(Highly pathogenic avian influenza,HPAI)是由H5 和H7 亚型HPAI 病毒(HPAIV)感染引起的一种重要人兽共患传染病[1]。近二十年来,H5 亚型和H7N9 亚型AIV 先后在我国家禽中引起HPAI 疫情,造成巨大经济损失,同时造成人的感染和死亡,引起全球高度关注[2-4]。
疫苗免疫是我国控制HPAI 的重要策略。自2004年以来,我国研制出一系列HPAI 防控疫苗,并及时更新疫苗种毒,保证其免疫预防效果[2,5]。疫苗的应用极大减少了家禽中HPAIV 的流行和传播,有效控制了我国家禽HPAI,避免了养禽业的重大经济损失。H5+H7 AIV 二价疫苗自2017 年9 月在家禽中应用后,有效控制了家禽中的H7N9 AIV,彻底阻断了其对人的感染,成为“从动物源头控制人兽共患传染病”的成功典范[5]。当前,我国使用的疫苗主要为重组AIV(H5+H7)三价灭活疫苗(H5N1 Re-11 株+Re-12株,H7N9 H7-Re3 株),该疫苗于2020 年7 月以来在我国11 家HPAI 定点生产企业中的10 家企业生产和销售。
AIV 为分节段的RNA 病毒,极易通过变异或重组而产生新型病毒,给HPAI 的防控带来挑战[1]。2020 年以来,我国野鸟中出现H5N8 和H5N6 亚型HPAIV 引起的疫情[6],家禽中也监测到H5N6 和H7N9亚型HPAIV,给养禽业带来巨大威胁,同时近期我国四川、重庆、广西3 省市出现6 例人感染H5N6 病毒的病例,引起广泛的关注[7]。国家禽流感参考实验室对2020 年以来分离的H5 和H7 亚型HPAIV 进行系统抗原性分析,发现绝大多数H5N6 亚型AIV 与现有疫苗株的抗原性匹配,但野鸟中分离的H5N8 亚型和家禽分离到的H7N9 亚型HPAIV 以及少数H5N6 亚型HPAIV 与现用疫苗株抗原性存在差异(数据未发表)。现用疫苗免疫对抗原变异株的预防效果成为兽医管理部门、家禽养殖者的关注重点。本研究利用与疫苗株有不同程度抗原差异的4 株H5N6 亚型、1 株H5N8 亚型和1 株H7N9 亚型AIV,评估了现用疫苗的免疫保护效果,以期为我国HPAI 防控疫苗的应用及疫苗毒种的更新提供科学数据。
1 材料与方法
1.1 病毒株 攻毒用H5N6 亚型AIV A/duck/Guangdong/SC001/2020(简称为DK/GD/SC001/2020)、A/duck/Hunan/S11553/2020(简称为DK/HuN/S11553/2020)、A/duck/Fujian/S1424/2020(简称为DK/FJ/S1424/20)和A/goose/Guizhou/S1569/2021(简称为GS/GZ/S1569/21)株均由本实验室2020 年~2021 年分别在广东省、湖南省、福建省和贵州壮族自治区的活禽市场健康鸭中分离,均为H5 亚型2.3.4.4d 分支HPAIV;H7N9亚型AIV A/chicken/Yunnan/SD024/2021(简称为CK/YN/SD024/21)株由本实验室2021 年在云南采集的临床样品中分离;H5N8 亚型AIV A/whooper swan/Shanxi/4-1/2020(简称为WS/SX/4-1/20)株由本实验室2020 年从山西省因HPAI 疫情的病死天鹅中分离,为H5 亚型2.3.4.4b 分支HPAIV。本研究选用的上述病毒株均与疫苗株有一定的抗原性差异[8]。
1.2 抗原和血清 重组H5 亚型AIV Re-11 株、Re-12 株HI 抗原和阳性血清及重组H7 亚型AIV H7-Re3株HI 抗原和阳性血清均购自哈尔滨维科生物技术开发公司。
1.3 禽流感疫苗 商品化重组AIV(H5+H7)三价灭活疫苗(H5N1Re-11 株+Re-12 株,H7N9 H7-Re3 株)(以下简称为H5+H7 三价疫苗)均由哈尔滨维科生物技术开发公司生产和检验,批号为2020048。该疫苗中H5 亚型Re-11 株和Re-12 株抗原的HA 基因分别来自H5 亚型2.3.4.4d 分支(A/Duck/Guizhou/S4184/2017,H5N6 亚型)和2.3.2.1d 分支病毒(A/Chicken/Liaoning/SD007/2017,H5N1 亚型)[9],H7 亚型H7-Re3株抗原的HA 基因来自2019 年从内蒙古鸡中的分离株A/chicken/Inner Mongolia/SD010/2019(H7N9)[8,10],其HA 裂解位点已修饰为H7N9 亚型LPAIV 的分子特征,疫苗株内部基因均来自鸡胚高度适应的A/Puerto Rico/8/1934(H1N1)病毒。
1.4 实验动物和鸡胚 3 周龄SPF 鸡和鸡胚均由依托中国农业科学院哈尔滨兽医研究所的国家禽类实验动物资源库提供。所有实验鸡均饲养在负压隔离器内,所有有关H5 亚型和H7 亚型AIV 的试验均在生物安全3 级实验室内进行。
1.5 各分离病毒鸡胚半数感染量(EID50)的测定根据《中华人民共和国药典》(2015 年版)规定的方法,将DK/HuN/S11553/2020(H5N6)、DK/GD/SC001/2020(H5N6)、 DK/FJ/S1424/20(H5N6)、GS/GZ/S1569/21(H5N6)、 WS/SX/4-1/20(H5N8)和CK/YN/SD024/21(H7N9)病毒分别用无菌PBS 10 倍倍比稀释(106~1010),每个稀释度接种5 枚鸡胚,0.1 mL/枚,37 ℃孵育,每日照胚,死亡鸡胚随时取出,置于4 ℃保存。72 h 后,检测所有鸡胚尿囊液的血凝价(HA),HA≥4log2判为感染。按照Reed-Muench法计算病毒EID50。
1.6 疫苗免疫效力试验
1.6.1 疫苗接种 60 只3 周龄SPF 鸡均以肌肉注射方式接种H5+H7 三价疫苗, 0.3 mL/只;另外60 只鸡注射同体积PBS,相同条件饲养,作为阴性对照组。免疫3 周后随机分组,每10 只免疫鸡和10 只对照鸡为一组,用于针对6 株分离株相应抗体的检测和攻毒后的免疫效力评估。
1.6.2 各组鸡血清HI 抗体的检测 疫苗免疫3 周后,采集各组免疫鸡和对照鸡血清,分别检测各组鸡血清中针对H5 亚型AIV Re-11 株、Re-12 株和H7 亚型H7-Re3 株抗原及其攻毒株的HI 抗体滴度。血凝(HA)和血凝抑制(HI)试验方法均根据国家标准(GB/T 18936-2020)进行。
1.6.3 攻毒试验 疫苗免疫3 周时,每10 只免疫鸡和10 只对照鸡为一组,分别经鼻腔感染DK/HuN/S11553/2020(H5N6)、DK/GD/SC001/2020(H5N6)、DK/FJ/S1424/20(H5N6)和GS/GZ/S1569/21(H5N6)、WS/SX/4-1/20(H5N8)和CK/YN/SD024/21(H7N9)株,进行免疫效力试验,攻毒剂量均为105EID50/只。攻毒后观察14 d,记录各组鸡发病和死亡情况;并按照HPAI 灭活疫苗的效力检验标准,在攻毒后5 d 采集各组鸡喉头和泄殖腔拭子,死亡鸡随时采集,并在10 日龄鸡胚中进行病毒滴定。为便于比较,本研究中所有鸡的排毒量均按照攻毒后5 d 的排毒结果统计。
2 结 果
2.1 各分离病毒EID50的测定结果 测定6 株攻毒用病毒接种SPF 鸡胚后的HA 效价,并按照Reed-Muench 方法计算病毒EID50。结果显示,DK/HuN/S11553/2020(H5N6)、DK/GD/SC001/2020(H5N6)、DK/FJ/S1424/20(H5N6)、 GS/GZ/S1569/21(H5N6)、WS/SX/4-1/20(H5N8)和CK/YN/SD024/21(H7N9)株的EID50分别为108.63/0.1 mL、108.50/0.1 mL、108.63/0.1 mL、108.50/0.1 mL、108.83/0.1 mL 和108.38/0.1 mL。
2.2 疫苗对4 株H5N6 亚型AIV 的免疫效力评估
2.2.1 各组鸡HI 抗体的测定结果 免疫H5+H7 三价疫苗后3 周,检测各组鸡血清中针对H5亚型AIV 及其分离株的HI 抗体效价。结果显示,免疫后3 周,4 组接种H5+H7 三价疫苗的SPF 鸡血清中针对Re-11 株和Re-12 株疫苗抗原的平均HI 抗体效价在8.0log2~8.6log2,针对DK/HuN/S11553/2020(H5N6)、DK/GD/SC001/2020(H5N6)、DK/FJ/S1424/20(H5N6)和GS/GZ/S1569/21(H5N6)株的平均HI 抗体效价分别为5.0log2、4.6log2、4.3log2 和3.8log2,与针对H5 亚型Re-11 株抗原的平均HI 抗体效价存在3.2log2~4.2log2的差异,与针对H5 亚型Re-12 株抗原的平均HI 抗体效价存在3.5log2~4.8log2 的差异;对照鸡血清中针对疫苗抗原和攻毒株抗原的HI 抗体均为阴性(表1)。现用H5+H7 三价疫苗接种鸡后可产生针对疫苗株的高水平H5 亚型AIV 的HI 抗体,但针对上述4 株H5N6 亚型AIV 的HI抗体水平与疫苗株相比显著降低。表明,上述分离株与现用疫苗株抗原性差异较大。

表1 接种疫苗3周后各组鸡产生的针对不同病毒的HI抗体检测结果Table 1 The detection results of HI antibody titers in experimental chickens at 3 weeks post vaccination
2.2.2 免疫攻毒效力试验结果 接种疫苗3 周时,各组鸡分别攻击4 株H5N6 亚型AIV,并观察临床症状和检测攻毒后5 d 的排毒。结果显示,攻毒后14 d的观察期内,对照组鸡在攻毒后4 d 内全部发病死亡,免疫组鸡无发病和死亡;攻击4 株病毒的对照组鸡在死亡时,喉头和泄殖腔拭子的病毒分离结果均为阳性,平均病毒滴度在4.2log10EID50~5.3log10EID50; 攻击 DK/HuN/S11553/2020、 DK/GD/SC001/2020、DK/FJ/S1424/20 株的免疫组鸡攻毒后5 d采集的喉头和泄殖腔拭子样品的病毒检测结果均为阴性,而2/10 免疫组鸡在攻击GS/GZ/S1569/21 株后5 d 的喉头拭子样品检测到低水平的病毒复制,泄殖腔拭子样品的检测结果均为阴性(表2)。表明鸡接种H5+H7 三价疫苗可以对免疫鸡提供抵抗高致病性H5N6 抗原变异株攻击的能力,并可完全阻止多数分离株在鸡体内的复制。
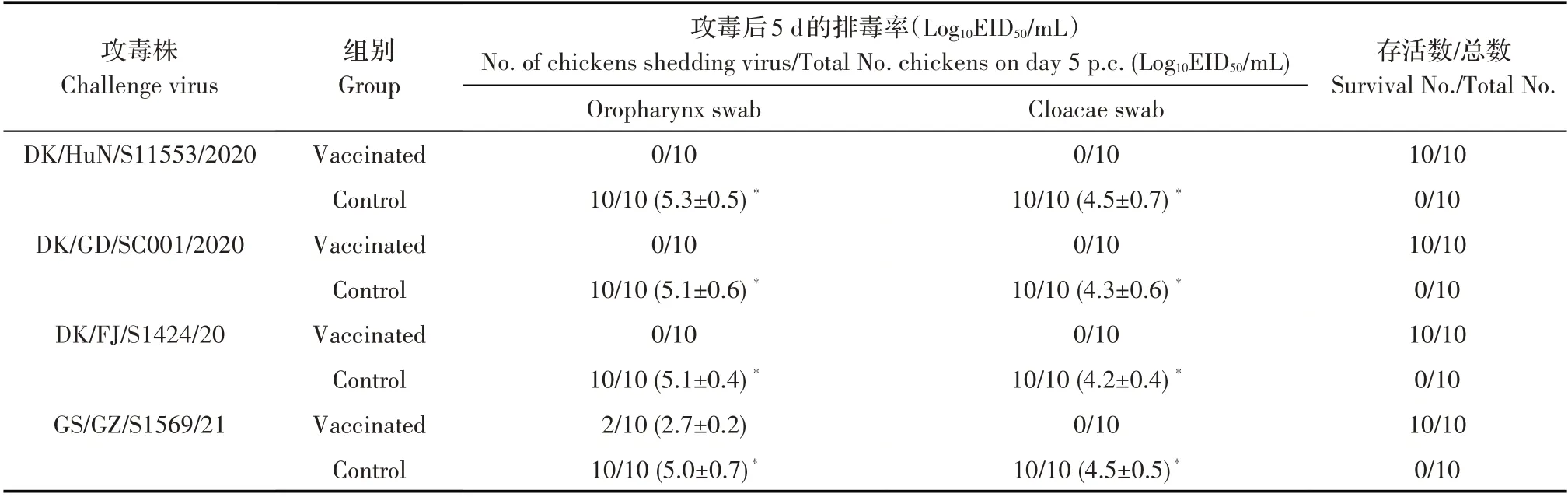
表2 SPF鸡接种疫苗3周后攻击H5N6亚型AIV的排毒和存活结果Table 2 Survival and virus shedding after challenging with H5N6 viruses in SPF chickens at 3 weeks post vaccination
2.3 疫苗对H5N8 亚型AIV 的免疫效力评估
2.3.1 各组鸡HI 抗体的检测结果 疫苗接种后3 周,检测所有鸡血清中针对疫苗株及攻毒株的HI 抗体。结果显示,免疫组鸡血清中针对H5 亚型Re-11 株和Re-12 株疫苗抗原的平均HI 抗体效价分别为8.0log2和8.5log2,针对攻毒株WS/SX/4-1/20(H5N8)的平均HI 抗体效价为3.7log2,与针对Re-11 株和Re-12 株疫苗抗原的平均HI 抗体效价存在4.3log2 和4.8log2 的差异(图1A);对照组鸡血清中针对疫苗抗原和攻毒株的HI 抗体结果均为阴性,表明鸡接种现用H5+H7三价疫苗后可产生针对疫苗株高水平的H5 亚型AIV HI 抗体,而针对H5N8 亚型变异株的HI 抗体水平相对较低。
2.3.2 免疫攻毒效力试验结果 各组鸡接种H5+H7 三价疫苗3 周时,均攻击WS/SX/4-1/20(H5N8)株,并观察其临床症状和攻毒后5 d 的排毒情况。结果显示,在攻毒后的14 d 观察期内,对照组鸡在攻毒后4 d 内全部发病死亡,免疫组鸡均无发病和死亡(图1C);对照组鸡在攻毒后死亡时,喉头和泄殖腔拭子病毒分离结果均为阳性,病毒滴度在3.8log10EID50~5.8log10EID50;3/10的免疫组鸡攻毒后5 d的喉头拭子样品检测到低水平的病毒复制(2.5log10EID50~2.8log10EID50)(图1B),而泄殖腔拭子样品检测结果均为阴性,表明鸡接种H5+H7 三价疫苗可对免疫鸡提供抵抗高致病性H5N8 病毒攻击的能力,但不能完全阻止病毒复制。

图1 H5+H7三价疫苗免疫对H5N8亚型AIV攻击的免疫效力试验结果Fig.1 The protection efficacy of the trivalent inactivated H5/H7 avian influenza vaccine against H5N8 virus
2.4 疫苗对H7N9 亚型AIV 的免疫效力评估
2.4.1 HI 抗体检测结果 疫苗接种后3 周,检测所有鸡血清中针对疫苗株抗原及攻毒株抗原的HI 抗体。结果显示,免疫组鸡血清中针对H7 亚型H7-Re3株抗原的平均HI 抗体效价为7.8log2,针对CK/YN/SD024/21(H7N9)株的平均HI 抗体效价为4.0log2,与针对H7-Re3 株疫苗抗原的抗体存在3.8log2 的差异(图2A);对照组鸡血清中针对疫苗株抗原和攻毒株的HI 抗体结果均为阴性,表明鸡接种现用H5+H7 三价疫苗后可产生针对疫苗株高水平的H7 亚型AIV HI抗体,而针对CK/YN/SD024/21(H7N9)变异株的HI抗体效价与疫苗株相比显著降低。
2.4.2 免疫攻毒效力试验结果 接种疫苗3 周时,所有鸡攻击CK/YN/SD024/21(H7N9)株,并观察其临床症状和攻毒后5 d 的排毒情况。结果显示,在攻毒后14 d的观察期内,对照组鸡在攻毒后4 d内全部发病死亡,免疫组鸡均无发病和死亡(图2C);对照组鸡在攻毒后死亡时,喉头和泄殖腔拭子的病毒分离结果均为阳性,病毒滴度在3.5log10EID50~5.3log10EID50;免疫组鸡攻毒后5 d喉头和泄殖腔拭子样品的病毒检测结果均为阴性(图2B),表明鸡接种H5+H7三价疫苗可以对免疫鸡提供抵抗高致病性H7N9抗原变异株攻击的能力。

图2 H5+H7三价疫苗免疫对H7N9亚型AIV攻击的免疫效力试验结果Fig.2 The protection efficacy of the trivalent inactivated H5/H7 avian influenza vaccine against H7N9 virus
3 讨 论
AIV 极易通过变异或重组而产生新型病毒,给HPAI 的防控带来持续挑战。病原学跟踪监测、疫苗的研制和评估对AI 的防控至关重要。国家禽流感参考实验室在我国农业农村部畜牧兽医局指导和全国各地动物疫病防控机构的支持下,每年从全国各地家禽及野鸟中采集大量样品,分离到一系列AIV 并进行系统分析,筛选出对动物和人具有重大危害的病毒,将其研制疫苗并应用,已经在我国HPAI 防控中发挥了关键作用[5]。如2013 年我国出现人H7N9 流感疫情时,国家禽流感参考实验室及时在家禽中追溯到H7N9 病毒,并持续跟踪监测其流行和进化,及时创制疫苗并大规模应用,成功控制了家禽和人H7N9 流感疫情[5,9-12]。二十世纪末,H5N1 亚型AIV 被人们熟知,其作为单一NA 亚型的H5 病毒危害家禽和人类健康,而二十一世纪以来H5N2、H5N3、H5N6、H5N8、H5N9 等新型AIV 相继出现并危害家禽养殖业[1]。本研究使用的H5N6、H5N8 亚型病毒株均为近期在野鸟或家禽中监测到,表明不同H5 亚型AIV 在野鸟和未免疫家禽中的流行和传播,值得持续关注和深入研究。
HPAIV 在自然界进化中常常发生抗原变化,导致原有疫苗保护力下降,但AI 疫苗对同种HA 亚型HPAIV 所致的AI 并未完全失去免疫预防作用,仍可显著减轻家禽的临床症状,从而降低甚至避免重大经济损失。Yin 等的最新研究表明,我国家禽使用H7N9 亚型H7-Re1 株HPAI 灭活疫苗以来,H7N9 病毒仍然在我国部分省份的鸡群中存在并进化,由于病毒HA 基因的糖基化致其抗原变异,原有的H7-Re2 株疫苗尽管对新出现的H7N9 抗原变异株的攻击不能完全阻止病毒复制,但免疫鸡攻毒后无临床症状且全部健活,而未接种疫苗鸡全部发病、死亡[13]。本研究结果表明,尽管使用的H5N6、H7N9 和H5N8亚型AIV 攻毒株与疫苗株之间存在抗原差异,现有H5+H7 三价疫苗免疫鸡在攻毒后仍然可以获得临床保护,无明显临床症状,并可有效阻止多数抗原变异株在鸡体内的复制,仅有个别分离株攻毒的免疫鸡喉头出现低水平的病毒复制,而阴性对照组鸡在攻毒后全部死亡,表明现有H5+H7 三价疫苗仍可对免疫鸡提供抵抗H5N6、H5N8 和H7N9 病毒的攻击能力。
鉴于我国野鸟和家禽中已出现H5N8、H5N6 和H7N9 亚型AIV 抗原变异株,针对抗原变异株的监测和与抗原匹配疫苗的储备研究是当前HPAI 防控研究的重点。针对抗原变异株的新型H5+H7 禽流感三价灭活疫苗(H5-Re13 株+H5-Re14 株+H7-Re14 株)已于2022 年1 月批准应用[13],但对于家禽养殖者而言,科学使用现有疫苗仍很重要。尤其是在HPAI 高发的冬春季节,养殖者应加强现有H5+H7 三价疫苗的使用,以保持现地家禽较高水平的H5 和H7 亚型AIV HI 抗体水平,同时,还要加强生物安全防控措施的制定,这对于有效预防当前出现的H5 和H7 亚型抗原变异株、降低家禽及人的感染和发病风险至关重要。本研究及时评估了现用疫苗对近期在野鸟或家禽中分离到的H5N6、H5N8 和H7N9 亚型AIV 的免疫保护效力,为现有疫苗的应用和疫苗种毒更新提供了科学参考依据。
