大口黑鲈虹彩病毒TaqMan荧光定量PCR检测方法的建立与应用
2022-07-11巩金鹏潘晓艺蔺凌云姚嘉赟尹文林刘忆瀚沈锦玉1
巩金鹏,潘晓艺,蔺凌云,姚嘉赟,黄 雷,尹文林,刘忆瀚,沈锦玉1,*
(1.浙江海洋大学水产学院,浙江 舟山 316022;2.浙江省淡水水产研究所农业农村部淡水渔业健康养殖重点实验室/浙江省鱼类健康与营养重点实验室,浙江 湖州 313001)
大口黑鲈是我国淡水养殖鱼类中养殖规模发展最迅速的品种之一,具有生长快、肉质鲜美和无肌间刺等优点,受到广大消费者的欢迎[1]。随着养殖规模、密度和苗种流通的不断扩大,多种疾病在养殖大口黑鲈中频发,涵盖了病毒性疾病、细菌性疾病和寄生虫病[2],其中大口黑鲈虹彩病毒(Largemouth bass ranavirus,LMBV)是最为主要的病毒性疾病病原之一[3]。主要衣壳蛋白(Major capsid protein,MCP)是虹彩病毒的主要结构蛋白,其基因序列高度保守,在反映不同虹彩病毒的亲缘关系中具有重要作用,因此将该基因作为研究虹彩病毒分子进化的依据[4-5]。根据MCP 基因序列进化树分析,LMBV 被归为蛙虹彩病毒属第5 大类桑蒂-库珀蛙虹彩病毒组(Santee-cooper ranavirus,SCRV)的一个种[6],SCRV病毒组包含了LMBV、裂唇鱼病毒(Doctor fish virus,DFV)、孔雀鱼病毒6 型(Guppy virus 6,GV-6)和鳜鱼蛙虹彩病毒。由LMBV 引起的疾病最早于1995 年在美国被报道[7],而国内2008 年在广东顺德地区养殖的大口黑鲈也大面积暴发了该病,此后在广东其他地区以及浙江等地也有报道,并造成较大的经济损失[8]。LMBV 不仅能感染大口黑鲈,还可感染其他鱼类如鳜鱼(Siniperca chuatsi)和乌鳢(Ophicephalus argus),有些物种呈潜伏感染[9-10]。感染LMBV 而发病的大口黑鲈,典型的症状表现为体表局部溃疡,肝脾肿大,肝脏发白发黄[11]。人工感染LMBV 的大口黑鲈,第4 d 出现体色发黑,活力下降,腹部膨大[12]。但是即使出现以上症状,也不能判定是LMBV引起的,因为真菌感染也会造成体表溃疡,某些细菌感染也会造成肝脏肿大发白,这给LMBV 感染的诊断带来了困难。目前,针对LMBV 引起的疾病还无有效药物,现阶段主要以预防或切断病原传播途径为主[13]。因此迫切需要一种准确快速检测LMBV 的方法以用于无LMBV 苗种筛选。
现有的LMBV 检测方法主要包括病毒分离[14-15]、常规PCR[13,16]、环介导等温扩增(LAMP)[17]和荧光定量PCR[18-19]。病毒分离需要细胞培养和防污染操作要求,所需时间长,基层检测机构无法满足该要求[20]。常规PCR 是最常用的检测工具,但因为检测过程中的扩增产物常常要暴露于环境中,易造成环境的核酸污染,易出现假阳性结果,并且无法进行病毒定量,不能确定疾病的发生程度。相比常规PCR,荧光定量PCR 具有特异性强、敏感性高、数据分析简单和快速等特点,并具有不开盖检测的优点。虽然已有针对LMBV 荧光定量PCR 方法的报道,但存在阴性Ct 值过低,易产生假阳性,也有存在灵敏度不高的缺点[18-19]。本研究以LMBV 的MCP 基因为靶基因,建立了一种特异性强、敏感性更高的TaqMan 荧光定量PCR 方法,用于携带LMBV 大口黑鲈苗种的筛查和LMBV 监测与流行病学调查。
1 材料与方法
1.1 主要实验材料 鲤上皮瘤细胞(EPC,ATCC:CRL-2872)在添加10%的新生牛备清和100 U/mL 青霉素、100 μL/mL 链霉素的M199 培养基中24 ℃培养。传染性脾肾坏死病毒(ISKNV)、大口黑鲈弹状病毒(MSRV)、神经坏死病毒(NNV)、鲤春病毒血症病毒(SVCV)、草鱼呼肠弧病毒(GCRV)、传染性造血器官坏死病毒(IHNV)和LMBV LY20709 株(在EPC中24 ℃进行培养增殖,并于-80 ℃保存)均由本实验室保存;大口黑鲈购自浙江省湖州市某规模化养殖场,经病毒检测和细菌分离确认无病原后,于循环水养殖桶中暂养。新生牛血清购自内蒙古金源康生物工程有限公司;M199 培养基购自美国Gibco 公司,青霉素、链霉素和PBS 购自北京索莱宝科技有限公司;2×Flash Hot Start MasterMix(Dye)购自康为世纪生物科技股份有限公司;pMDTM19-T Vector Cloning Kit 购自宝生物工程(大连)有限公司;质粒小提试剂盒和2×SuperReal PreMix(Probe)购自天根生化科技(北京)有限公司;核酸提取试剂盒(磁珠法)购自洛阳爱森生物科技有限公司。
1.2 引物和探针的设计与合成 根据LMBV 的基因组序列(FR682503),利用软件Primer Premier 5 设计用于制备质粒标准品的MCP 引物(MCP-1500-F/R);以LMBV LY20709 株MCP 的基因序列与裂唇鱼病毒(FR677324)、孔雀鱼病毒6 型(FR677325)、鳜鱼蛙虹彩病毒(MG941005)和锦鲤蛙病毒(KJ939444)的MCP基因序列进行比对,选取保守区,设计用于TaqMan荧光定量PCR 的引物(q-MCP-102F/R)和探针(q-MCP-102P)以及常规PCR 引物(LMBV-288-F/LMBV-535-R)[16],均由上海生工生物工程技术服务有限公司合成(表1)。
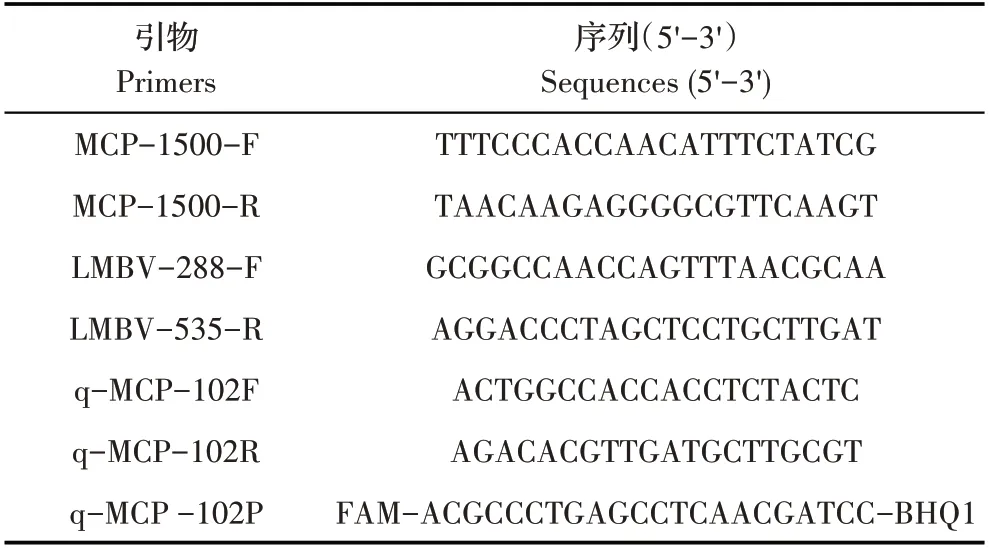
表1 引物及探针序列Table 1 Sequences of primers and TaqMan probe
1.3 病毒核酸提取 采用磁珠法全自动核酸提取纯化仪搭配核酸提取试剂盒(磁珠法),提取1.1 中各病毒DNA/RNA,用NanoDrop2000 超微量分光光度计测定病毒DNA/RNA 浓度和纯度后,将RNA 反转录为cDNA 与病毒DNA 均于-80 ℃保存用于后续试验。
1.4 重组质粒标准品的制备 以提取的LMBV LY20709 株DNA 为模板,采用引物MCP-1500-F/R 进行PCR 扩增MCP 片段,反应体系为25 μL,包括2×Flash Hot Start MasterMix(Dye)12.5 μL,MCP-1500-F/R(10 μmol/L)各1 μL,模板1.5 μL,ddH2O 9 μL。反应条件:95 ℃5 min;98 ℃10 s、58 ℃10 s、72 ℃30 s,35 个循环;72 ℃5 min。扩增产物纯化回收后测序鉴定。采用pMDTM19-T Vector Cloning Kit 将MCP片段克隆于pMD19-T 载体,转化DH5α 感受态细胞,经菌落PCR 鉴定后,选取阳性质粒由上海生工生物工程技术服务有限公司测序。阳性重组质粒命名为pMD-LMBV-MCP,采用质粒小提试剂盒提取质粒DNA,利用NanoDrop2000 超微量分光光度计测定重组质粒的浓度和纯度,并计算质粒拷贝数。
1.5TaqMan 荧光定量PCR 反应条件的优化 参照2×SuperReal PreMix(Probe)试剂盒操作说明建立20 μL反应体系,采用矩阵法[21]优化引物q-MCP-102F/R(10 μmol/L)(终浓度在200 nmol/L~500 nmol/L)和探针q-MCP-102P(10 μmol/L)(终浓度在100 nmol/L~400 nmol/L),其他2×SuperReal PreMix(Probe)10 μL,DNA 模板1 μL,50×ROX Reference Dye 0.2 μL,ddH2O补足至20 μL。利用Mx3005P 荧光定量PCR 仪进行扩增,程序为两步法:预变性95 ℃15 min;95 ℃3 s、58℃~62 ℃优化退化温度32 s,40 个循环。
1.6 标准曲线的建立 将pMD-LMBV-MCP 质粒标准品稀释为4.6×1010拷贝/μL~4.6×100拷贝/μL 11 个浓度,作为模板。采用优化的反应体系和反应条件进行TaqMan 荧光定量PCR 扩增,每个浓度设置3 个重复,以质粒拷贝数为横坐标,Ct 值为纵坐标绘制标准曲线。
1.7 特异性试验 以1.3 提取的各病毒DNA 或cDNA为模板,利用建立的TaqMan 荧光定量PCR 方法进行检测,评价其特异性。
1.8 敏感性试验 以10 倍倍比稀释的pMD-LMBVMCP 质粒标准品(4.6×108拷贝/μL~4.6×100拷贝/μL)作为模板,利用建立的TaqMan 荧光定量PCR 方法进行检测。由于目前该病原尚无国家推荐的检测方法,本实验采用已报道的常规PCR 方法[16]同时对上述质粒标准品进行扩增,比较和分析两种方法的敏感性。
1.9 重复性试验 取3 个不同浓度(4.6×107拷贝/μL、4.6×106拷贝/μL、4.6×105拷贝/μL)的pMD-LMBVMCP 质粒标准品,利用建立的TaqMan 荧光定量PCR扩增,每个浓度重复3 次,进行组内重复性分析,将上述3 个浓度的质粒标准品在3 次不同的时间点重复3 次上述扩增,进行组间重复性分析[22]。根据每一次试验的Ct 值,计算其标准偏差(s)和变异系数(CV),用以评估该方法的重复性和稳定性。
1.10TaqMan 荧光定量PCR 检测方法的应用
1.10.1 临床样品的检测 选取2020 年10 月~2021 年4 月来自浙江和江苏的待检大口黑鲈组织样品30 份,取脾和肾组织经常规处理后按照1.3 的方法提取组织总DNA,利用建立的TaqMan 荧光定量PCR 进行检测。由于目前该病原尚无国家推荐的检测方法,本实验采用文献[16]报道的常规PCR 方法同时进行检测,并对阳性样品测序鉴定。计算两种方法的检出率,同时验证方法的可靠性。
1.10.2 大口黑鲈主要组织器官病毒载量的检测 选取10±2 g 的健康大口黑鲈15 条,将LMBV LY20709株病毒液按0.1 mL/尾腹腔注射大口黑鲈,在感染后第5 d取5尾大口黑鲈,分别采集其脑、脾、中肾、头肾、肝、肠、鳃、胃、肌肉、心脏和鳍条,各取部分组织,液氮研磨后,按照1.3 方法提取各组织总DNA并测定DNA 浓度后作为模板,利用建立的TaqMan 荧光定量PCR 检测,根据获得的标准曲线计算病毒载量,比较LMBV 在不同组织中的分布情况。
2 结 果
2.1 重组质粒标准品的构建与鉴定 采用T-A 克隆方法将从LMBV LY20709 株中扩增获得的MCP 基因克隆于pMD19-T 载体中,获得重组质粒pMD-LMBVMCP,经测序,克隆片段长度约1 500 bp,序列与FR682503 一致(图1)。经分光光度计测定重组质粒pMD-LMBV-MCP DNA 浓度为212 ng/μL,换算成拷贝数浓度为4.6×1010拷贝/μL。

图1 重组质粒标准品的PCR鉴定结果Fig.1 PCR identification results of recombinant plasmid standards
2.2TaqMan 荧光定量PCR 条件优化及标准曲线的建立 经引物浓度、探针浓度和退火温度的优化,建立了LMBV MCPTaqMan 荧光定量PCR 方法。其反应体系为20 μL,包括2×SuperRealPreMix(Probe)10 μL,q-MCP-102F/R(10 μmol/L)各0.6 μL(终浓度300nmol/L) , q-MCP-102P (10μmol/L)0.4 μL(终浓度200 nmol/L),DNA 模板1 μL,50×ROX Reference Dye 0.2 μL,RNase-free ddH2O 7.2 μL。反应条件为预变性95 ℃15 min;95 ℃3 s、60 ℃32 s,40 个循环。
以不同浓度(4.6×1010拷贝/μL~4.6×100拷贝/μL)的pMD-LMBV-MCP 质粒标准品为模板,进行Taq-Man 荧光定量PCR,建立标准曲线(图2)。结果显示标准曲线在4.6×108拷贝/μL~4.6×102拷贝/μL 与Ct 值之间具有良好的线性关系,标准曲线拷贝数计算公式为Y=-3.341×lg(X)+41.01,相关系数R2为1,扩增效率为99.2%。

图2 LMBV TaqMan荧光定量PCR标准曲线(A)及扩增曲线(B)Fig.2 Standard curve(A)and amplification curve(B)of LMBV TaqMan qPCR
2.3 特异性试验结果 采用建立的TaqMan 荧光定量PCR 方法对ISKNV、LMBV、MSRV、NNV、SVCV、GCRV 和IHNV 进行检测,结果显示ISKNV、MSRV、NNV、SVCV、GCRV、IHNV 和阴性对照均未出现扩增曲线,仅样品LMBV LY20709 株出现扩增曲线(图3),表明该方法可特异检测出LMBV。

图3 特异性试验结果Fig.3 Specific results
2.4 敏感性试验结果 以稀释成不同浓度(4.6×108拷贝/μL~4.6×100拷贝/μL)的pMD-LMBV-MCP 质粒标准品为模板,分别进行TaqMan 荧光定量PCR 和常规PCR 的敏感性试验。结果显示TaqMan 荧光定量PCR 方法的最低检出限为4.6×10 拷贝/μL(图4A),而常规PCR 检出限为4.6×103拷贝/μL(图4B)。Taq-Man 荧光定量PCR 检测方法比常规PCR 敏感性高100倍,表明建立的TaqMan 荧光定量PCR 检测方法敏感性更高。

图4 TaqMan荧光定量PCR(A)和常规PCR(B)灵敏度比较Fig. 4 Comparison of the sensitivities of TaqMan qPCR(A)and conventional PCR(B)assay
2.5 重复性试验结果 将pMD-LMBV-MCP 质粒标准品稀释成4.6×107拷贝/μL~4.6×105拷贝/μL 作为模板,采用TaqMan 荧光定量PCR 进行组内和组间重复性试验,结果显示,组内变异系数和组间变异系数均小于2.5%(表2)。表明该检测方法的重复性和稳定性均较好。
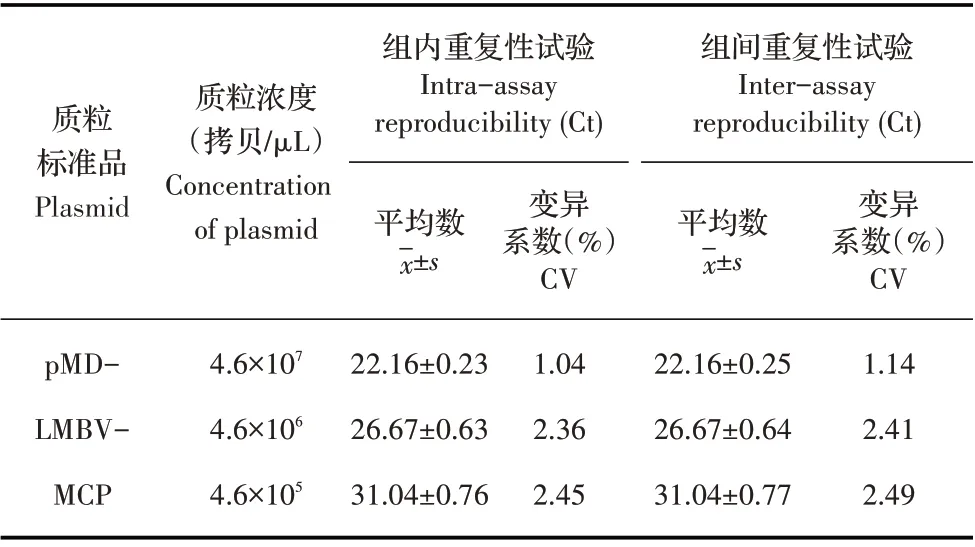
表2 TaqMan荧光定量PCR重复性试验结果Table 2 TaqMan qPCR intra-assay and inter-assay reproducibilities analysis results
2.6TaqMan 荧光定量PCR 和常规PCR 检测大口黑鲈样品
2.6.1 临床样品检测结果 利用TaqMan荧光定量PCR和常规PCR 对30 份送检样品进行检测,结果显示,TaqMan 荧光定量PCR 阳性检出率为40%(12/30),优于PCR 阳性检出率13.3%(4/30)。表明该方法敏感性更高,可用于临床样品的检测。
2.6.2 大口黑鲈主要组织器官病毒载量的检测 对人工感染LMBV 的大口黑鲈采集样品(脑、脾、中肾、头肾、肝、肠、鳃、胃、肌肉、心脏和鳍条)进行TaqMan 荧光定量PCR,结果显示各器官中均含有不同载量的病毒,病毒载量为2.01×104拷贝/μg~1.33×108拷贝/μg。且胃、肝、肠、脾和心脏LMBV 含量高于其他组织(图5)。表明本研究建立的TaqMan 荧光定量PCR 方法可用于该病毒的定量检测。
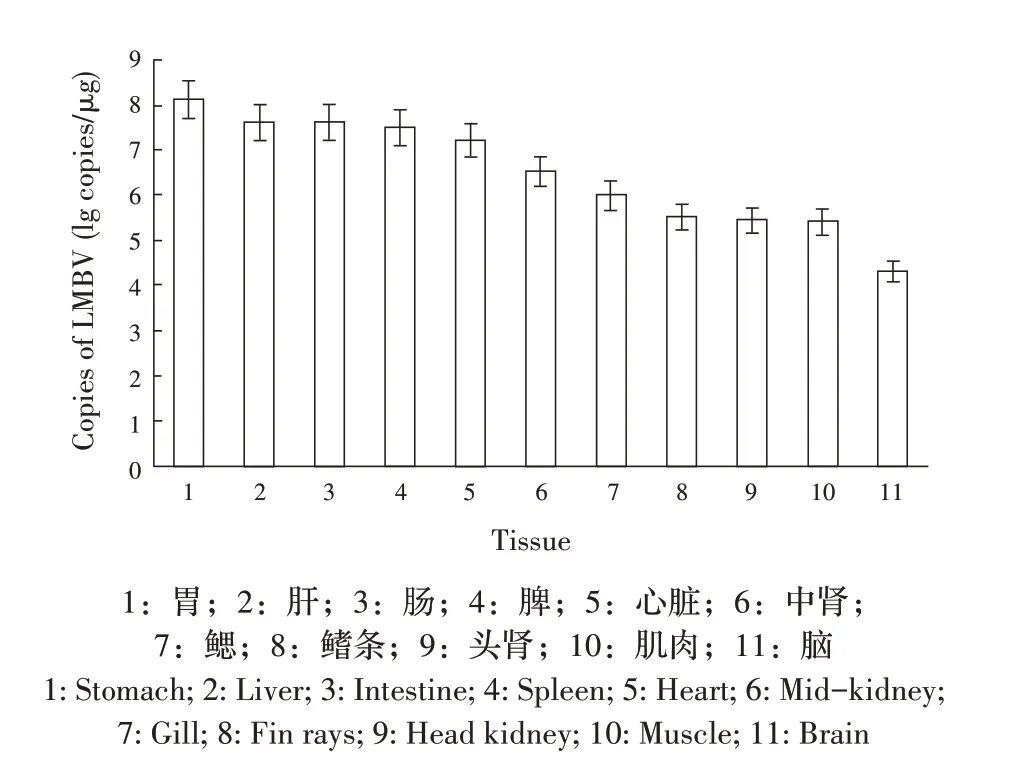
图5 LMBV感染组织分布Fig.5 Distribution of LMBV infected tissues
3 讨 论
在2008 年广东顺德地区发生LMBV 病之后报道逐渐增多,并成为制约大口黑鲈产业健康发展的重要疫病之一[23-24]。LMBV 病在水温25 ℃~30 ℃的夏季最易发生,主要危害成鱼,致死率极高[3,24]。目前无LMBV 的特效药物,主要以预防和切断传播途径为主,一旦暴发疾病,将造成重大的经济损失。因此,建立敏感、特异、快速简便的LMBVTaqMan 荧光定量PCR 方法十分必要。
MCP 基因是虹彩病毒最为保守的基因[25-26],本研究针对蛙病毒属SCRV 病毒组中所有病毒的MCP序列比对后设计荧光定量PCR 引物q-MCP-102F/q-MCP-102R 和探针q-MCP-102P,设计的引物探针与SCRV 病毒组中所有种类的病毒靶标区均一致。本研究结果显示,本研究建立的TaqMan 荧光定量PCR 方法最低检测限为4.6×10拷贝/μL,比普通PCR方法敏感性高100 倍[16],并且对ISKNV、MSRV、NNV、SVCV、GCRV 和IHNV 均无交叉反应。而Getchell 等针对MCP建立的荧光定量PCR检测方法,在3.8×10拷贝/μL的质粒标准品中检测率为97%,出现漏检,在更高拷贝数下检测率为100%[18];马冬梅等建立的LMBV 荧光定量检测方法判定为阳性的Ct 值过低(阳性判定为Ct 25)[19],并且特异性检测仅选择ISKNV 一种病毒作为对比,无法说明该方法的特异性,该方法选取的靶标为DNA 甲基转移酶基因(MTase),MTase 基因在SCRV 病毒组中并不是最为保守的基因[27],不同LMBV株间MTase基因仅有96.35%的同源性。
通过建立的TaqMan 荧光定量PCR 方法对人工感染LMBV 的大口黑鲈内脏组织进行病毒载量测定,发现其胃、肝、肠、脾和心脏的病毒载量高于其他组织,其中胃组织中病毒载量最高,脑中病毒载量最低。而Benjamin 等通过LMBV 浸泡感染实验发现,受感染的大口黑鲈内脏组织病毒载量较高的器官是鱼鳔、鳃和中肾[28],Getchell等浸泡感染试验也显示鱼鳔的病毒载量最高,但鳃中病毒含量却不高[18]。本实验检测结果与上述实验结果不一致,可能与LMBV人工感染方法不一样有关。本研究建立的高灵敏度方法可以用于低病毒载量组织部位的病毒定量测定。
综上,本研究建立的TaqMan 荧光定量PCR 方法对LMBV 检测具有重要的意义,可用于临床LMBV 病的筛查,也可用于对大口黑鲈受精卵、仔鱼和稚鱼疾病的早期诊断,这为减少LMBV 的危害和早期预防提供了一种可靠稳定的检测手段。
