牛呼吸道合胞体病毒G蛋白特异性核酸适配体的筛选及初步应用
2022-07-11甄思慧程如楠宋想胜张永红
甄思慧,程如楠,宋想胜,李 磊,张永红,王 真
(北京农学院动物科学技术学院/兽医学(中兽医)北京市重点实验室,北京 102206)
牛呼吸道合胞体病毒(Bovine respiratory syncytial virus,BRSV)是一种牛养殖中常见的呼吸道病原,可引起牛的急性、热性呼吸道传染病[1]。BRSV 首次于上世纪70 年代在瑞士患有呼吸道疾病的牛机体中分离得到[2],我国在2007 年首次从黑龙江某牛场牛的鼻汁中分离到该病毒[3]。由该病毒引起的牛呼吸道疾病在世界范围内流行[4],危害性较大,不仅引起牛严重的呼吸道感染,还能影响犊牛的生长发育,使肉牛增重减缓,以及乳牛泌乳量显著下降,15 月龄~18 月龄牛发病率高达80%~100%,在一些牛场急性感染牛的死亡率可达20%[5]。
BRSV 基因组含有10 个基因,编码11 个蛋白质,包括NS1、 NS2、 N、 P、 M、 SH、 G、 F、 M2-1、M2-2、L[6]。其中G 蛋白是病毒囊膜的主要成分之一。G 蛋白为N-和O-糖基化的II 型糖蛋白,其基因大小774 bp,编码257 个氨基酸,包括N-端的胞浆区、疏水的锚定区和外功能区[7]。G 蛋白是病毒主要的吸附蛋白,G 蛋白的特异性抗体可以阻止病毒与细胞的结合[8],同时G 蛋白也是BRSV 的主要保护性抗原之一[9],能使宿主产生特异性免疫反应、诱导嗜酸性粒细胞的增殖,以抵抗病毒的感染[10]。此外,有研究证明,在感染BRSV 1 d 后,大部分G 蛋白以分泌蛋白形式表达[11]。因此,G 蛋白常被用作该病原的检测抗原。感染早期的准确检测是防控该病的关键。目前,BRSV 的检测方法有细胞分离培养鉴定、免疫荧光技术、中和试验、酶联免疫吸附试验(ELISA)、RT-PCR 和荧光定量PCR 等[12],这些方法分别存在检测时间长、准确性低、特异性不强、成本高和对抗原保存要求高等各类问题[13]。
指数富集配体系统进化技术(Systematic evolution of ligand by exponential enrichment,SELEX)是一种能获取与靶物质特异结合的寡核苷酸筛选技术,筛选得到的单链DNA 或RNA 分子称为核酸适配体(Aptamer)。核苷酸不仅有储存和传递遗传信息的作用,还可以通过自身特有的空间结构与其他分子相互作用。在适宜条件下,单链DNA 或RNA 分子会发生适应性折叠,形成发夹、凸环、四分体等结构,从而与靶物质紧密结合。与抗体相比,适配体可以人工合成和修饰[14],且具有强特异性、高亲和力、高稳定性、低免疫原性、低分子量、易于合成等特点[15],在检测领域已经得到了广泛的应用。
本研究经原核表达并纯化了BRSV G 蛋白,进一步利用SELEX 筛选G 蛋白的特异性核酸适配体,为牛呼吸道合胞体抗原或抗体的酶联适配体检测方法的建立奠定基础。
1 材料与方法
1.1 主要实验材料 重组G 蛋白表达载体(pET28a-G)由本实验室构建和保存;BL21 和DH5α 感受态细胞均购自北京全式金生物技术有限公司;初始寡核苷酸文库序列:5'-TAGGGAATTCGTCGACGGATCC-(N)40-CTGCAGGTCGACGCATGCGCCG-3',N 表示A或G 或C 或T,由上海生工生物工程技术服务有限公司合成;BioTeke 短片段DNA 胶回收试剂盒、高纯度质粒小量快速提取试剂盒、琼脂糖凝胶纯化回收试剂盒、零背景pTOPO-TA Simple 克隆试剂盒和PCR试剂均购自北京艾德莱生物科技有限公司;His 标签可溶性蛋白纯化试剂盒购自康为世纪生物科技有限公司;辣根过氧化物酶标记链霉亲和素(HRP-SA)购自北京博尔西科技有限公司;BCA 试剂盒购自南京凯基生物科技发展有限公司;本研究所用血清均由本实验室临床采集并保存;BRSV 商品化ELISA 试剂盒购自比利时Bio-X 诊断公司;根据BRSV 基因序列(NC001989)设计G 蛋白编码基因特异性引物,引物序列见表1。

表1 引物序列Table 1 Primer sequences
1.2 重组G 蛋白的表达及纯化 将pET28a-G 转化到BL21 感受态细胞中,在带含卡那抗性的LB 液体培养基中培养至OD600nm为0.6 时,加入IPTG 诱导表达,表达产物经SDS-PAGE 检测。再将诱导表达的重组蛋白利用Ni 亲和层析柱进行纯化,纯化后用BCA 试剂盒检测蛋白浓度。
1.3 G 蛋白适配体的筛选 将终浓度为150 μg 的G蛋白以100 μL/孔包被于微孔板中,4 ℃过夜;次日用含0.05% Tween-20 的HEPES 300 μL/孔洗涤微孔板3 次;再加入含1% BSA 的HEPES 液,200 μL/孔,37 ℃封闭2 h;HEPEST 洗板后,每孔加入100 μL 初始寡核苷酸文库孵育1 h;再经HEPEST 洗涤后加核酸洗脱液,80 ℃作用10 min;采取酚抽提法提取洗脱液中的核酸适配体;最后对提取的核酸适配体分别进行一轮对称和非对称PCR 扩增(对称PCR 体系为:2×Mix 25 μL,WZ-02 1 μL,WZ-04 1 μL,适配体3 μL,去离子水20 μL;反应程序为95 ℃10 min,95 ℃20 s、65 ℃20 s、72 ℃30 s、72 ℃5 min,共15 个循环。非对称PCR 体系为2×Mix 25 μL,WZ-02 1 μL,WZ-04 0.02 μL,适配体5 μL,去离子水19 μL,反应程序与对称PCR 一致,但循环设为28 次)。利用Bioteke 短片段DNA 胶回收试剂盒收集纯化的适配体。为避免筛选到与微孔板和BSA 非特异结合的核酸适配体,从第5 轮起开始反筛,在包被G 蛋白的同时设置无G 蛋白包被的反筛孔,其他步骤不变。
1.4 核酸适配体库的结合率测定 依据实验室前期相关实验结果得出,适配体筛选至11 轮时与G 蛋白结合率趋于稳定。11 轮筛选结束后,使用生物素标记的WZ03 引物对第5 轮、第9 轮、第10 轮、第11 轮核酸适配体库进行非对称PCR 扩增,胶回收非对称PCR 产物得到生物素标记的核酸适配体,分别用HEPEST 溶液调整各轮次核酸适配体浓度至200 nmol/L。采用间接酶联适配体法(i-ELAA)测定其与G 蛋白的结合率。具体操作如下:将终浓度为150 μg 的G 蛋白以100 μL/孔包被微孔板中4 ℃过夜;次日再加入含1% BSA 的HEPES 液,37 ℃孵育2 h;经HEPEST 洗涤3 次,加入各轮次核酸适配体37 ℃孵育1 h;HEPEST 洗涤3 次后加入HRP-SA(1:6 000),37 ℃孵育1 h;洗涤微孔板4次后加显色液,37 ℃显色10 min 后;加入终止液2 mol/L H2SO4终止显色;最后用酶标仪读取每孔的OD450nm值。
1.5 核酸适配体序列测定 将最后一轮筛选出的核酸适配体进行一轮对称PCR,得到dsDNA(预期为84 bp),连接pTOPO-TA 载体(预期为160 bp)后利用pTOPO-TA Cloning Kit 转化。将转化产物均匀涂布在含氨苄霉素的LB 固体培养基上,37 ℃过夜培养。挑取白色菌落于1 mL 含氨苄霉素的LB 液体培养基中,37 ℃震荡培养18 h。用pTOPO-TA 载体通用引物对菌液进行PCR 鉴定并提取质粒由铂尚生物技术(上海)有限公司测序。
1.6 i-ELAA 测定核酸适配体的解离常数(Kd 值)选择第11 轮筛选出的重复次数较多且测序正确的适配体,并在5'端标记生物素,采用i-ELAA 测定各适配体的亲和力,具体操作方法同1.4。根据公式Kd=BmaxX/Y-X来计算每条适配体的Kd值。其中,Y代表OD450nm平均值,Bmax 代表最大OD450nm值,X 代表适配体浓度。
1.7 适配体二级结构预测 采用在线核酸结构预测软件MFOLD 分析筛选出各核酸适配体的二级结构,软件网址为:http://mfold.rit.albany.edu。
1.8 间接竞争酶联适配体方法(ic-ELAA)阴阳性临界值的确定 根据Kd 值测定结果选择结合力高的G-13 适配体建立ic-ELAA,采用临床采集的20 份BRSV 阴性血清和20 份阳性血清进行阴阳性临界值的确定。具体操作如下:微孔板在4 ℃下用G 蛋白包被12 h,洗涤微孔板后用1%BSA 封闭,再将50 μL 未稀释的牛血清和50 μL 200 nmol/L DNA 适配体G-13 加入孔中,于37 ℃孵育1 h。加入HRP-SA并在37 ℃孵育1 h。最后读取OD450nm值。利用计算公式确定阻断率(PI)值:PI(%)=(1-样品血清的OD450nm/适配体对照的OD450nm)×100%。临界值PICut-off=阴性血清的平均PI值+2×s(),确保阴性血清的PI值的95%在该范围内。
1.9 ic-ELAA 方法特异性检测 按照1.8 方法对BRSV 病毒、牛冠状病毒、牛传染性支气管炎病毒感染牛的阳性血清及牛阴性血清进行ic-ELAA 试验,以检验ic-ELAA 的特异性。
2.0 临床血清样品的ic-ELAA 检测 通过ic-ELAA
对临床采集的50 份牛血清样品进行检测,与BRSV商品化ELISA 检测试剂盒(Bio-X)进行比较分析。
2 结 果
2.1 重组G 蛋白的表达及纯化 将pET28a-G/BL21诱导表达,对表达蛋白进行纯化,经SDS-PAGE 检测,结果显示,在25 ku~35 ku 处出现目的蛋白条带,与G 蛋白的大小相符,且纯化后的蛋白条带较为清晰、单一(图1),经测定蛋白浓度为1.5 mg/mL。
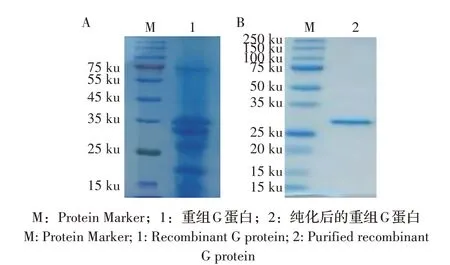
图1 重组G蛋白的诱导表达(A)及纯化(B)结果Fig.1 Expression(A)and purification(B)results of recombinant G protein
2.2 G 蛋白适配体的筛选 利用微孔板法获得每轮筛选循环中的适配体溶液并回收适配体候选物,共筛选了11 轮,利用引物WZ-02 和WZ-04 以回收产物为模板进行PCR 扩增,对称PCR 和非对称PCR 的产物经琼脂糖凝胶电泳检测。结果显示,第5 轮与第10 轮PCR 筛选获得目的条带大小约为84 bp,与预期大小相符(图2)。表明筛选到与G 蛋白结合的适配体。

图2 第5轮(A)与第10轮(B)筛选的核酸适配体PCR扩增结果Fig.2 PCR amplification results of nucleic acid aptamer of round 5(A)and round 10(B)
2.3 核酸适配体库与G 蛋白的结合率测定 采用i-ELAA,利用相同浓度的生物素标记的适配体库与相同浓度的G 蛋白孵育后测定OD450nm值,分别对适配体初始文库、第5 轮、第9 轮、第10 轮、第11 轮获得的适配体与G 蛋白的结合力进行评价。OD450nm值越高,说明适配体与G 蛋白的结合率越高,结合力越强。结果显示,随着筛选次数的增加,适配体与G 蛋白的结合量增多,OD450nm值越来越高。从第11轮开始,OD450nm值不再增加(图3),表明与G 蛋白特异性结合的适配体达到稳定状态。

图3 不同轮次筛选的适配体库的结合率测定结果Fig.3 Binding rate determination results of different rounds of aptamer library
2.4 菌液PCR 鉴定及适配体序列测定 将第11 轮筛选的PCR 扩增产物与pTOPO-TA 载体连接后,转化感受态细胞,涂板挑选100 个转化子增殖培养,100 份菌液样品经PCR 鉴定,结果显示有98 份菌液样品经PCR 扩增出240 bp 左右的与目的条带大小相符的条带(部分PCR 结果见图4)。回收目的条带并测序,共获得98 条适配体,其中有5 条核酸适配体(G-6、G-13、G-39、G-55 和G-72)在测序中频繁出现,分别重复出现5、9、4、12 和8 次(表2),表明这5 条核酸适配体被最大程度地富集,其与G 蛋白特异性结合的可能性最大。
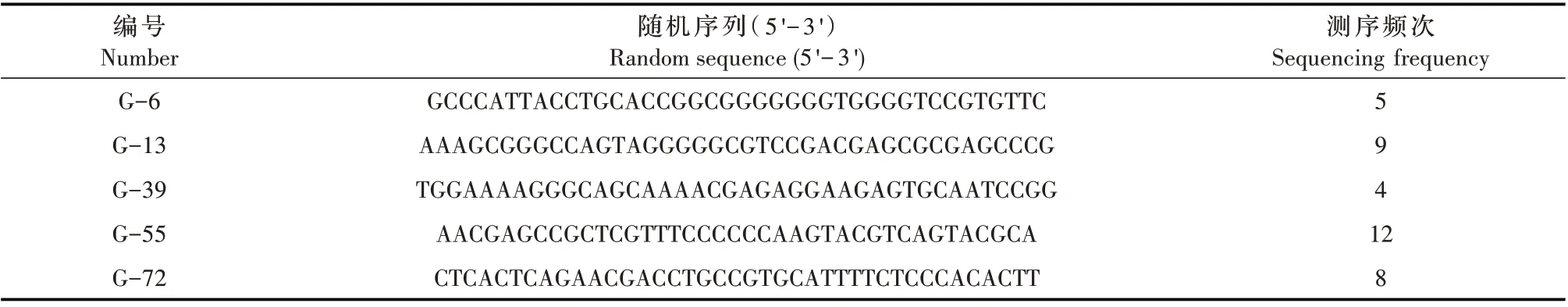
表2 核酸适配体测序结果Table 2 Results of nucleic acid aptamer sequences
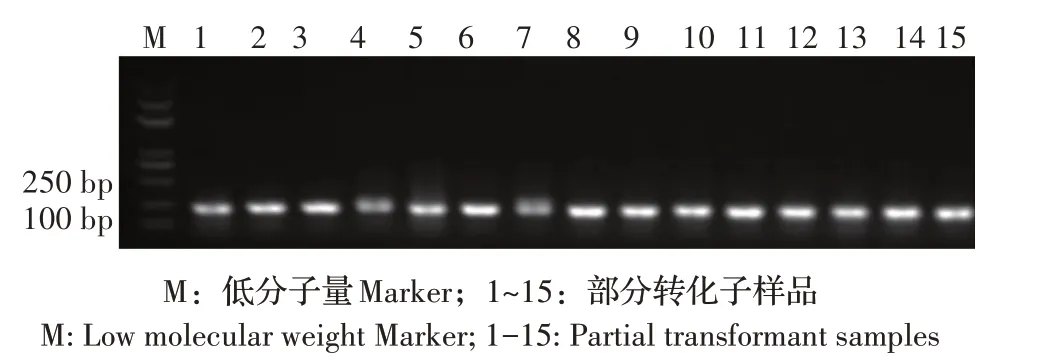
图4 部分阳性转化子菌液PCR鉴定结果Fig.4 Results of partial PCR identified positive transformants
2.5 核酸适配体Kd 值测定 采用i-ELAA 测定G-6、G-13、G-39、G-55 和G-72 适配体的亲和力。利用软件Sigma Plot 10.0 处理数据,根据公式Kd=BmaxX/Y-X 计算得出这5 条核酸适配体的Kd 值分别为34.17±2.1 nmol、 28.33±2.07 nmol、 48.09±1.05 nmol、32.06±2.27 nmol 和25.27±1.34 nmol(图5),其中适配体G-13 和G-72 结合力略高于另外3 条适配体,结果表明5 条适配体的Kd 值均达到纳摩尔级别,符合后续试验要求。

图5 5条核酸适配体的Kd值测定结果Fig.5 Kd results of the five nucleic acid aptamers
2.6 适配体二级结构预测 通过在线网站,预测5条适配体G-6、G-13、G-39、G-55 和G-72 的二级结构。结果显示,5 条核酸适配体均具有稳定的茎环状或发卡状结构,在一定条件下能与靶分子G 蛋白形成稳定的结合(图6)。

图6 利用MFOLD软件预测G-6、G-13、G-39、G-55和G-72的二级结构Fig.6 Predicted secondary structures of G-6,G-13,G-39,G-55,and G-72 using MFOLD software
2.7 ic-ELAA 临界值的确定 利用适配体G-13 建立的ic-ELAA,对20 份阴性血清进行检测,平均PI 值为21.29%,s为5.42。因此,临界值设定为33%(-2s)。如图7 所示,所有阳性血清的PI 值均高于33%。由此表明,临界值为33%时可以清楚地区分BRSV 阴性和阳性血清样品。

图7 40份阴性血清和阳性血清阻断率分布图Fig.7 Percent inhibition profiles of forty negative and positive sera
2.8 ic-ELAA 方法特异性的检测 利用ic-ELAA 对BRSV 病毒、牛冠状病毒、牛传染性支气管炎病毒和牛副流感病毒感染牛的阳性血清以及阴性血清进行检测,结果显示,其PI 值分别为75.32%、15.36%、20.11%、18.52%和16.77%。仅有BRSV 阳性血清PI值大于33%,其余血清PI 值均在临界值以下(图8),表明本研究建立的ic-ELAA 具有良好的特异性。
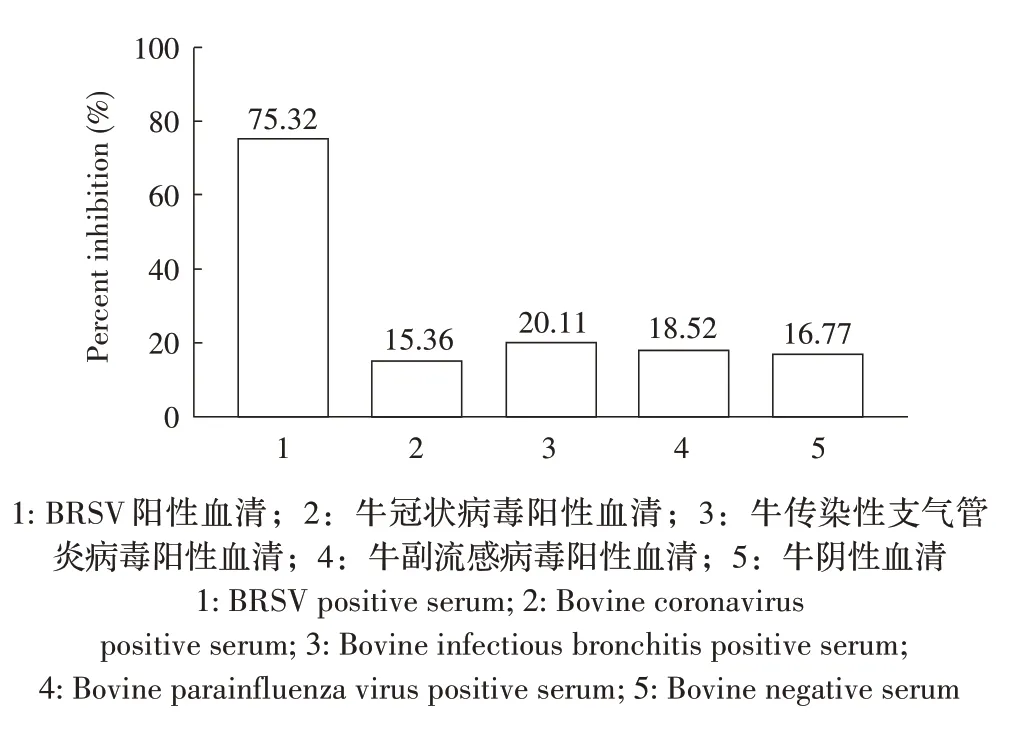
图8 ic-ELAA的特异性试验结果Fig.8 ic-ELAA for different pathogen antisera
2.9 临床牛血清样品的检测 利用本研究建立的ic-ELAA 和商品化ELISA,对临床采集的50 份牛血清样品进行BRSV 抗体检测,结果显示,50 份临床血清样品中,ic-ELAA 检测出阳性样品36 份,商品化ELISA 检测出阳性样品32 份,其中两种方法检测均为阳性的样品32 份,ic-ELAA 与商品化试剂盒的符合率为92%(表3)。相较之下,建立的ic-ELAA 比商品化ELISA 试剂盒阳性检测率稍高,说明筛选出的核酸适配体与BRSV 结合的特异性更强,在牛呼吸道合胞体病检测方面具有应用潜能。
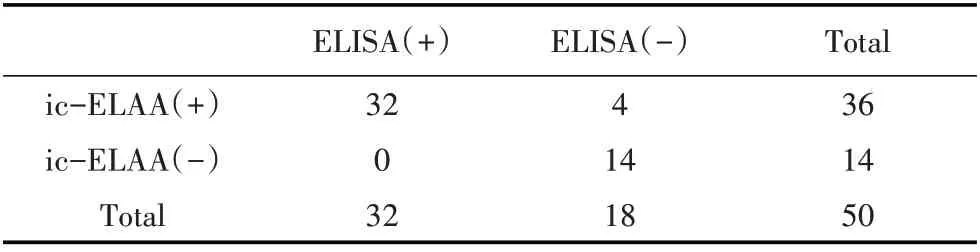
表3 ic-ELAA和商品化ELISA检测临床牛血清样品Table 3 ic-ELAA and commercial ELISA testing for clinical bovine serum samples
3 讨 论
牛呼吸道合胞体病的早期准确诊断,不但能够减少经济损失,而且可以有效控制该病的发生和蔓延。因此,建立一种低成本同时具有较高敏感性和特异性的牛呼吸道合胞体病诊断方法对养牛业甚至是畜牧业的发展具有很重要的意义。随着国内外科研工作者对牛合胞体病毒的潜心研究,特异性强、敏感性高、操作简便快捷的检测方法将逐渐取代传统的检测手段。最新研究显示,有学者建立了基于BRSV 融合前F 蛋白的间接ELISA 检测方法,检测结果与病毒中和试验结果的符合率达89.5%,准确率相对较高,也为针对BRSV 开发ELISA 商品化试剂盒奠基了基础[16];有研究建立了快速检测BRSV 的环介导等温扩增技术(RT-LAMP),该方法的灵敏度可达到10-6[17]。目前多数的快速诊断方法均是基于抗体的酶联检测技术,制备并纯化抗体的步骤复杂、用时较长,并且抗体活性还不稳定。核酸适配体与抗体相比,在制备技术要求、便捷程度、成本、特异性以及时效性等几个方面具有很大优势,还可以通过人工合成实现标准化。核酸适配体作为一段单链核苷酸序列,不仅可以替代抗体作为生物识别物,还可以与互补链杂交结合、被核酸水解酶水解或者被核酸聚合酶扩增[18]。总之,核酸适配体可以利用自身的特性作为检测信号的一部分,使基于应用核酸适配体的检测方法更灵活。
为了弥补现有检测技术的不足,本研究在基于核酸-蛋白的特异性结合原理,利用SELEX 筛选出BRSV G 蛋白的特异性核酸适配体。经过多次筛选和反筛,最终得到5 条与G 蛋白结合力较强且多次反复出现的核酸适配体。核酸适配体的筛选方法较多,本实验利用ELISA 酶标板能吸附靶分子的功能,对牛呼吸道合胞体核酸适配体筛选方法进行改进和优化。虽然该方法作用时间长,但对靶分子性状要求低,适用的靶分子广,并且不需要使用特殊仪器设备和材料,操作简便,可在低成本下获得特异性强的核酸适配体。核酸适配体通过形成特定的二级结构(如茎环结构、发卡、凸起或G4 聚体等)与靶蛋白结合,达到识别靶蛋白的作用。该研究中筛选的5条适配体G-6、G-13、G-39、G-55 和G-72 均具有稳定的茎环状或发卡状结构,可以与G 蛋白在结构上特异、稳定的结合,因此,筛选的5 条核酸适配体在牛呼吸道合胞体病的诊断方面具有应用潜能,可用于BRSV 抗原或抗体的酶联适配体检测方法的建立,为该病的早期快速诊断技术开发提供基础。
