布鲁氏菌BspG基因缺失对其部分生物学活性影响的研究
2022-07-11于水发马忠臣徐艺玫苗玉和胡瑞瑞易继海李志强陈创夫
于水发,马忠臣,徐艺玫,苗玉和,胡瑞瑞,王 震,易继海,李志强,王 勇*,陈创夫*
(1.石河子大学动物科技学院,新疆 石河子 832003;2.西部地区高发人兽共患传染性疾病防治协同创新中心,新疆 石河子 832003;3.新疆疾病预防控制中心,新疆 乌鲁木齐 830002;4.福建圣维生物科技有限公司,福建 南平 354100;5.石河子大学生命科学学院,新疆 石河子 832003;6.商丘师范学院,河南 商丘 476000)
布鲁氏菌病是人畜共患病,曾被称为马耳他热、地中海热、波动热、邦氏病,遍布于世界各地[1]。目前为止,布鲁氏菌属多达十几个种,其中羊种布鲁氏菌、牛种布鲁氏菌、猪种布鲁氏菌(B. suis)和犬种布鲁氏菌(B. canis)可感染人诱发布鲁氏菌病,严重时可导致心内膜炎、关节炎和骨髓炎等全身衰弱性疾病[2]。
布鲁氏菌经过粘附侵袭、隐蔽、增殖和释放等过程在宿主内建立循环感染体系[3]。其感染最显著的特点是以“隐蔽策略”逃避宿主免疫系统的杀伤,最终建立慢性和长期感染[4]。布鲁氏菌的分泌蛋白即效应蛋白BAB1_0678(BspA)、 BAB1_0712(BspB)、BAB1_0847(BspC)和BAB1_1948(BspF)已被陆续报道[5],其对布鲁氏菌胞内的生存非常重要。有研究表明,在布鲁氏菌侵入宿主细胞的阶段分泌BspG(BAB1_0227),在进入宿主细胞核时发挥特定的功能[6]。本研究室前期研究发现,BspG 定位于宿主细胞核,可能具有核-胞穿梭机制。原核表达的BspG具有良好的免疫原性和反应原性,但其在病原菌胞内存活中的作用尚未见报道[7-8]。BspG基因所编码的蛋白质是新发现的布鲁氏菌的一个分泌蛋白,其被布鲁菌分泌后,主要分布在宿主细胞核及核周围,但其功能目前尚不清楚,为探究BspG基因在布鲁氏菌致病机理及胞内生存中的潜在功能,本研究通过构建B. abortus BspG基因缺失株(ΔBspG)及回补株(pBspG),并利用小鼠巨噬细胞RAW 264.7 鉴定了BspG基因对流产布鲁氏菌(B. abortus)感染及胞内定植能力的影响,为布鲁氏菌BspG的功能研究奠定了实验基础。
1 材料与方法
1.1 主要实验材料Brucella abortus2308 株由中国疾病预防控制中心提供;大肠杆菌DH5α 标准株由西部地区高发人兽共患传染性疾病防治协同创新中心提供;pMD19-T 载体购自TaKaRa 公司;pBBR1MCS-4载体购自Miaolingbio 公司;小鼠巨噬细胞RAW 264.7购自中国医学科学院/北京协和医学院基础医学研究所细胞资源中心;DNA 提取试剂盒购自天根生化科技(北京)有限公司;布鲁氏菌液体培养基(BBLTMBrucellaBroth)及布鲁氏菌固体培养基(BBLTMBrucellaAgar)购自美国BD 公司;DMEM 培养液购自美国Thermo 公司;胎牛血清购自Gibco 公司。
1.2 引物设计 根据GenBank 中布鲁氏菌基因组序列(DK63_1762),利用Primer Premier 5.0 软件设计BspG基因上游同源臂(447 bp)、下游同源臂基因(514 bp)的扩增引物、BspG基因扩增引物及卡那(Kan)抗性基因扩增引物(下划线部分),引物序列见表1。
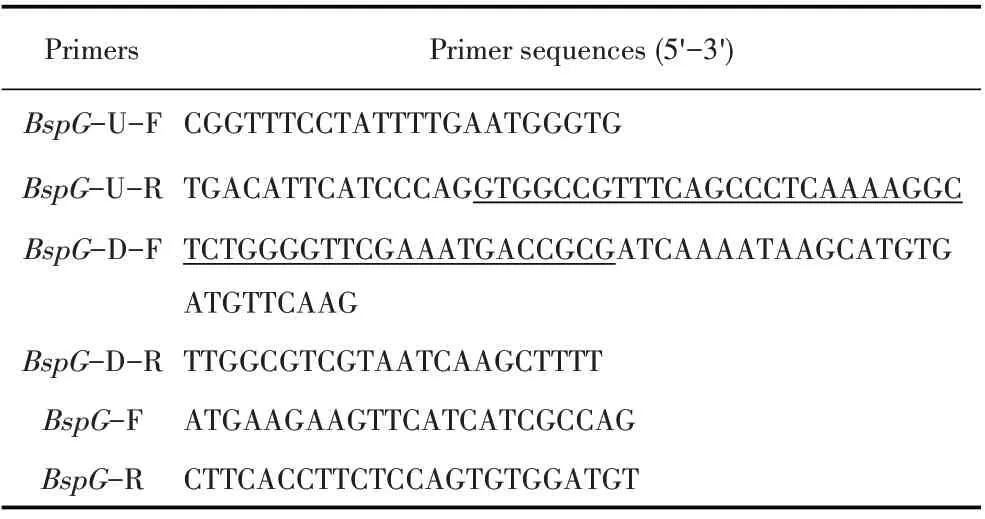
表1 引物信息Table 1 Primer information
1.3 重组质粒pMD19-BspG-Kan、pBBR1MCS-4-BspG的构建与鉴定 以提取的B. abortusDNA 为模板,以BspG-U-F/BspG-U-R 为引物,PCR 扩增BspG基因上游同源臂;以BspG-D-F/BspG-D-R 为引物,PCR 扩增BspG基因的下游同源臂;以BspG-UR/BspG-D-F 引物PCR 扩增Kan抗性基因。以上述扩增的基因片段经融合PCR 扩增, PCR 产物纯化回收后由新疆昆泰锐生物技术有限公司测序后克隆至pMD19-T 载体,构建重组质粒pMD19-BspG-Kan;以提取的B. abortusDNA 为模板,BspG-F/BspG-R 为引物PCR 扩增BspG基因,克隆至pBBR1MCS-4 载体中,构建重组质粒pBBR1MCS-4-BspG。构建的重组质粒分别经PCR 及测序鉴定。
1.4B. abortus BspG基因缺失株和回补株的构建与鉴定 将500 ng 重组质粒pMD19-BspG-Kan电转化至B. abortus2308 感受态细胞中, 37 ℃180 r/min 震荡培养24 h 后涂布含Kan抗性的布鲁氏菌固体培养基,37 ℃培养72 h~96 h,挑单菌落,利用BspG-F/BspG-R 和BspG-U-F/BspG-D-R 引物分别经PCR 鉴定,并由新疆昆泰锐生物技术有限公司测序鉴定,获得布鲁氏菌BspG缺失株(ΔBspG)。将重组质粒pBBR1MCS-4-BspG电转化至ΔBspG中,经Kan+、AMP+抗性平板培养后挑取单克隆菌落,采用BspG-F/BspG-R 引物经PCR鉴定后获得BspG基因回补株(pBspG)。上述PCR 鉴定均设B.abortus2308株为对照。
1.5B. abortus BspG基因缺失株和回补株的遗传稳定性分析 将初步筛选获得的ΔBspG、pBspG连续传15 代,每隔5 代提取细菌DNA,分别以BspG-F/BspG-R 和BspG-U-F/BspG-D-R 为引物对ΔBspG和pBspG经PCR 鉴定,分析各菌株的遗传稳定性。
1.6 各菌株生长曲线的测定 将亲本株、ΔBspG和pBspG分别于37 ℃170 r/min震荡培养,每隔2 h分别取样,测OD600nm值,直至细菌进入平台期(大概28 h),以OD600nm值为纵坐标,培养时间为横坐标绘制上述3 株菌的生长曲线,分析各菌株的生长特性。
1.7 各菌株对RAW 264.7 细胞粘附与侵袭力影响的检测 待六孔板中培养的RAW 264.7 细胞达到每孔约2×106个时,按照MOI 100 将ΔBspG、pBspG和亲本株分别感染RAW 264.7,分别于感染15 min、30 min、45 min、60 min 后,加入庆大霉素(50 μg/mL)杀死未粘附的细菌,继续培养1 h 后,加入0.3% 溶酶素裂解细胞释放出细菌,将裂解液按照101~105稀释后分别涂布于布鲁氏菌固体培养基,37 ℃培养3 d 后进行菌落计数。以亲本株作为参考,分析ΔBspG和pBspG对RAW 264.7 细胞的粘附与侵袭力。
1.8 各菌株在RAW 264.7 细胞中的生存能力试验将RAW 264.7 细胞于六孔板中培养,每孔数量为2×106个,按照MOI 100 将ΔBspG、pBspG和亲本株分别分别感染RAW 264.7 细胞,1 h 后,加入庆大霉素(50 μg/mL)杀死胞外细菌,继续培养4 h、8 h、12 h、24 h、48 h 后,加入0.3% 溶酶素裂解细胞,按照101~105稀释后分别涂布于布鲁氏菌固体培养基,37 ℃培养3 d 后计算菌落数量,分析各菌株在RAW 264.7 细胞中的生存能力。
1.9 统计学分析 每组实验均重复3 次,所有的结果均以±s表示,使用SPSS Statistics 23 分析数据的相关性与差异性,P<0.05 为差异显著。
2 结 果
2.1 重组质粒的构建与鉴定结果 以B.abortusDNA为模板,分别经PCR 扩增BspG基因的上游、下游同源臂基因及Kan抗性基因片段,并经融合PCR 扩增后克隆至pMD19-T 载体中,构建重组质粒pMD19-BspG-Kan并经PCR 及测序鉴定。结果显示,所测序列确为上述3 种基因的融合基因片段。将BspG基因克隆至pBBR1MCS-4 载体中构建重组质粒pBBR1MCS-4-BspG 并经PCR 和测序鉴定。结果显示,PCR 及测序结果均正确。上述结果表明,正确构建了上述两个重组质粒。
2.2B. abortus BspG基因缺失株的构建 将重组质粒pMD19-BspG-Kan电转化B. abortus后涂布Kan+布鲁氏菌培养板,挑单菌落经PCR 鉴定。结果显示,采用BspG-U-F/BspG-D-R 引物经PCR 扩增出2 095 bp 的融合基因片段,而B. abortus无该条带(图1A);采用BspG-F/BspG-R 引物经PCR 未扩增出651 bp 的BspG基因,而亲本株B. abortus扩增出了BspG基因(图1B),经测序后表明正确构建了BspG基因缺失株ΔBspG。
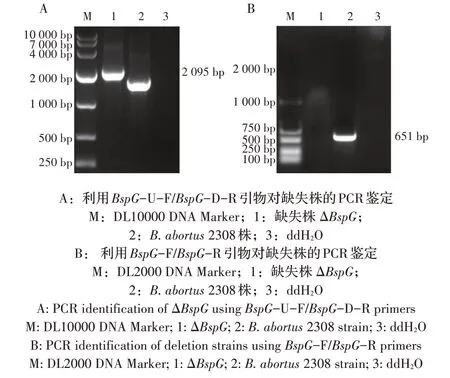
图1 缺失株ΔBspG的PCR鉴定结果Fig.1 PCR identification results of deletion strain ΔBspG
2.3B. abortus BspG基因回补株的构建 将pBBR1MCS-4-BspG电转化至ΔBspG感受态细胞中,经抗性筛选ΔBspG基因回补株,并以BspG-F/BspG-R 引物经PCR 鉴定。结果显示,获得大小为651 bp 的目的片段,与亲本株B. abortus2308 扩增的目的条带基本一致(图2),PCR 产物经测序后与预期BspG基因序列一致,表明正确构建基因回补株pBspG。

图2 回补株pBspG的PCR鉴定结果Fig.2 PCR identification results of the complemented strain pBspG
2.4B. abortus BspG基因缺失株和回补株的遗传稳定性检测 将ΔBspG,和pBspG传15 代,每隔5 代均利用BspG-F/BspG-R 对上述菌株经PCR 鉴定。结果显示,5 代、10 代、15 代的ΔBspG菌株均未扩增出651 bp 的目的条带(图3A);而5 代、10 代、15 代的pBspG菌株则均扩增出651 bp 的目的条带(图3B),均与预期结果相符,可见在经过连续培养15 代后ΔBspG均未出现回复突变,pBspG则均未出现基因丢失。表明构建的ΔBspG和pBspG遗传稳定性均较强。
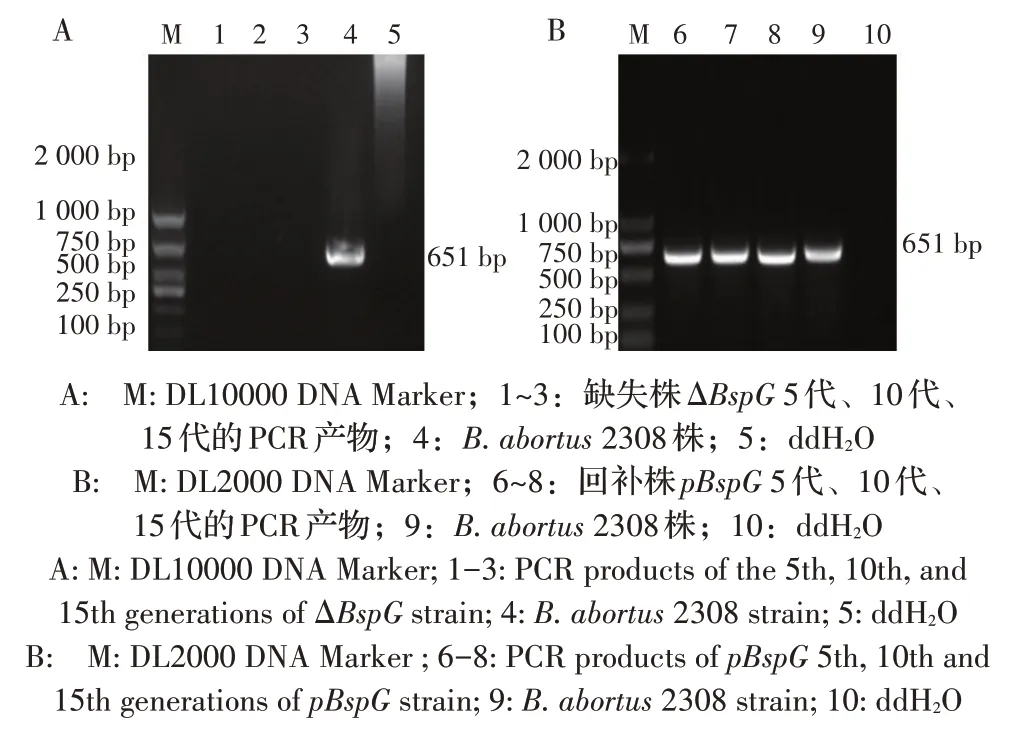
图3 缺失株ΔBspG(A)和回补株pBspG(B)的遗传稳定性检测结果Fig.3 Analysis of genetic stability of the deletion strain ΔBspG(A)and the complemented strain pBspG(B)
2.5 各菌株生长曲线的测定 将亲本株、ΔBspG和pBspG培养后,检测各时间点OD600nm值,绘制生长曲线。结果显示,ΔBspG、pBspG均与亲本株生长趋势相似,培养4 h时进入对数生长期,32 h进入平台期,但在同一时间点ΔBspG和pBspG的OD600nm值均极显著或者显著低于亲本株(图4)(P<0.05)。表明BspG基因的缺失显著抑制布鲁氏菌的体外生长能力。
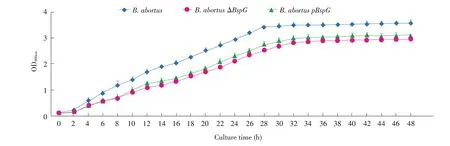
图4 各菌株生长曲线的测定结果Fig.4 Results of the growth curve of each strain
2.6 各菌株对RAW 264.7 细胞的粘附与侵袭力试验结果 将ΔBspG、pBspG及亲本株分别感染RAW264.7细胞后不同时间检测细胞内的细菌数量。结果显示,在感染后15 min~60 min,RAW 264.7 细胞中的活菌数量均缓慢增长,但感染后不同时间,ΔBspG和pBspG的活菌数量均与亲本株无显著差异(P>0.05)(图5)。表明BspG基因的缺失对布鲁氏菌在RAW 264.7 细胞中的粘附与侵袭能力均无影响。
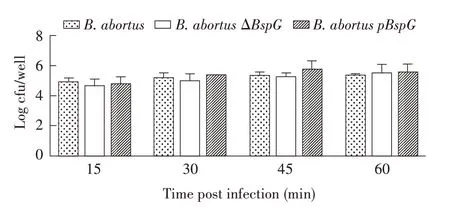
图5 各菌株对RAW 264.7细胞黏附及侵袭试验结果Fig.5 Results of adhesion and invasion tests of each strain on RAW 264.7 cells
2.7 各菌株在RAW 264.7 细胞中生存能力的试验结果 将ΔBspG、pBspG和亲本株分别感染小鼠巨噬细胞RAW 264.7 后,于不同时间段检测细胞内布鲁氏菌的活菌数量。结果显示,在感染后4 h~24 h,各菌株在RAW 264.7 细胞内均缓慢增长,且ΔBspG的胞内细菌数量与亲本株差异均不显著(P>0.05);而24 h 后各组细菌数量均急剧增长,且ΔBspG的胞内活菌数量均极显著低于亲本株(P<0.01)。而pBspG 的胞内活菌数量在上述时间段均与亲本株无显著差异,pBspG恢复了BspG缺失造成的复制缺陷(图6)。表明布鲁氏菌BspG缺失可降低其在巨噬细胞内的增殖能力。

图6 各菌株在RAW 264.7细胞中生存能力的试验结果Fig.6 Results of experiments on the viability of each strain in RAW 264.7 cells
3 讨 论
布鲁氏菌是革兰氏阴性菌,其致病的关键取决于其感染吞噬细胞和非吞噬细胞的能力[9]。在其侵袭宿主细胞过程中,布鲁氏菌与宿主内体相互作用并获得若干标记,包括Rab5、早期内体抗原(EEA-1)和Rab7 等,从而形成“布鲁氏菌小体”(Brucella-containing vacuoles,BCV)。BCV 与溶酶体的融合、其内容物的降解及内化布鲁氏菌的杀灭均可能涉及BCV的酸化过程并触发VirB 操纵子激活Ⅳ型分泌系统(T4SS)[10],从而将多种分泌蛋白包括BspG 释放到宿主细胞内,布鲁氏菌随后迁移并到达内质网(Endoplasmic reticulum,ER)中。在ER 中,布鲁氏菌建立其复制BCV(rBCV),并大量增殖。迄今为止,只鉴定出了少数布鲁氏菌的分泌蛋白[11]。BspG 是分泌蛋白,但其分泌转运途径尚不明确。本研究构建了BspG基因缺失株和回补株,并绘制了缺失株、回补株和亲本株的生长曲线。结果显示,缺失株和回补株的生长曲线与亲本株大致相同,说明缺失株和回补株均具有较好的生长趋势,但它们在同一时间点的OD600nm值均低于亲本株。表明BspG基因缺失株的体外生长能力被显著抑制,但BspG基因回补之后的回补菌株并未达到亲本株的生长水平。推测可能是由于BspG是亲本株染色体上的基因,而pBspG是通过重组质粒回补的BspG基因,又经过Kan+、AMP+抗性的筛选, 可能会致BspG基因的回复不完全,而致BspG基因回补后并未完全恢复该回补株的生长特性。可见BspG基因的缺失对布鲁氏菌的生长有一定的抑制作用。
布鲁氏菌感染宿主的过程中,其对宿主细胞的粘附对其的感染非常重要[12]。本研究比较了BspG基因缺失株、回补株与亲本株对小鼠巨噬细胞RAW 264.7 的粘附与侵袭作用。结果显示,ΔBspG、pBspG均与亲本株的粘附与侵袭能力几乎相同,表明BspG的缺失对布鲁氏菌在RAW 细胞中的粘附与侵袭能力无影响。这与赵晓丽[13]、王震等[14]发现rirA基因缺失并未降低布鲁氏菌对巨噬细胞的粘附与侵袭能力的结论基本一致。
rBCV 阶段(感染后24 h~48 h)是布鲁氏菌在宿主细胞内的主要增殖阶段,也是布鲁氏菌释放的必要阶段。本研究发现在感染后24 h 内ΔBspG和pBspG在RAW 264.7 细胞胞内的活菌数量与亲本株相比差异不明显,而感染24 h 后ΔBspG的胞内活菌数量开始极显著低于亲本株(P<0.01),可见BspG的缺失确实减缓了布鲁氏菌在rBCV 阶段的增殖过程,这不利于布鲁氏菌在宿主细胞内的生存与增殖。VirB T4SS 的分泌蛋白VceC 可以结合ER 伴侣蛋白Grp78/BiP 并诱导未折叠蛋白反应(UPR),引发炎症,可能在rBCV的生成中起作用[15]。还有研究表明,布鲁氏菌T4SS分泌的VceC、BspA、BspB、BspF 效应蛋白可以协同作用来调节宿主细胞的囊泡分泌转运并促进布鲁氏菌rBCV 阶段的生存能力[15-16]。BspG 是否也和这些效应蛋白作用类似,即参与rBCV 的生成及调节宿主细胞的分泌性转运过程,还有待大量研究去证实。
本研究构建了BspG基因缺失株ΔBspG和回补株pBspG,并首次证实BspG基因的缺失可以降低布鲁氏菌的胞内生存能力,提示BspG可能是布鲁氏菌侵染宿主的关键分子,在布鲁氏菌的rBCV 阶段发挥重要作用。本研究为探究BspG基因在布鲁氏菌致病机理中的作用奠定基础。
