肠炎沙门菌glpK基因缺失株的生物学特性及其免疫效果评价的研究
2022-07-11冀梦瑶周诗淼张莹辉彭小薇李佩国吴同垒
冀梦瑶,周诗淼,蒋 卉,张莹辉,彭小薇,李佩国,吴同垒*
(1.河北省预防兽医学重点试验室,河北科技师范学院,河北 秦皇岛 066004;2.中国兽医药品监察所,北京 100080)
沙门菌是一种人兽共患病原菌,可感染多种畜禽,引起败血症和肠炎,导致怀孕动物流产;也可感染人类,造成胃肠炎等,具有重要的公共卫生意义[1-2]。沙门菌感染的防控主要依赖抗生素、检疫净化等措施,从近年来的执行效果来看,成效远远不足。疫苗是解决沙门菌感染的重要途径,利用基因工程技术对细菌遗传物质进行改造,可获得安全性和保护力良好的弱毒菌株[3]。沙门菌携带大量毒力相关因子,其中htrA和ssaV等是开发基因工程减毒活疫苗的靶基因[4]。研究显示,缺失htrA和yncD基因的甲型副伤寒沙门菌株对小鼠的毒力显著降低,滴鼻免疫能够刺激小鼠产生高滴度的特异性抗体,具有一定的免疫保护效果;ssaV基因缺失可导致伤寒沙门菌和鼠伤寒沙门菌的毒力降低,且能对免疫小鼠提供良好的免疫保护效果[5]。研究结果显示,与免疫野生菌株的雏鸡相比较,免疫phoP和fllic基因缺失菌株雏鸡病理损伤均明显减轻,存活率均显著提高[6-8]。甘油激酶K(GlpK),由glpK基因编码,可影响志贺菌对上皮细胞的黏附与侵入,增强细菌的致病性,调控分枝杆菌、李氏杆菌的生物被膜形成和耐药性[9]。另外,glpK基因在沙门菌感染的宿主胞内外的表达水平差异显著,提示其在沙门菌胞内感染及其毒力中具有潜在作用[4]。
目前未见glpK基因对肠炎沙门菌毒力的影响,及其缺失菌株作为疫苗候选株的研究报道。因此,本研究对肠炎沙门菌glpK缺失株进行了模拟体内应激试验、巨噬细胞存活试验、小鼠感染及免疫保护试验,为沙门菌的致病机制和基因工程弱毒疫苗的研究奠定基础。
1 材料与方法
1.1 主要实验材料 肠炎沙门菌c50336 株和glpK基因缺失株c50336ΔglpK,由河北省预防兽医学重点实验室保存;鼠源巨噬细胞Raw264.7,由吉林农业大学单晓枫教授惠赠;4 周龄~6 周龄BALB/c 小鼠购自北京维通利华实验动物技术有限公司。
DMEM、1640 培养基、胎牛血清、胰酶购自赛默飞世尔科技有限公司;青、链霉素、庆大霉素购自北京亚米生物科技有限公司;MTT 试剂盒购自上海碧云天生物技术有限公司;BCA 蛋白浓度测定试剂盒购自康为世纪生物技术有限公司;ConA、TMB显色液及羊抗鼠HRP-IgG 购自北京索莱宝科技有限公司。
1.2 野生株和glpK基因缺失株的体外模拟应激试验 将c50336 和c50336ΔglpK菌液分别以等体积pH3.5(酸性刺激)、pH10.0(碱性刺激)、含10 mmol/L H2O2(氧化应激)和2.4 mol/L NaCl(高渗刺激)的生理盐水重悬,37 ℃作用60 min,10 倍倍比稀释后活菌计数。以细菌存活率=应激后活菌数/原始活菌数,评价菌株对酸、碱、氧化和高渗应激的抵抗能力。
1.3 野生株和glpK基因缺失株的巨噬细胞胞内存活试验 将状态良好的鼠源巨噬细胞Raw264.7 铺96孔细胞板;24 h 后,将c50336 和c50336ΔglpK菌液分别以MOI 100 感染,并加入含100 μg/mL 庆大霉素的维持培养基继续培养;分别在感染后1 h、10 h、24 h,使用1% Triton X-100 裂解巨噬细胞,10 倍倍比稀释后细菌计数,统计菌株在巨噬细胞胞内的活菌数。
1.4 野生株和glpK基因缺失株对小鼠的半数致死量(LD50)测定 将4 周龄~6 周龄BALB/c 雌鼠分为11组,5 只/组,其中5 组为野生株感染,5 组为缺失株感染,1 组为对照组。采用腹腔注射方式感染小鼠,根据预试验结果,菌株c50336 分别以1.5×106cfu/只~1.5×102cfu/只感染小鼠,菌株c50336ΔglpK分别以2.1×109cfu/只~2.1×105cfu/只感染小鼠。对照组小鼠注射等体积TSB 液体培养基。记录14 d 内小鼠的死亡情况。采用寇氏法计算菌株对小鼠的LD50。
1.5glpK基因缺失株的免疫保护试验 将4 周龄~6 周龄BALB/c 雌鼠分为3 组,每组25 只,分别为免疫组、攻菌组和对照组。免疫组小鼠经腹腔注射菌株c50336ΔglpK,剂量为2.1×106cfu/只;攻菌组和阴性对照组小鼠腹腔注射TSB 培养基;14 d 后二免。首免后28 d,对免疫组和攻菌组小鼠分别经腹腔注射菌株c50336,剂量为1.5×105cfu/只。对照组注射TSB 液体培养基。记录15 d 内小鼠的死亡情况。
1.6glpK基因缺失株免疫小鼠后的脾脏指数及脾脏载菌量的测定 将4 周龄~6 周龄BALB/c 雌鼠分为2 组,每组15 只;一组为实验组,经腹腔注射菌株c50336ΔglpK,剂量为2.1×106cfu/只;另一组为对照组,注射等体积的TSB 液体培养基。分别在注射后3 d、10 d 和21 d,取5 只小鼠,称重、眼球采血分离血清;同时取脾脏称重,计算脾脏指数,脾脏指数=脾脏重量/小鼠体质量×100%。将脾脏匀浆,10 倍倍比稀释后细菌计数,测定各组小鼠脾脏载菌量。
1.7 免疫小鼠脾淋巴细胞增殖能力检测 将菌株c50336ΔglpK利用LB 液体培养基培养至对数期,PBS 洗涤,超声破碎,离心取上清,即为全菌蛋白,经BCA 试剂盒检测蛋白浓度为1.28 mg/mL。
参照文献[7]分别将免疫后3 d、10 d 和21 d 的各5 只小鼠脾脏制备成脾淋巴细胞悬液,铺96 孔细胞板,每只小鼠脾细胞铺9 孔,分别利用ConA 和c50336ΔglpK全菌蛋白刺激,浓度均为5 μg/mL。同时设置未刺激的阴性对照组。72 h 后,向培养孔避光加入10 μL MTT(5 mg/mL),继续培养4 h;加入100 μL Formazan 溶解液,培养4 h,测定OD570nm,评估各组小鼠脾淋巴细胞的增殖能力。
采用增殖指数评估脾淋巴细胞的增殖能力,增殖指数的计算公式为:ConA 组=(ConA 组OD570nm均值-培养基组OD570nm均值)/(未刺激组OD570nm均值-培养基组OD570nm均值);全菌蛋白组=(全菌蛋白组OD570nm均值-培养基组OD570nm均值)/(未刺激组OD570nm均值-培养基组OD570nm均值)。
1.8glpK基因缺失株免疫小鼠抗体水平的间接ELISA 检测 取1.7 制备的c50336ΔglpK全菌蛋白,以1 000 ng/孔、37 ℃包被2 h;PBST 洗涤, 5%脱脂乳4 ℃封闭过夜;以小鼠血清(1:100)为一抗,羊抗鼠HRP-IgG(1:5 000)为二抗,经间接ELISA 检测小鼠血清抗体水平。
2 结 果
2.1 野生株和glpK基因缺失株的体外模拟应激试验结果 分别以pH3.5、pH10.0、含10 mmol/L H2O2和含2.4 mol/L NaCl 的生理盐水孵育菌株c50336 和c50336ΔglpK,计算各组菌的存活率。结果显示,相比于c50336,缺失菌株c50336ΔglpK在氧化和高渗环境环境中的存活率均极显著降低(0.001<P<0.01),但在酸性和碱性环境中的存活率均无差异(图1)。表明GlpK 参与肠炎沙门菌对氧化和高渗环境的抵抗能力。
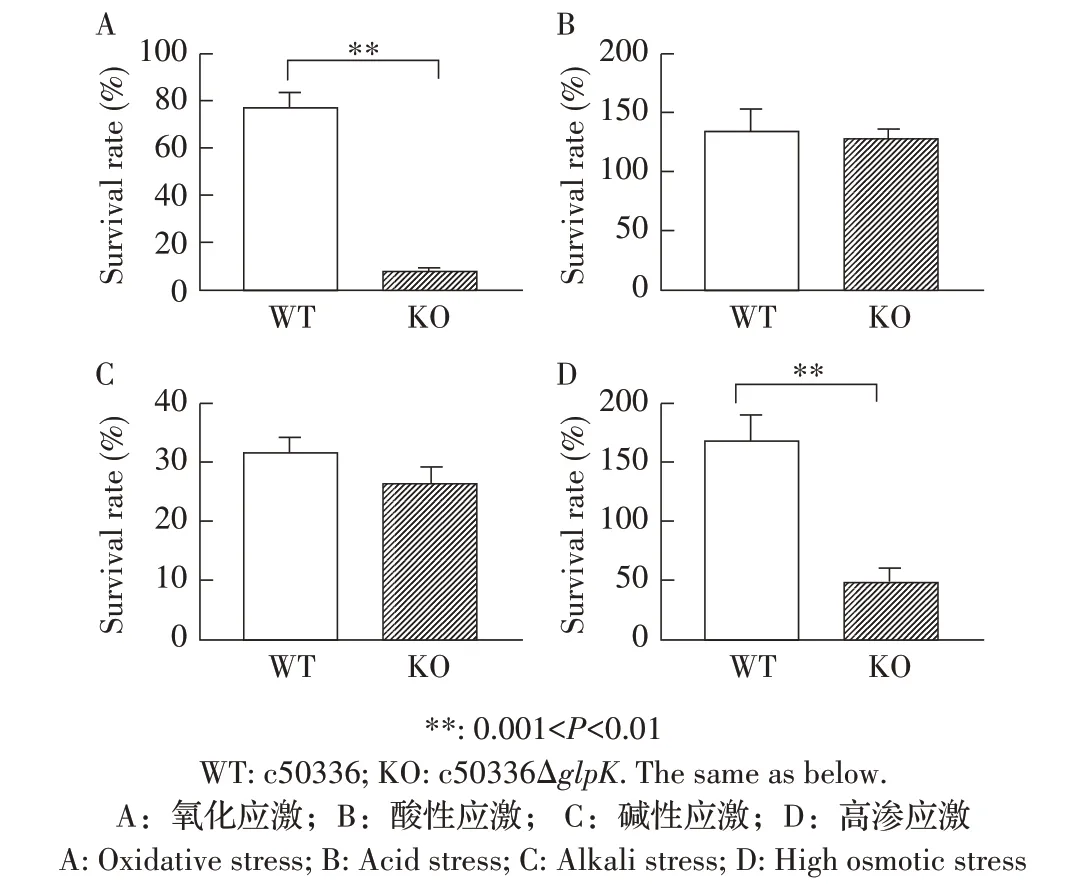
图1 缺失菌株的环境应激试验结果Fig.1 Results of environmental stress test for the mutant
2.2 野生株和glpK基因缺失株的巨噬细胞胞内存活试验结果 将c50336 和c50336ΔglpK菌株分别以MOI 100 感染鼠源巨噬细胞Raw264.7,分别在感染后1 h、10 h、24 h 裂解细胞,细菌计数。结果显示,感染后10 h 和24 h,野生菌株c50336 胞内细菌数明显高于缺失菌株c50336ΔglpK(图2)。结果表明,glpK基因缺失降低了肠炎沙门菌在巨噬细胞内的存活能力。

图2 缺失菌株的胞内存活试验结果Fig.2 Intracellular survival test of the mutant
2.3 野生株和glpK基因缺失株的LD50测定结果将不同剂量的c50336 和c50336ΔglpK分别经腹腔注射小鼠,记录14 d 内小鼠的死亡情况,并对死亡小鼠剖检和细菌的再分离鉴定,并采用寇氏法计算菌株对小鼠的LD50。经计算结果显示,菌株c50336 和c50336ΔglpK的LD50分别为6.7×102cfu 和1.6×107cfu(表1)。对各组死亡小鼠剖检,细菌的再分离结果显示,获得的菌株与小鼠腹腔攻菌使用的菌株一致。结果显示,小鼠脾脏肿大,且颜色变深,症状符合预期。结果表明:glpK基因的缺失导致肠炎沙门菌的毒力显著下降。
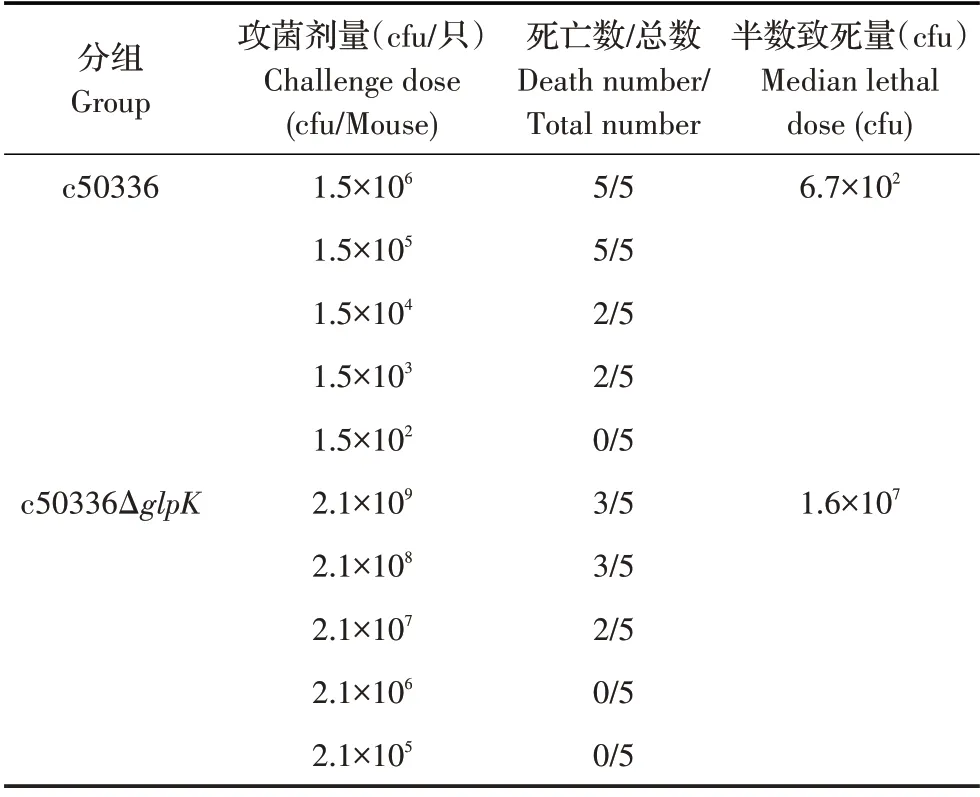
表1 缺失菌株对小鼠的LD50测定结果Table 1 Results of LD50 test for the mutant to mice
2.4glpK基因缺失株的免疫保护试验结果 将缺失菌株c50336ΔglpK经腹腔注射免疫小鼠2 次,首免后28 d 经腹腔感染菌株c50336,统计15 d内各组小鼠的免疫保护率。结果显示,攻菌组小鼠出现震颤,被毛直立、凌乱,蜷缩一起,攻菌后的12 d 内陆续死亡、并最终全部死亡;免疫组小鼠攻菌后,也有部分小鼠出现上述症状,但最终恢复,15 d 内未见死亡,免疫保护率为100%;阴性对照组小鼠未出现上述临床症状,且未见死亡(图3)。表明glpK基因缺失株的免疫保护效果良好。

图3 缺失菌株对小鼠的免疫保护率Fig.3 Immune protection rate of the mutant strain
2.5 免疫小鼠脾脏指数及载菌量检测结果 将c50336 ΔglpK免疫小鼠后3 d、10 d 和21 d 分别对各组小鼠称重后,迫杀取脾脏称重,并计算脾脏指数。将脾脏组织匀浆,10 倍倍比稀释后经细菌计数,测定载菌量。结果显示,免疫组小鼠脾脏指数均极显著高于对照组(P<0.01,P<0.001),且在免疫后10 d 脾脏指数最高(图4A);免疫组小鼠脾脏载菌量逐渐降低,并在21 d 时为零;对照组小鼠脾脏始终无细菌检出(图4B)。表明glpK基因缺失株在小鼠体内不能形成持续感染,最终被机体清除,安全性良好。

图4 免疫小鼠脾脏指数(A)及脾脏载菌量(B)的检测结果Fig.4 Detection of spleen index(A)and bacterial load(B)in mice
2.6 免疫小鼠脾淋巴细胞增殖能力及血清抗体水平检测 分别将小鼠免疫c50336ΔglpK后3 d、10 d 和21 d 的脾脏研磨后,制备脾淋巴细胞悬液,分别经c50336ΔglpK全菌蛋白刺激后计算淋巴细胞增殖指数。结果显示,全菌蛋白刺激的小鼠脾细胞增殖指数均极显著高于未刺激组(0.001<P<0.01),且随免疫次数的增加,该增殖指数也随之升高。阳性对照ConA 刺激的小鼠脾细胞增殖指数高于全菌蛋白刺激组和极显著高于(P<0.01)未刺激组(图5A)。结果表明glpK基因缺失株可增强小鼠脾淋巴细胞的增殖能力,并产生良好的细胞免疫反应。
分别在免疫后3 d、10 d 和21 d 采血分离血清,采用间接ELISA 法检测血清中的抗体水平。结果显示,免疫组小鼠血清中的抗体水平随免疫次数的增加而持续上升(图5B)。表明glpK基因缺失株可刺激小鼠产生体液免疫反应。

图5 免疫小鼠脾淋巴细胞增殖能力(A)和血清抗体水平检测(B)结果Fig.5 Detection of lymphocyte proliferation ability(A)and serum antibody level(B)in mice
3 讨 论
甘油激酶GlpK 的功能研究主要集中在其对细菌甘油代谢作用的影响方面,而对其影响细菌毒力方面的研究较少。沙门菌进入机体后,需抵御一系列来自机体体液或吞噬细胞的杀伤作用,其作用方式主要包括氧化、酸及渗透压应激等[10-12]。研究表明,沙门菌胞内感染过程中glpK基因表达量的变化显著,提示其可能与沙门菌胞内存活的机制有关[13-14]。本研究利用glpK基因缺失株c50336ΔglpK进行模拟体外应激试验证明GlpK 参与了肠炎沙门菌的抗氧化和抗高渗机制。
研究显示,与病原菌代谢相关的基因往往影响其毒力,例如与铁离子转运相关的基因fur、putA和feuABC等,与糖类代谢相关的基因ABC transpoter、nagC和glmS等[15-18]。GlpK 可将进入菌体的甘油磷酸化,形成α-磷酸甘油,最终进入糖酵解过程,参与细菌能量代谢,同时参与细菌细胞壁中脂类的合成,进而影响细菌的粘附等致病过程[19]。据此,推测GlpK 可能影响沙门菌的胞内存活能力和毒力,本研究利用巨噬细胞存活试验和对小鼠的LD50试验,发现glpK基因缺失株c50336ΔglpK在巨噬细胞内的存活能力显著降低,而对小鼠的LD50显著升高,表明缺失菌株c50336ΔglpK对小鼠的毒力明显降低。
利用同源重组或者其他相关技术敲除病原菌的毒力基因获得基因缺失弱毒株,是构建基因工程减毒活疫苗的重要方式。小鼠的免疫攻菌试验结果显示,免疫c50336ΔglpK后对免疫小鼠可以提供100%的抵抗野生菌株感染的能力。研究认为,机体产生的细胞免疫反应对机体抵抗沙门菌的感染更为重要[20]。体液免疫在沙门菌感染的早期不能发挥免疫清除作用,但在感染后期和持续性感染过程中发挥了重要的免疫防御作用[21]。本研究利用MTT 法检测了c50336ΔglpK免疫小鼠脾淋巴细胞的增殖能力,并利用间接ELISA 检测免疫小鼠的血清抗体水平,结果表明,glpK基因缺失株可有效增强免疫小鼠脾淋巴细胞的增殖能力和诱导小鼠血清产生较高的抗体水平,即刺激小鼠产生了良好的细胞和体液免疫反应。
综上所述,本研究结果首次证明GlpK 影响肠炎沙门菌的毒力,glpK基因缺失菌株能够为小鼠提供良好的免疫保护效果,具有作为防御肠炎沙门菌感染的候选疫苗株的潜力。本研究结果丰富了肠炎沙门菌的致病机制理论,并为其疫苗的研究提供了重要试验参考。
