GPR81、MCT1、MCT4 蛋白联合检测在诊断宫颈鳞癌腹膜后淋巴结转移的临床价值
2022-07-11杨晓娜张丹
杨晓娜,张丹
(1.郑州市金水区总医院妇产科;2.郑州大学第二附属医院妇产科,河南 郑州450000)
宫颈癌是一种发病率高、 致死率高的女性生殖系统发生病变的恶性肿瘤, 全球每年新发患者约50 万,死亡患者约26 万,且85%患者来自发展中国家[1]。 宫颈癌有多种类型,其中宫颈鳞癌临床最常见,占比约为宫颈癌的83.3%[2]。病理组织检查是临床诊断腹膜后淋巴结转移的 “金标准”[3],同时, 多项研究报道,G 蛋白偶联受体81 (G protein coupled receptor 81,GPR81)、 单 羧 酸 转 运 体1(Monocarboxylate transporter 1,MCT1)、 单羧酸转运体4(Monocarboxylate transporter 4,MCT4)蛋白参与肿瘤细胞的增殖、侵袭和转移,可作为宫颈鳞癌的肿瘤标志物, 但对于其用于诊断宫颈鳞癌腹膜后淋巴转移情况的临床研究鲜少报道[4]。 本研究旨在探讨GPR81、MCT1、MCT4 蛋白联合检测诊断宫颈鳞癌腹膜后淋巴结转移的可能性, 并采用Kappa 一致性与病理组织诊断“金标准”比较其诊断的敏感度、特异度、准确度,以期为临床防治宫颈鳞癌腹膜后淋巴结转移提供更多的循证支持。
1 资料与方法
1.1 一般资料 选取2016 年至2021 年在本院经病理学组织确诊的128 例宫颈鳞癌患者为研究对象,年龄35~65 岁,平均年龄(50.03±7.51)岁。 术后根据病理检查结果确定腹膜后是否发生淋巴结转移分为转移组(n=36)和未转移组(n=92)。 纳入标准:(1)符合FIGO 分期标准[5],ⅠA~ⅡA 期;(2)行根治性子宫切除术+盆腔淋巴结清扫术+腹膜后淋巴结清扫术;(3)患者及其家属知情同意。 排除标准:(1)合并其他恶性肿瘤;(2)合并其他影响GPR81、MCT1、MCT4 蛋白水平的疾病;(3) 既往有宫颈手术史。 本研究通过医院伦理委员会批准。
1.2 方法 仪器与试剂:空白阵列组织芯片蜡块制备仪(北京克洛伊科技公司)、组织切片机(德国Leica,RM2235)、 显微镜 (德国Leica,THUNDER Imager Tissue 全景组织显微成像系统)、 福尔马林缓冲液(WAKO,货号060-01721)、苏木素-伊红染色液(尚宝生物,R21871-500)、二甲苯(默克,货号534056)、GPR81 抗体(美国艾美捷Abnova,货号PAB26622)、MCT1 抗体(USBiological,货号301403-ML750)、MCT4 抗体(Abbkine,货号ABP51762)。
选择免疫组化SP 法进行分析,将所有患者的病理组织进行福尔马林缓冲液固定, 常规进行石蜡包埋(酒精脱水、浸蜡),准确切片(切片厚度4 μm×4 张); 1 张进行苏木素-伊红染色2 min,由2名经验丰富的病理医师复核诊断。 再经常规脱蜡(放入二甲苯中10 min) 及水化处理 (无水乙醇-95%酒精-85%酒精-75%酒精各5 min 逐级进行)后,选择链菌素亲生物素-过氧化物酶免疫组织化学 法 检 测GPR81、MCT1、MCT4 蛋 白 表 达 水 平。GPR81 抗体(1∶100)、MCT1 抗体(1∶50)及MCT4 抗体(1∶100)为一抗,将PBS 替代一抗视作阴性对照。结果判定[6]:染色结果均以细胞膜或细胞质内出现棕黄色颗粒为阳性染色。 免疫组织化学评分包括染色强度(0 分为无明显着色,1 分为黄色,2 分为棕黄色,3 分为黄褐色)、阳性细胞所占比例(0 分为阳性细胞数<5%,1 分为5%~25%,2 分为26%~50%为,3 分>50%),总分≥2 分定义为阳性表达。
1.4 统计学处理 采用SPSS 22.0 统计学软件进行数据分析,诊断计数资料以n(%)表示,采用χ2检验;以病理学检查为临床诊断金标准,采用Kappa一致性检验GPR81、MCT1、MCT4 蛋白单独检测与联合检测诊断宫颈鳞癌腹膜后淋巴结转移的准确率、敏感度、特异度。
2 结果
2.1 所有宫颈鳞癌患者临床资料比较 128 例宫颈鳞癌患者术后病理检查发生腹膜后淋巴结转移36例(28.13%),未发生转移92 例(71.87%)。 转移组与非转移组的年龄、病理分级、临床分期、分化程度基础临床资料无明显差异(P>0.05)。 见表1。
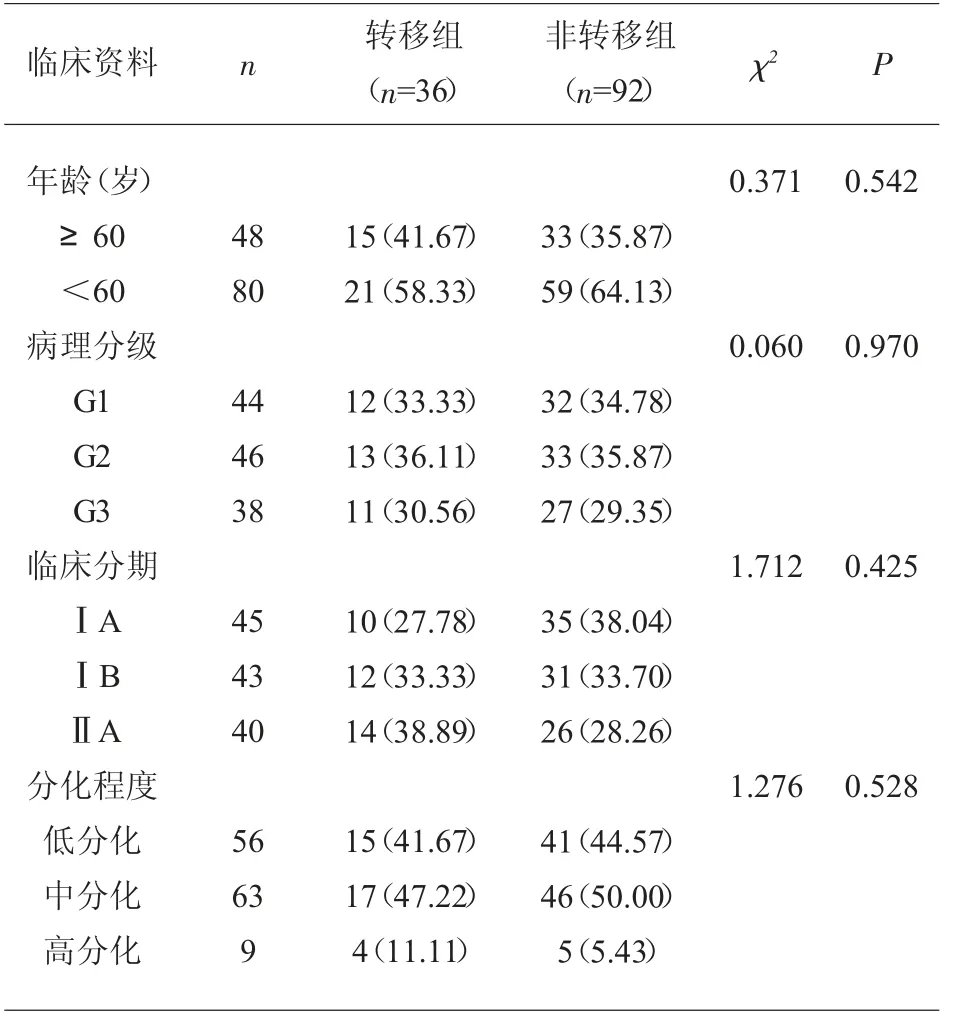
表1 所有宫颈鳞癌患者临床资料比较
2.2 所有宫颈鳞癌患者GPR81、MCT1、MCT4 蛋白水平比较 128 例宫颈鳞癌患者检测出GPR81 蛋白阳性表达53 例(41.41%),见图1。 其中36 例淋巴结转移患者中GPR81 阳性表达27 例(75.00%),92 例未淋巴结转移患者中GPR81 阳性表达26 例(28.26%)。 与病理组织检查金标准诊断相比,假阳性26 例,误诊率为20.31%(26/128);假阴性9 例,漏诊率为7.03%(9/128)。 见表2。
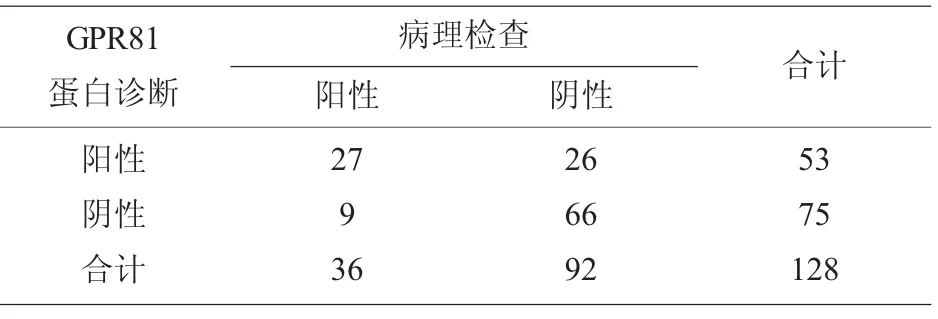
表2 GPR81 蛋白检测诊断宫颈鳞癌腹膜后淋巴结转移情况
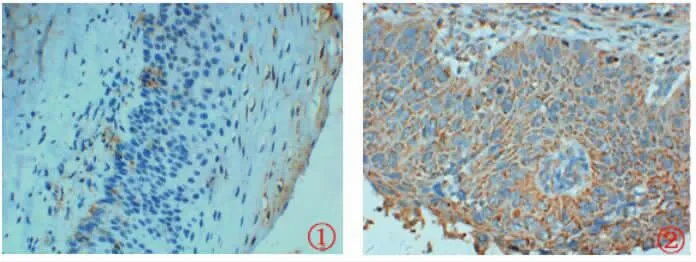
图1 GPR81 蛋白在所有宫颈鳞癌患者中的表达
128 例宫颈鳞癌患者检测出MCT1 蛋白阳性表达52 例(40.63%),见图2。 其中36 例淋巴结转移患者中MCT1 阳性表达28 例(77.78%),92 例未淋巴结转移患者中MCT1 阳性表达24 例(26.09%)。 与病理组织检查金标准诊断相比,假阳性24 例,误诊率为18.75%(24/128);假阴性8 例,漏诊率为6.25%(8/128)。 见表3。
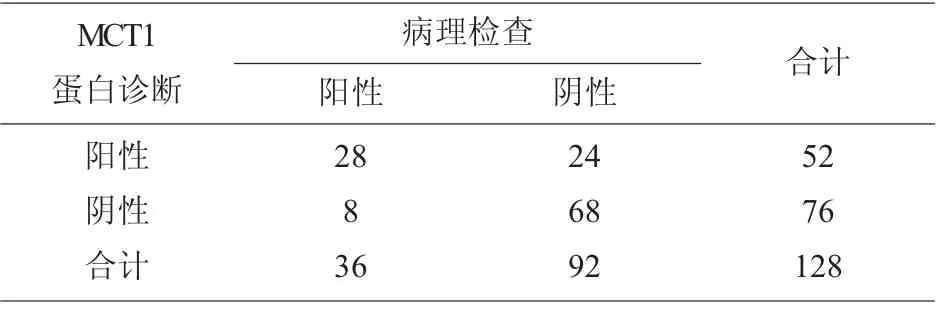
表3 MCT1 蛋白检测诊断宫颈鳞癌腹膜后淋巴结转移情况
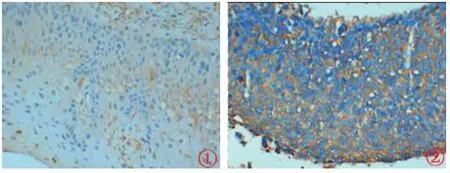
图2 MCT1 蛋白在所有宫颈鳞癌患者中的表达
128 例宫颈鳞癌患者检测出MCT4 蛋白阳性表达52 例(40.63%),见图3。 其中36 例淋巴结转移患者中MCT4 阳性表达29 例(80.56%),92 例未淋巴结转移患者中GPR81 阳性表达23 例(25.00%)。 与病理组织检查金标准诊断相比,假阳性23 例,误诊率为17.97%(23/128);假阴性7 例,漏诊率为5.47%(7/128)。 见表4。
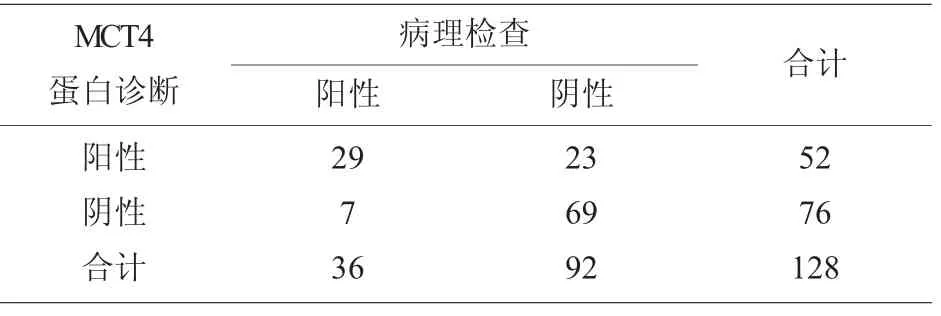
表4 MCT4 蛋白检测诊断宫颈鳞癌腹膜后淋巴结转移情况
2.3 GPR81、MCT1、MCT4 蛋白联合检测诊断腹膜后淋巴结转移情况 128 例宫颈鳞癌患者中GPR81、MCT1、MCT4 蛋白串联联合检测阳性表达49 例(38.28%)。与病理组织检查金标准诊断相比,假阳性15 例,误诊率为11.72%(15/128);假阴性2例,漏诊率为1.56%(2/128)。 见表5。
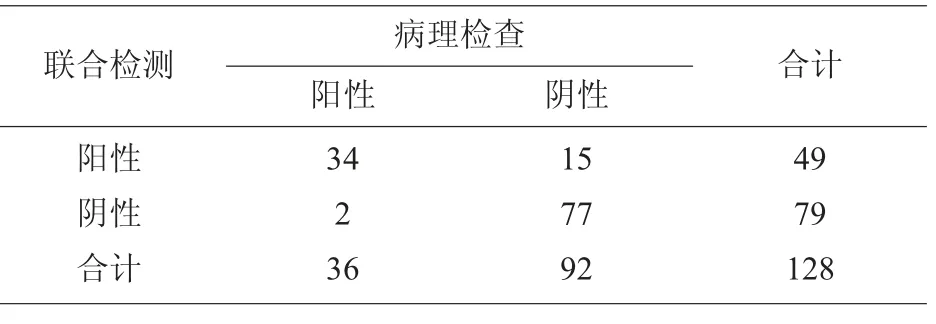
表5 GPR81、MCT1、MCT4 蛋白联合检测诊断腹膜后淋巴结转移情况
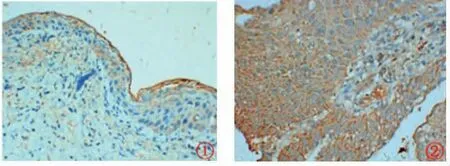
图3MCT4 蛋白在所有宫颈鳞癌患者中的表达
2.4 GPR81、MCT1、MCT4 蛋白水平诊断腹膜后淋巴结转移的价值 与病理组织检查金标准诊断相比,GPR81 蛋白检测诊断宫颈鳞癌患者腹膜后淋巴结转移的Kappa 值为0.409, 敏感度为75.00%,特异度为71.74%, 准确率为72.66;MCT1 蛋白检测诊断宫颈鳞癌患者腹膜后淋巴结转移的Kappa值为0.455,敏感度为77.78%,特异度为73.91%,准确度为75.55%;MCT4 蛋白检测诊断宫颈鳞癌患者腹膜后淋巴结转移的Kappa 值为0.489,敏感度为80.56%, 特异度为75.00%, 准确度为76.56%; 三者联合诊断宫颈鳞癌患者腹膜后淋巴结转移的Kappa 值为0.704, 敏感度为94.44%,特异度为83.69%,准确度为86.72%,显著高于三者单独检测诊断价值(P<0.05)。
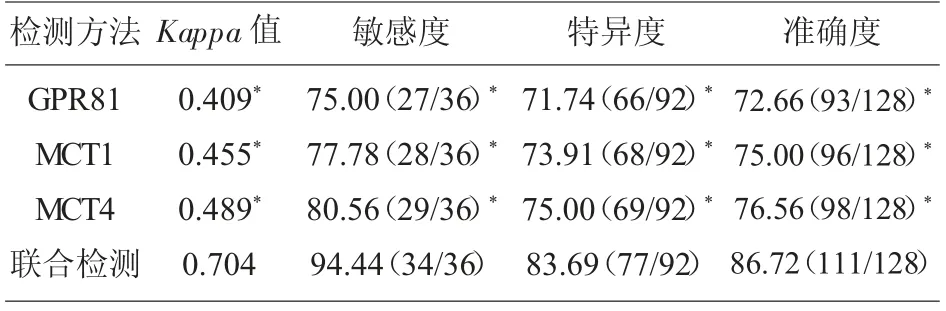
表6 GPR81、MCT1、MCT4 蛋白单独检测与联合检测诊断宫颈鳞癌腹膜后淋巴结转移的效能n(%)
3 讨论
宫颈鳞癌是指发生在女性子宫颈的鳞状细胞癌,是上皮内恶性肿瘤之一,其患者数占宫颈癌的75%~80%,发病率位于女性生殖系统肿瘤的首位[7]。 其治疗原则以手术和放化疗为主,但手术方式需根据是否有转移确定。 相关研究报道,早期宫颈癌未发生腹膜后淋巴结转移的5 年生存率为85%~95%, 而发生淋巴结转移的患者生存率下降35%~40%[8], 因此在术前明确是否存在淋巴结转移,不仅能够尽快确定手术方案,还可能会提高患者5 年生存率。 目前,病理检查是临床诊断腹膜后淋巴结转移的“金标准”。 本次研究中,经病理学组织检查腹膜后淋巴结转移患者36 例, 发生率为28.13%,与韩茜茜等[9]的研究报道基本一致。
近年来,对于癌症细胞的发生、发展过程的研究越来越多。 相关研究发现,肿瘤细胞的生长速度异于正常细胞的主要原因是能量代谢的差异,肿瘤细胞在有氧状态下,产生大量的乳酸、丙酮酸等酸性产物, 而GPR81、MCT1、MCT4 蛋白可参与癌细胞的新成代谢,调节癌细胞的能量供给和pH 值环境[10]。 相关研究数据表明,GPR81 蛋白在宫颈鳞癌患者中呈现高表达[11]。 本次研究发现,宫颈鳞癌腹膜后淋巴结转移患者的GPR81 蛋白阳性表达明显高于未发生淋巴结转移患者, 进一步验证了上述报道结论, 提示GPR81 蛋白可作为预测患者是否会发生淋巴结转移的诊断指标。 分析其原因可能是,GPR81 广泛分布于人体组织中,是乳酸盐的特异性激动剂, 可作为多种癌症微环境中的转导信号,参与癌症的发生发展[12]。因此,本次研究采用与病理组织“金标准”诊断一致性评判GPR81 蛋白诊断宫颈鳞癌腹膜后淋巴结转移的价值, 结果显示, 与病理组织检查金标准诊断相比,Kappa 值为0.409,误诊率为20.31%,漏诊率为7.03%,敏感度为75.00%,特异度为71.74%,准确率为72.66。 相关研究报道,MCT4 蛋白促进鳞癌细胞的增殖、侵袭和转移,影响患者预后[13]。 相关研究指出,MCT1在宫颈癌组织中呈现高表达, 且其表达水平与宫颈癌病情发展呈正相关[14]。 本次研究发现,宫颈鳞癌腹膜后淋巴结转移患者的MCT1、MCT4 蛋白阳性表达明显高于未发生淋巴结转移患者, 进一步验证了上述报道结论,提示MCT1、MCT4 蛋白可作为预测患者是否会发生淋巴结转移的诊断指标。分析其原因可能是,MCT1、MCT4 蛋白均属于单羧酸转运蛋白,均可介导乳酸的跨膜转运,调控机体糖酵解过程, 其在糖酵解较高的肿瘤组织中较高表达,将癌细胞内乳酸外运,维持糖酵解的能量代谢,促使癌细胞的发生、发展[15-16]。 因此,本次研究采用与病理组织“金标准”诊断一致性评判MCT1、MCT4 蛋白诊断宫颈鳞癌腹膜后淋巴结转移的价值,结果显示,与病理组织检查金标准诊断相比,MCT1、MCT4 蛋白诊断的Kappa 值分别为0.455、0.489, 误 诊 率 为18.75%、17.97%, 漏 诊 率 为6.25%、5.47%,敏感度为77.78%、80.56%,特异度为73.91%、75.00%,准确度为75.55%、76.56%。 说明GPR81、MCT1、MCT4 蛋白单独检测诊断淋巴结转移均有一定的临床价值,但其误诊率较高,可能将未发生淋巴结转移的患者诊断为转移患者,导致手术方案错误, 造成患者不必要的精神和经济压力。 本研究中,进一步采用GPR81、MCT1、MCT4蛋白串联联合检测,结果显示,与病理组织检查金标准诊断相比,Kappa 值为0.704,误诊率为11.72%,漏诊率为1.56%, 敏感度为94.44%, 特异度为83.69%,准确度为86.72%,误诊率与漏诊率低于三项指标单独检测,敏感度、特异度及准确度明显高于三项指标单独检测, 提示三项指标联合检测可有效诊断宫颈鳞癌腹膜后淋巴结转移, 术前根据患者肿瘤组织的GPR81、MCT1、MCT4 蛋白水平,预测术后腹膜后淋巴结转移的发生风险, 结合患者实际身体状况, 实施最适宜有效的手术治疗方案。
综上所述, 与GPR81、MCT1、MCT4 蛋白单独检测相比, 三者联合检测与病理学组织诊断宫颈鳞癌患者腹膜后淋巴结转移有较好的一致性,且能有效提高特异度、敏感度与准确度,避免单一手段检测造成的误诊, 为临床诊断早期宫颈鳞癌患者术后发生腹膜后淋巴结准一提供了可靠的筛查技术手段。 但本研究样本数量较少,试验数据存在一定的局限性, 需进一步采用大样本临床研究对三项蛋白指标抑制剂防治宫颈鳞癌腹膜后淋巴结转移的可能性。
