大豆GmZAT12基因的克隆和表达分析
2022-07-11张晋玉徐新娟晁毛妮张晓红吴向远高际涛黄中文
张晋玉,徐新娟,晁毛妮,张晓红,吴向远,高际涛,黄中文
(河南科技学院,现代生物育种河南省协同创新中心,河南 新乡 453003)
高温、低温、干旱、盐渍等非生物胁迫危害植物生长发育整个过程,影响农作物的产量及品质[1]。由于其固着生长的习性,植物已经在生理生化和分子水平上适应了这些胁迫,使自身在多变的环境条件下得以存活[2]。在胁迫环境下,植物通过一系列信号转导途径激活或抑制转录因子,结合顺式作用元件调控下游抗逆基因实现时空差异表达,从而抵抗不良环境。迄今为止,植物中已鉴定多个抗逆相关转录因子,包括NAC、bZIP、WRKY、AP2/ERF、MYC、bHLH和锌指蛋白等[3-5]。
大豆作为重要的粮食和油料作物,不利的外界环境如干旱和高盐等,对大豆生长发育及高产具有很大威胁。因此,有必要研究大豆应对非生物胁迫的分子机制,提高其抗逆性。本研究克隆了大豆GmZAT12基因,并对其进行生物信息学分析,通过实时荧光定量PCR(qRT-PCR)技术检测GmZAT12基因在大豆不同组织以及高温、低温、NaCl和ABA处理后的表达变化,旨在为进一步研究大豆GmZAT12基因的生物学功能奠定基础。
1 材料和方法
1.1 试验材料
选用的大豆材料为商豆1201。将大豆种植于大田,在盛花期取根、茎、叶片和花,在鼓粒期取剥去荚皮的大豆种子,用于后续RNA提取、基因克隆和组织表达分析。
1.2GmZAT12基因克隆和表达载体构建
采用植物总RNA提取试剂盒提取大豆RNA(Tiangen,DP432)并逆转录成cDNA。PCR扩增模板为大豆根的cDNA,上下游引物为,F:5′-GCTCTAGAATGAAGAGAGGCAGAGAAGAGG-3′,R:5′-CGCGGATCCAATGAAACAATTGAGGACGG-3′(下划线分别代表酶切位点XbaⅠ和BamH Ⅰ)。采用高保真酶Phanta@ Max Super-Fidelity DNA Polymerase(诺唯赞生物科技有限公司,P505)进行PCR扩增,反应体系按照说明书进行配制。PCR扩增程序为:95 ℃ 5 min;95 ℃ 15 s,55 ℃ 15 s,72 ℃ 1 min,32个循环;72 ℃彻底延伸5 min。PCR胶回收产物和植物表达载体pCambia1305-GFP分别用XbaⅠ和BamH Ⅰ双酶切,连接转化后筛选阳性菌液,提取质粒进行酶切并测序。
1.3GmZAT12的生物信息学分析
GmZAT12基因序列信息由Phytozome网站获得,氨基酸理化性质和潜在磷酸化位点使用ProtParam和NetPhos-3.1进行预测,SOPMA网站分析GmZAT12蛋白二级结构,同时利用MEGA X软件对氨基酸进行多序列比对和进化树构建。
1.4 GmZAT12的亚细胞定位分析
在快代谢组46例中,有2例换用替格瑞洛,没有发生心血管缺血事件;在44例继续口服氯吡格雷的患者中,17例再发心绞痛,其中2例再次靶血管重建。
将测序正确的质粒转化农杆菌感受态细胞GV3101,之后注射烟草叶片,暗培养48 h;使用激光共聚焦显微镜(Zeiss LSM780)观察GFP荧光在烟草叶片表皮细胞中的分布情况,以pCambia1305-GFP载体为对照。
1.5 非生物胁迫处理
取商豆1201种子种在蛭石中,人工气候室培养条件为光照(28 ℃、16 h)/黑暗(24 ℃、8 h),湿度70%,待大豆生长至第一对真叶完全展开时进行非生物胁迫处理。将大豆苗分别转移至40 ℃ (高温胁迫)和8 ℃ (低温胁迫)光照培养箱中,在0,2,4,8 h取大豆叶片;NaCl(300 mmol/L)和ABA(100 μmol/L)处理时间为0,2,4,8,24,48 h,取大豆根于冻存管中。液氮速冻后,-80 ℃冰箱保存备用。
1.6 qRT-PCR分析
根据GmZAT12基因序列设计qRT-PCR引物,RT-F:5′-AGGCAGAGAAGAGGGTGAGT-3′,RT-R:5′-CGTGATGCCACGACGAAAGA-3′;以Tubulin基因作为内参,Tubulin-F:5′-GGAGTTCACAGAGGCAGAG-3′,Tubulin-R:5′-CACTTACGCATCACATAGC-3′。按照SYBR Green Master Mix(诺唯赞生物科技有限公司,Q111)说明书配制反应体系,反应程序为:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 1 min,40个循环。采用2-ΔΔCt法计算基因的相对表达量,使用Origin 2019软件绘图。
2 结果与分析
2.1 大豆GmZAT12基因的克隆
用GmZAT12基因ID号(Glyma.13G333400)检索大豆基因组数据库,得到其CDS序列。以根的cDNA为模板,采用F和R引物进行PCR扩增,获得长度约500 bp的片段(图1)。将PCR产物连接至植物表达载体pCambia1305-GFP,测序结果与大豆基因组数据库参考序列进行Blast比对,结果表明,扩增片段与大豆基因组参考序列一致,GmZAT12基因克隆成功。
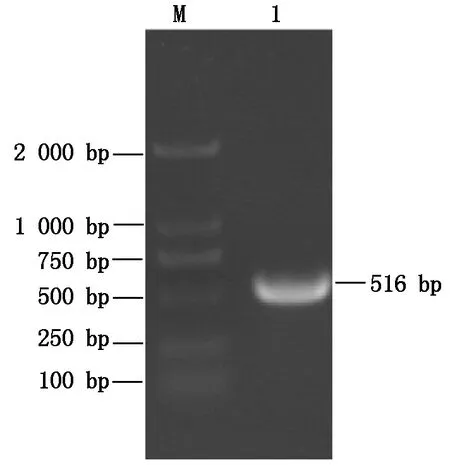
M.Marker DL2000;1.GmZAT12。
2.2GmZAT12的生物信息学分析
利用ProtParam对GmZAT12蛋白序列进行理化性质分析,结果表明,GmZAT12基因全长516 bp,共编码171个氨基酸,分子质量为19.264 28 ku,理论等电点(pI)为9.02,不稳定系数为37.00;经NetPhos-3.1预测,GmZAT12蛋白存在12个丝氨酸(Serine)、7个苏氨酸(Threonine)和1个酪氨酸(Tyrosine)磷酸化位点(图2);通过在线工具SOPMA对GmZAT12蛋白进行二级结构预测,结果显示,GmZAT12蛋白由β-折叠、无规则卷曲、α-螺旋和延伸链组成(图3),分别占总蛋白质的1.75%,62.57%,21.64%和14.04%。

图2 GmZAT12蛋白的磷酸化位点预测Fig.2 Prediction for phosphorylation sites of GmZAT12 protein
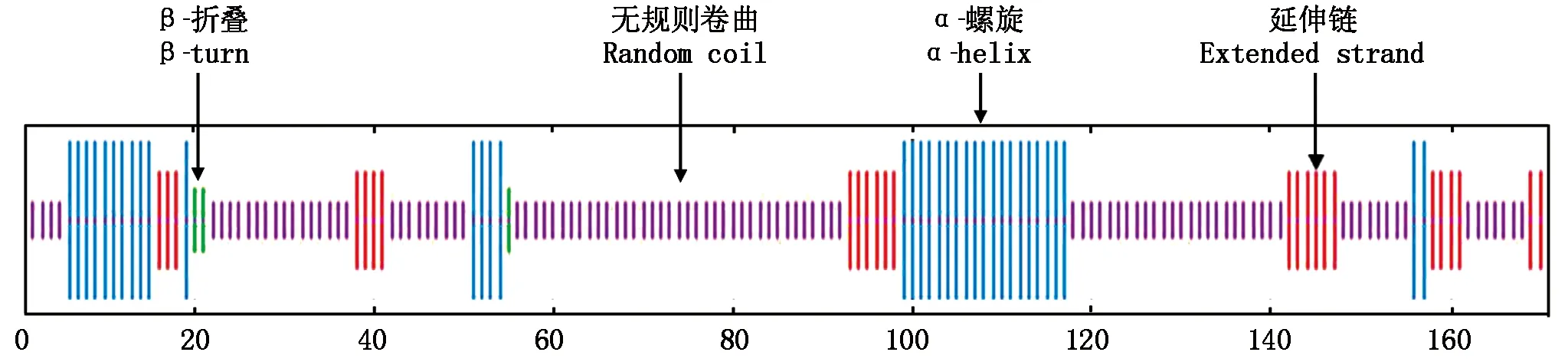
图3 GmZAT12蛋白的二级结构分析Fig.3 Secondary structure analysis of GmZAT12
将GmZAT12与其他植物物种的ZAT蛋白进行氨基酸序列比对,结果发现,这些蛋白质含有2个保守的C2H2锌指结构域(图4),即GmZAT12的40—64 aa和90—113 aa。从进化树可以看出(图5),GmZAT12与GmZF1聚为一支;与玉米、水稻、高粱、苜蓿和向日葵相比,大豆和拟南芥的ZAT蛋白亲缘关系更近。

GmZAT12的同源蛋白如下:大豆GmZF1(Glyma.15G040700)、GmZF2(Glyma.12G065800)和GmZAT8(Glyma.11G142500.1);水稻OsZAT12(XP_015638278.1)和OsZFP16(AAP74357.1);玉米ZmZAT12(XP_008654280.1)和ZmZAT8(XP_008660288.1);拟南芥AtZAT11(AT2G37430)、AtZAT18(AT3G53600)、AtZAT12(AT5G59820)和AtZF1(At2G28710);向日葵HaZAT11(XP_021973789.1);番茄SlZAT11(XP_004239776.1);苜蓿MtZAT11(XP_003621801.1)。图5同。
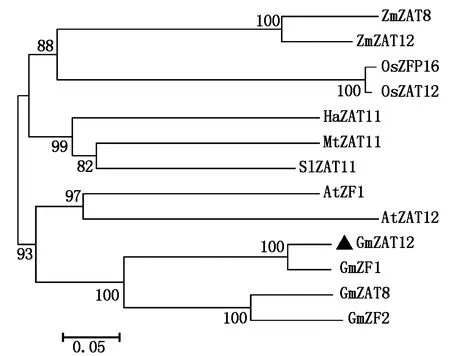
图5 GmZAT12和其他植物ZAT蛋白的进化树Fig.5 Phylogenetic tree of GmZAT12 and other plant ZAT proteins
2.3GmZAT12的组织表达分析
通过qRT-PCR检测GmZAT12在大豆不同组织的表达水平,结果显示,在大豆各个组织中均能够检测到GmZAT12基因表达,其中,根中表达量最高,其次依次是叶片和种子,在花和茎中表达量较低(图6)。

不同小写字母表示差异显著(P<0.05)。图8—9同。Different lowercase letters indicate significant difference.The same as Fig.8—9.
2.4GmZAT12蛋白的亚细胞定位分析
将植物表达载体pCambia1305-GmZAT12-GFP转化农杆菌GV3101后注射烟草叶片,空载体pCambia1305-GFP为阳性对照。激光共聚焦显微镜下观察GFP分布情况,结果显示,细胞核中可以检测到荧光信号(图7),说明GmZAT12定位于细胞核。
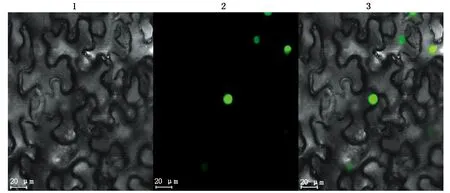
1.暗场;2.明场;3.融合。1.Dark field;2.Bright field;3.Merge.
2.5GmZAT12在非生物胁迫条件下的表达分析
为了探究GmZAT12如何响应非生物胁迫,利用qRT-PCR技术研究温度、NaCl和ABA处理后该基因的表达变化。从图8-A可以看出,低温处理2 h和4 h后基因上调表达,在处理8 h后基因表达降低;与低温胁迫不同,高温处理2 h后基因表达微弱上调,而在处理4 h后基因的表达量最高,然后下降(图8-B)。
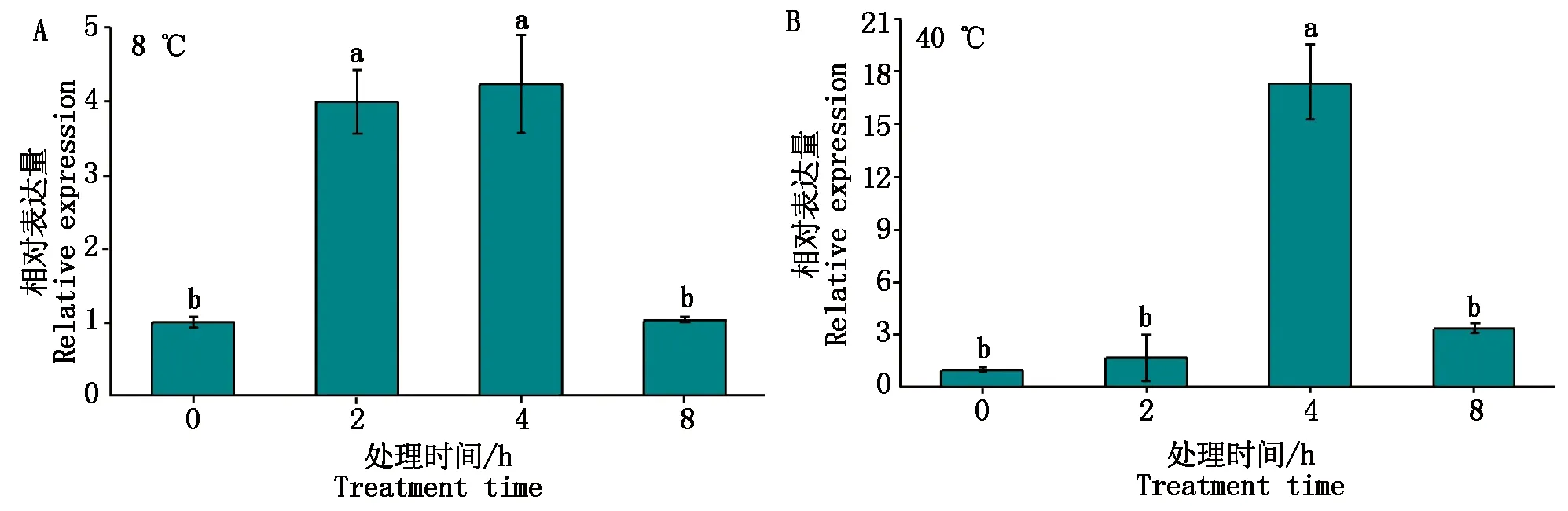
图8 不同温度胁迫处理下GmZAT12的表达分析Fig.8 Express analysis of GmZAT12 under different temperature stress treatments
从图9-A可以看出,NaCl处理GmZAT12基因表达量整体呈现先上升后下降的趋势,处理2 h和4 h后基因表达量升高,并在处理8 h后表达量达到最高,随后表达量降低;ABA处理后基因表达较复杂,处理后2,8,48 h后表达量相对较高,而在处理后4,24 h基因的表达量相对较低(图9-B)。
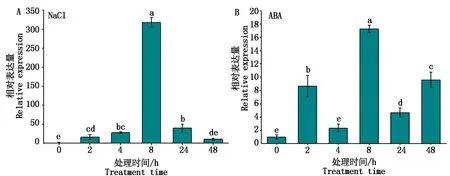
图9 NaCl和ABA处理后GmZAT12的表达分析Fig.9 Expression analysis of GmZAT12 under NaCl and ABA treatments
3 结论与讨论
锌指蛋白广泛参与植物的生长发育和对环境胁迫的应答反应[6]。本研究从大豆中克隆了一个C2H2型锌指蛋白基因GmZAT12,该基因全长516 bp,编码171个氨基酸,分子质量为19.264 28 ku,pI为9.02。对该基因编码蛋白和其他植物ZAT蛋白进行序列比对发现,GmZAT12含有2个保守的C2H2锌指结构域。进化树分析结果表明,GmZAT12与拟南芥AtZF1和AtZAT12亲缘关系更近,推测它们可能具有相似的功能。亚细胞定位分析显示,GmZAT12蛋白定位在细胞核,与同源蛋白AtZAT12[13]、GmZF1[14]、OsZAT12[15]定位结果一致,而GmZAT12是否具有转录激活或抑制功能、下游靶基因及表达调控机制仍需进一步研究。
GmZAT12在根中表达量最高,其次依次是叶片和种子,而在花和茎中表达量较低,预示该基因可能主要在根和叶片中发挥作用。C2H2型锌指蛋白基因主要参与植物的生长发育及多种逆境胁迫的应答[16-17]。如大豆锌指蛋白基因GmZFP3能够负向调节干旱响应[18],野生大豆锌指蛋白基因GsGIS3的过量表达提高了拟南芥的铝耐受性[19]。为了探究GmZAT12对非生物胁迫的响应,本研究分析了该基因在不同处理下的表达模式,发现GmZAT12受到高温、低温和NaCl诱导表达。前人研究发现,拟南芥AtZAT12在4 ℃以及38 ℃、NaCl处理后均表现为上调表达[20],GmZAT12呈现相似变化趋势,棉花GhZAT12在NaCl处理后表达量增加[21],推测ZAT12在不同物种中对NaCl胁迫具有相似的响应模式。
ABA在低温、干旱、渗透等胁迫信号途径中具有重要的调控作用,并且诱导一系列非生物胁迫响应基因的表达[22-23],如拟南芥锌指蛋白AZF2在ABA、干旱、NaCl处理后呈现明显的上调表达[24-25]。然而,也有报道发现,有些C2H2锌指蛋白受到脱水、冷胁迫诱导表达,但是并不响应外源ABA[26-27],暗示植物响应非生物胁迫可能存在2种信号转导途径,即ABA依赖途径和ABA非依赖途径。本研究结果发现,与高温、低温、NaCl处理后上调表达不同,GmZAT12在ABA处理后不同时间点的表达较复杂,呈现上升—下降—上升—下降—上升的趋势。前人研究报道,GmZF1在ABA处理3 h和5 h表达量上升,而在处理12 h表达量下降,处理24 h后表达量再次上升[14]。因此,推测GmZAT12可能与GmZF1相似,依赖ABA信号转导途径响应非生物胁迫。
