人β-防御素3转染脂肪干细胞成骨分化潜能及抗牙周炎致病菌的作用
2022-07-09蒋莉莉张艳东胡硕红
蒋莉莉, 张艳东, 胡硕红
(1. 河北省张家口宣钢医院 口腔科, 河北 张家口, 075100;2. 河北北方学院附属第二医院 重症科, 河北 张家口, 075100;3. 海南省海口市总医院 口腔科, 海南 海口, 570100)
难治性牙周病是发生在牙周支持组织的慢性感染性疾病,是造成成人牙齿缺失的重要原因[1]。目前临床主要治疗方法为全身局部应用抗生素及牙周引导组织再生手术等,但成功率较低[2-3]。β-防御素是一类重要的内源性抗菌肽,可调节机体免疫应答和炎症反应[4]。人β-防御素3(hβD-3)被认为是最具有潜力的防御素类抗菌肽,可有效抵抗牙周支持组织的病菌[5]。但hβD-3在机体内含量很少,且很难在体外大量合成。研究[6]发现,应用基因工程技术可以大量生成hβD-3。人脂肪干细胞(hADSCs)是具有多向分化潜能的干细胞,易获取、易培养,增殖速度快,已被安全有效地应用在退行性骨关节炎、糖尿病及其并发症和创伤修复等的治疗中,其可在基因工程中用于治疗牙周骨缺损[7]。有报道应用重组腺相关病毒和慢病毒为载体成功介导人滑膜间质干细胞及软骨细胞,并通过动物模型验证。因此,本研究采用慢病毒介导hβD-3基因转染hADSCs, 探讨hβD-3转染hADSCs成骨分化潜能及体外抗牙周炎致病菌的作用,以期寻找治疗难治性牙周炎牙周骨缺损的新方法。
1 材料与方法
1.1 主要材料与仪器
DMEM培养基(美国Gibco公司), hADSCs成骨诱导分化培养基[赛业(苏州)生物科技有限公司], 0.02% 乙二胺四乙酸(EDTA)+0.25%胰酶(美国Gibco公司),I型胶原酶(上海慧颖生物科技有限公司), MH琼脂培养基(广东环凯微生物科技有限公司), BHI琼脂培养基(上海邦景实业有限公司),RNA提取试剂盒和RNA反转录试剂盒(美国Promega Corporation公司), SYBR Green RT-PCR 试剂盒(日本TaKaRa公司), MA-6000实时荧光定量PCR仪(苏州雅睿生物技术有限公司), MB-530酶标仪(深圳市汇松科技发展有限公司), CytoFLEX LX流式细胞仪(美国Beckman-Coulter公司), CKX41倒置显微镜(日本Olympus公司)。
1.2 脂肪干细胞的培养与鉴定
本研究经伦理委员会审批且志愿者知情同意。在对志愿者行吸脂术时,用无菌管提取腹部脂肪组织20 mL左右,加入同等体积的磷酸盐缓冲液(PBS)反复冲洗,剪碎组织后1 h内移入离心管,加入0.075%的Ⅰ型胶原酶,震荡消化后加入DMEM培养基终止消化,以800转/min离心10 min, 采用差异贴壁法从成熟脂肪细胞、血细胞中分离hADSCs, 细胞在37 ℃、5% CO2的培养箱中培养,每日观察细胞生长状态,每隔3 d进行换液,待细胞长到培养瓶底部的90%左右后进行传代,取第3代细胞观察细胞形态,并用流式细胞仪对细胞免疫表型(CD29/CD44)进行鉴定。
1.3 hβD-3基因的慢病毒载体转染hADSCs
取第3代hADSCs进行转染,引物设计: 利用SGD软件设计引物, 5′端序列为5′-CTAGCTAGCCAAATCCATAGGG-AGCTCTG-3′; GCTAGC为限制性内切酶Nhel的酶切位点, ATA为终止密码子。3′端序列为5′-GGGTTTACC-GGTCATGTTTCAGGGTTTTTATT-3′; ACCGGT为限制性内切酶Agel的酶切位点, AGG为终止密码子。重组质粒构建: 抽提hADSCs的总RNA, 逆转录反应合成cDNA。采用聚合酶链反应(PCR)法扩增hβD-3至1.3 kb, 将Agel和Nhel从10 U/μL稀释到1 U/μL, 将扩增产物双酶切,并于70 ℃下灭活10 min, 100 V电泳后从质量浓度10 g/L琼脂糖凝胶上的1.3 kb条带处割胶,同时将已包含EGFP报告基因的pFUGW用Agel和Nhel双酶切,将双酶切后的载体和割下的胶带按1∶3比例在16 ℃下反应1 h, 期间加入T4 DNA, 即得到pFUGW-hβD-3重组质粒。病毒包装: 扩增pFUGW-hβD-3后,将质粒pMD2. G和psPAX2提纯浓缩至1 μg/μL, 在双蒸水中加入psPAX2 9 μg、pFUGW-hβD-3 31 μg、pMD2.G 10 μg, 总容量调至1 600 μL。加入BES 1 750 μL和2.5 mol/L的氯化钙(CaC12)150 μL, 混匀后室温下放置20 min。逐滴将上述混合物加入含293T细胞的培养瓶,将培养瓶保存于37 ℃、5% CO2培养箱中16 h, 弃上清,用0.45 μm滤纸过滤,将所得的病毒液(plentiV6-hβD-3)冻存于-80 ℃下备用。
1.4 增殖能力检测
将细胞分为3组: 对照组、空载组与实验组,对照组不作处理,空载组转染不含hβD-3基因的慢病毒载体,实验组利用质粒构建含hβD-3基因的慢病毒载体并转染hADSCs, 细胞长满培养瓶底部的90%左右时,消化离心后,以细胞培养液重悬,按50个/cm2密度接种于24孔板中,培养8 d, 每天分别取3孔,消化细胞后,采用细胞计数板对细胞进行计数,取平均值,绘制hADSCs生长曲线,横坐标为培养时间,纵坐标为细胞数。比较3组hADSCs的增殖能力。
1.5 分化能力检测
对照组不作处理,空载组与实验组均加入成骨分化诱导液,诱导7、14 d后应用实时荧光定量PCR检测3组细胞中成骨相关标志物[碱性磷酸酶(ALP)、Ⅰ-型胶原蛋白(Col-Ⅰ)、骨桥蛋白(OPN)、骨钙素(OCN)]的mRNA表达量,以评价hADSCs的分化能力。
方法如下: 用预冷的PBS漂洗细胞,每孔加500 μL裂解液, 5 min后收集混悬液,保存于-20 ℃待检,通过RNA提取试剂盒提取总RNA, 使用PrimeScipt RT试剂盒和茎环引物(5′-GTCGTATCAGCGAGGTATTCGTG-3′)对分离的RNA进行逆转录; 通过实时PCR检测系统使用SYBR试剂盒进行实时PCR, 将反应物在96孔板中于95 ℃扩增5 min, 然后95 ℃10 s, 55.7 ℃ 30 s, 进行40个循环; 以GAPDH为内参, 2-△△CT为目的基因相对表达强度,ALP的正向引物序列为5′-TAGCGTAGTCCACCACTAAGGCC-3′, 反向引物序列为5′-GAGCTCTGATTACTACGTCAGTCG-3′,Col-Ⅰ的正向引物序列为5′-GCCTGAAGCTGCCAGTTGAAGTC-3′, 反向引物序列为5′-GTGCAGGGTCCGAGGT-3′,OPN的正向引物序列为5′-CTAAGCATGCTACAATATTCGGTA-3′, 反向引物序列为5′-AGGCCTTGATGCCGTTAGCT-3′,OCN的正向引物序列为5′-CTCGCTTCGGCAGCACA-3′, 反向引物序列为5′-GTGCAGGGTCCGAGGT-3′,GAPDH的正向引物序列为5′-GTGCTAGAGCTCGTGATTCGCGTC-3′, 反向引物序列为5′-AACGCTTCACGAATTTGCGT-3′。
1.6 体外抑菌能力检测
采用琼脂弥散抑菌圈的方法进行样品测定。将对数生长期的葡萄球菌、卟啉单胞菌分别均匀涂布于MH琼脂培养基平板、BHI琼脂平板上,并将卟啉单胞菌BHI琼脂平板倒置在恒温(37 ℃)厌氧箱中进行为期72 h的厌氧培养。待菌液充分吸收后,利用直径为3 mm的打孔器均匀打孔。将纯化后的实验组hβD-3-hADSCs按不同密度(10个/cm2、100个/cm2、1 000个/cm2)接种于培养基孔中,分别记为低密度组、中密度组、高密度组,对照组与空载组的hADSCs以密度1 000个/cm2接种于培养基孔中, 37 ℃孵育过夜。利用电子数显卡尺测量抑菌圈的直径,重复5次,取平均值,另设置抗生素阳性对照组,抗生素阳性对照组分别为米诺环素组(30 μg)、环丙沙星组(5 μg)。
1.7 统计学方法
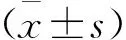
2 结 果
2.1 hADSCs的镜下观察及表面抗原表达
显微镜下观察原代及第3代hADSCs, 原代细胞培养2 d即可观察到细胞贴壁,大多为梭形,有少量的星形或分叉形细胞(图1A); 细胞培养传至P3代时,可观察到细胞呈漩涡状排列,几乎全呈长梭形(图1B)。流式细胞仪结果显示, hADSCs的表面标记物CD29、CD44均呈强阳性,阳性率为92.4%、90.0%, 符合干细胞的表面抗原表达,表明hADSCs纯度较高,见图1C、图1D。

A: 原代hADSCs(放大100倍); B: 第3代hADSCs(放大100倍); C: CD29表达; D: CD44表达。图1 hADSCs的镜下观察及表面抗原表达
2.2 增殖能力检测
3组hADSCs生长曲线均呈现出“S”形,培养不同时间时, 3组细胞数量比较,差异无统计学意义(P>0.05)。见图2。

图2 细胞生长曲线
2.3 诱导7 d后形态学观察
诱导7 d后,对照组细胞仍呈长梭形,空载组与实验组细胞核变大,形态开始变宽大扁平,有向多角形变化的趋势。见图3。
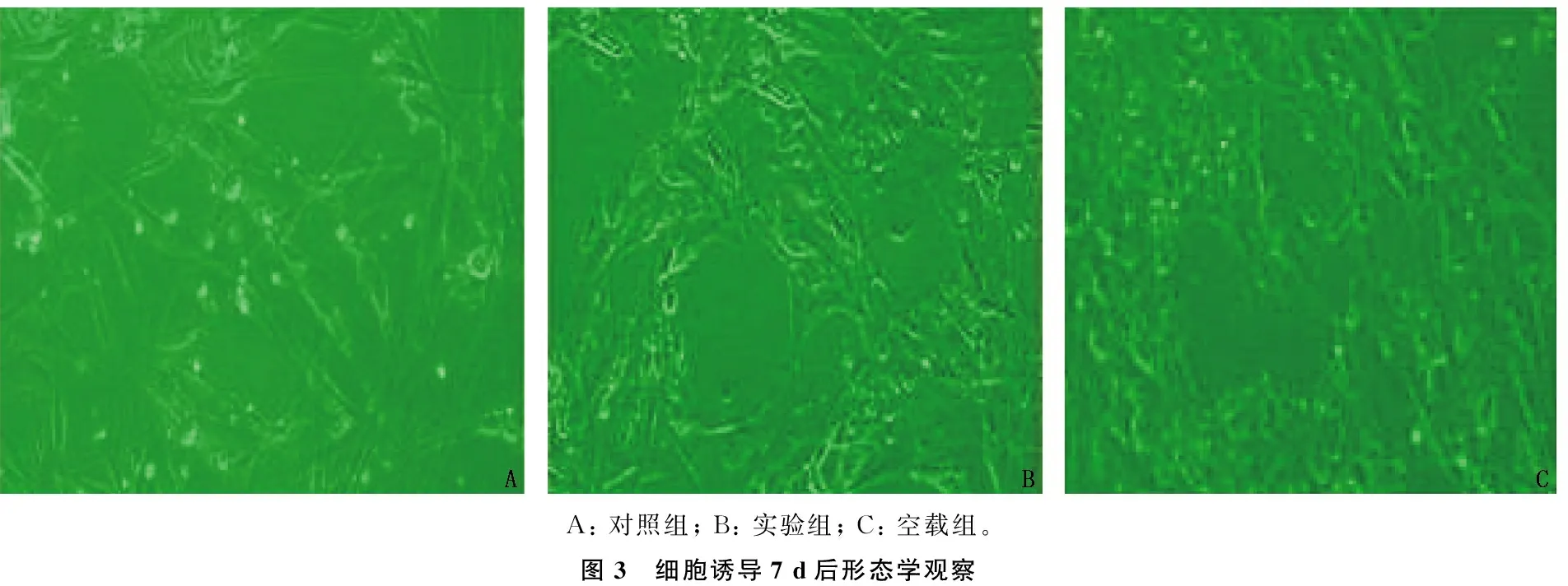
A: 对照组; B: 实验组; C: 空载组。图3 细胞诱导7 d后形态学观察
2.4 ALP、Col-Ⅰ、OPN、OCN mRNA相对表达量
诱导7、14 d时,空载组与实验组的ALP、Col-Ⅰ、OPN、OCNmRNA相对表达量均高于对照组,差异有统计学意义(P<0.05); 空载组与实验组诱导14 d时的ALP、Col-Ⅰ、OPN、OCNmRNA相对表达量高于诱导7 d时,差异有统计学意义(P<0.05)。见图4。

A: ALP mRNA相对表达量; B: Col-Ⅰ mRNA相对表达量; C: OPN mRNA相对表达量; D: OCN mRNA相对表达量。与对照组比较, *P<0.05; 与诱导7 d时比较, #P<0.05。图4 ALP、Col-Ⅰ、OPN、OCN mRNA相对表达量
2.5 体外抑菌能力检测
葡萄球菌抑菌实验中,低密度组抑菌圈小于米诺环素组与环丙沙星组,差异有统计学意义(t=20.120,P<0.001;t=6.149,P<0.001); 中密度组抑菌圈大于环丙沙星组,差异有统计学意义(t=7.250,P<0.001), 与米诺环素组抑菌圈比较,差异无统计学意义(t=0.857,P=0.416); 高密度组抑菌圈大于米诺环素组与环丙沙星组,差异有统计学意义(t=8.061,P<0.001;t=15.233,P<0.001)。卟啉单胞菌抑菌实验中,低密度组抑菌圈小于米诺环素组与环丙沙星组,差异有统计学意义(t=6.768,P<0.001;t=15.765,P<0.001); 中密度组抑菌圈大于米诺环素组,差异有统计学意义(t=8.216,P<0.001), 与环丙沙星组比较,差异无统计学意义(t=1.158,P=0.250); 高密度组抑菌圈大于米诺环素组与环丙沙星组,差异有统计学意义(t=13.457,P<0.001;t=10.256,P<0.001)。见表1。

表1 各组抑菌圈直径比较 mm
3 讨 论
牙周炎由牙菌斑中细菌侵犯牙周引起,好发于35岁以上的成年人群,男性发病率高于女性[8]。难治性牙周病指由某些特异性微生物引起的感染,治疗成功率较低,可导致患者牙齿缺损,严重影响患者正常工作和生活[9]。因此,寻找安全有效的治疗方法具有重要的意义。β-防御素是一类富含二硫键的阳离子型多肽,是动物黏膜组织抵御外界病原微生物侵袭的第一道化学屏障,是生物免疫系统中的重要调节分子[10]。在β-防御素家族中, hβD-3对金黄色葡萄球菌等革兰阳性菌、革兰阴性菌以及酵母、白色念珠菌都具有强烈的杀伤作用,且在生理盐水中活性不受影响,其对福赛氏类杆菌、齿密螺旋体、牙龈卟啉单胞菌、牙龈卟啉菌等的杀伤能力远大于其他种类防御素[11],故可采用hβD-3治疗难治性牙周病。但hβD-3很难在体内大量生成,因此,寻找体外大量生成hβD-3的方法极为关键。
近年来,干细胞治疗牙周骨缺损的可能性被提出, hADSCs取材简便、来源丰富、易于培养,对机体损伤小,且具有多向分化潜能[12-13]。因此本研究选用脂肪干细胞作为种子细胞。本研究结果发现,显微镜下原代细胞培养2 d即可观察到细胞贴壁,大多为梭形,有少量的星形或分叉形细胞; 细胞培养传至P3代时,可观察到细胞呈漩涡状排列,几乎全呈长梭形,符合干细胞形态学。流式细胞仪结果显示, hADSCs的表面标记物CD29、CD44均呈强阳性,阳性率为92.4%、90.0%, 符合干细胞的表面抗原表达,表明hADSCs纯度较高。3组细胞生长曲线均呈现出“S”形,符合细胞的生长规律,且在7~8 d保持稳定,提示转染后的hADSCs并未无限制生长。
本研究结果还显示,诱导7 d后,对照组细胞仍呈长梭形,空载组与实验组细胞核变大,形态开始变宽大扁平,有向多角形变化的趋势。诱导7、14 d时,空载组与实验组的ALP、Col-Ⅰ、OPN、OCNmRNA相对表达量均高于对照组,空载组与实验组诱导14 d时的ALP、Col-Ⅰ、OPN、OCNmRNA相对表达量高于诱导7 d时,提示转染后的hADSCs具有成骨分化的潜能。转染后的hADSCs可直接向成骨方向分化,以促进骨折愈合及加速骨缺损修复,有助于治疗牙周缺损。在葡萄球菌、卟啉单胞菌抑菌实验中,高密度组抑菌圈均大于米诺环素组与环丙沙星组,提示转染后的hADSCs可稳定表达hβD-3, 且具有一定的抗菌性。分析原因可能是,慢病毒载体介导的hβD-3基因转染可整合入宿主染色体,在细胞内稳定持久表达。hβD-3表达后分子带正电荷可利用静电作用与带负电荷的细菌胞膜结合,疏水区形成多个通道,破坏胞膜造成胞外的离子等流入胞内,胞内重要成分外流,最终致使细菌死亡。研究[14]发现,hβD-3基因转染处理大鼠牙周膜细胞,可降低牙周炎大鼠组织破坏,减轻牙周组织炎症。另一研究[15]发现,慢病毒转染人β-防御素后,可显著抑制角质形成细胞的促炎因子表达,亦可抑制牙周炎主要致病微生物的增殖。
综上所述,经hβD-3基因的慢病毒载体转染hADSCs, 细胞可正常传代生长,诱导成骨分化,转染后的hADSCs对葡萄球菌、卟啉单胞菌均有较好的抗菌活性,抑菌圈随着细胞浓度升高而增大,可为治疗难治性牙周病提供新的治疗手段。
