MDA-PCR检测痕量结核分枝杆菌核酸方法的建立*
2022-07-08周林甫万群赵钢张红鸭
周林甫, 万群, 赵钢, 张红鸭
1西北大学医学院(陕西西安 710068); 2空军军医大学西京医院神经内科(陕西西安 710032); 3深圳大学总医院神经内科(广东深圳 518055)
结核病仍然是全世界最致命的感染性疾病之一,被称为继艾滋病之后的人类第二大杀手,系结核分枝杆菌 (mycobacterium tuberculosis,M.tb) 感染机体所致,多数以呼吸系统受累为主,而结核性脑膜炎 (tuberculous meningitis, TBM) 则是M.tb感染的最严重形式[1],约占所有结核病1%~5%[2]。尽管给予积极抗结核治疗,仍有超过半数患者最终死亡或遗留严重后遗症[3]。因脑脊液 (cerebrospinal fluid, CSF) 中M.tb涂片镜检、培养等传统检测方法敏感性低,费时费力等不足,使TBM早期诊断仍然面临着很多挑战[4]。随着分子生物学的快速发展,CSF中M.tb核酸检测是当前TBM早期诊断方法研究的热点。然而,由于TBM患者CSF中含有痕量M.tb,并且在标本处理、核酸提取及纯化等过程中可能造成核酸产量和质量进一步下降而影响核酸检测效果[5]。即使是近年来兴起的下一代测序技术 (next-generation sequencing, NGS) 与芯片技术等高通量分析方法也往往受限于样品量过少而无法更好地发挥作用[6]。因此,如何获得足量的病原体基因组DNA是M.tb核酸检测是能否成功的关键。多重置换扩增 (multiple displacement amplification, MDA) 技术是基于噬菌体29 (Phi 29) 高保真DNA聚合酶等温PCR反应的全基因组扩增 (whole genome amplification, WGA) 方法,它可以高保真地将微小数量的DNA成指数级扩增,并可以达到最佳基因组覆盖率和最低的扩增偏差[7-8]。近年来,该技术已经被广泛应用于生物基因检测、胚胎疾病诊断、临床标本病原体鉴定、法医学鉴定及环境样本微生物多样性的相关研究中[9-12]。无论是面对痕量生物标本还是残留组织,甚至是单细胞,该方法均可实现对基因组DNA扩增富集,进而为之后的基因组研究提供充足的DNA模板[9]。然而,有关应用MDA技术检测CSF中M.tb核酸的研究却鲜有报道。因此,我们于2015年12月至2017年4月开展本研究,基于MDA-PCR技术拟建立对CSF中痕量M.tb核酸检测的新方法,并通过对模拟TBM患者CSF标本检测来验证该方法的可行性及可靠性。
1 材料与方法
1.1 材料
1.1.1 菌株M.tb标准菌株H37Ra (ATCC25177),绿脓杆菌 (P.aeruginosa) 标准菌株 (ATCC27853),金黄色葡萄球菌 (S.aureus) 标准菌株 (ATCC25923),大肠埃希菌 (E.coli) 标准菌株 (ATCC25922),肺炎克雷伯菌 (K.pneumoniae) 标准菌株 (ATCC 35657),鲍曼不动杆菌 (A.baumannii) 标准菌株 (BAA-74),均由空军军医大学西京医院检验科保存。卡介苗 (BCG) 购自上海市生物制品研究所。
1.1.2 质粒与细胞系 大肠杆菌 (E.coli) 细胞由本室保存,pGEM-T载体购于Promega公司。
1.1.3 主要试剂与仪器 普通PCR仪 (德国Eppendof公司);凝胶电泳仪 (美国CLP公司);核酸蛋白检测仪 (德国Eppendof公司);电热恒温培养箱 (博泰仪器公司(上海));生物电泳成像分析系统 (上海复日科技公司);BACT-MGIT 960全自动培养仪 (美国BD公司);QIAamp DNA Mini Kit基因组DNA提取试剂盒 (德国QIAGEN公司);琼脂糖凝胶胶回收纯化试剂盒 (美国OMEGA公司);Premix TaqTM(大连TaKaRa公司);溶菌酶 (美国Sigma公司);质粒提取试剂盒 (美国OMEGA公司);REPLI-g全基因组扩增试剂盒 (德国QIAGEN公司)。
本研究已经空军军医大学西京医院伦理委员会审批通过 (KY20163367-1号)。
1.2 方法
1.2.1 引物的设计与合成 运用Oligo 6.5软件对从GenBank中获取的M.tb复合群的特异性插入序列 (IS6110和IS1081) 进行分析比对并设计特异性引物 (表1),交由上海生工进行合成。

表1 引物序列
1.2.2 BCG基因组DNA的提取及PCR扩增 BCG基因组DNA的提取按照试剂盒说明书进行。PCR反应体系 (25 μL) 组成如下: DNA模板 1 μL, 上下游引物各1 μL (10 μmol/μL), Premix TaqTM12.5 μL, 加无菌去离子水补至25 μL。 PCR反应条件: 95℃预变性10 min, 然后95℃ 30 s, 60℃ 30 s, 72℃ 60 s, 共35个循环, 72℃延伸10 min。
1.2.3 重组质粒的构建与鉴定 首先按照试剂盒说明书回收、纯化BCG基因组DNA的PCR扩增产物,然后将回收产物与pGEM-T载体连接,制备感受态细胞、转化,最后将重组质粒进行筛选与鉴定。
1.2.4 质粒DNA标准品的制备 根据Plasmid Mini kit试剂盒说明书提取质粒DNA,制备系列稀释的质粒DNA标准品。将新提取的质粒DNA按照以下公式进行定量:copies/μL = (6.02×1023copies/mol)×(con ng/μL) ×10-9/ (MW g/mol),计算质粒DNA的总拷贝数,然后将其系列稀释至105、 104、 103、 500、 250、 125、 75、 25、 10 copies /μL。
1.2.5 ST-PCR及MDA-PCR扩增反应 以质粒DNA标准品为模板分别进行ST-PCR及MDA-PCR检测,分析两种方法对质粒DNA标准品的最低检测下限。根据REPLI-g试剂盒 (QIAGEN)说明,应用Phi 29 DNA聚合酶 (New England BioLabs) 对系列稀释的质粒DNA样品进行MDA反应,随后以MDA扩增产物(MDA-Products) 为模板进行PCR扩增,最后将MDA-Products经1.5%琼脂糖凝胶电泳鉴定分析。MDA-PCR反应体系:MDA-products 1 μL, 上下游引物各1 μL (10 μmol/μL), Premix TaqTM12.5 μL, 加无菌去离子水补至25 μL。 PCR反应条件: 95℃ 预变性10 min, 然后 95℃ 30 s, 60℃ 30 s, 72℃ 60 s, 共35个循环, 72℃延伸10 min, 4℃保存。
1.2.6 MDA-PCR的敏感度及特异度分析 先将新鲜制备的系列稀释的质粒DNA进行MDA扩增,然后以MDA-Product为模板进行PCR扩增,评估MDA-PCR方法对质粒DNA标准品的检测敏感度。以综合性医院患者感染常见细菌 (P.aeruginosa,S.aureus,E.coli,K.pneumoniae,A.baumannii) 标准菌株基因组DNA为模板分别进行MDA-PCR检测,观察是否有非特异性反应发生,评估MDA-PCR检测方法的特异度。
1.2.7 MDA-PCR对模拟TBM患者CSF标本的检测 首先将Bactec MGIT 960系统内培养的M.tbH37Ra按照麦氏比浊法进行计数,以0.5麦氏单位的M.tb菌悬液为原液,用生理盐水将其10倍系列稀释成以下阳性标准品:107、 106、 105、 104、 103、 102、 101、 1 cfu/mL,85℃水浴30 min灭活,1 mL/管分装,于-20℃保存。然后将制备的阳性标准品分别与非感染患者CSF混匀作为模拟TBM检测标本。最后以CSF标本中提取的M.tbH37Ra基因组DNA为模板,分别进行ST-PCR及MDA-PCR扩增。
2 结果
2.1 引物验证及重组质粒DNA鉴定 针对IS6110和IS1081基因序列设计的两对引物分别对BCG基因组DNA扩增出245 bp、310 bp的目的条带 (图1)。另外,分别以两种重组质粒DNA为模板,均可实现对IS6110和IS1081基因的有效扩增,无非特异性反应发生。PCR回收产物测序结果显示两种重组质粒DNA (6110和1081) 的扩增序列均与预期结果一致。
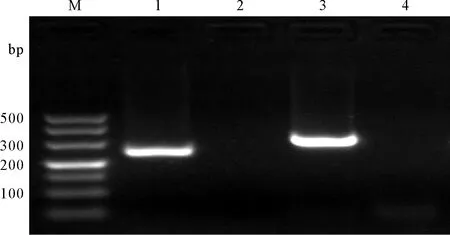
注:M: DNA marker DL500;1、3泳道:BCG基因组DNA模板;2、4泳道:灭菌去离子水(阴性对照)
2.2 MDA-PCR方法的检测敏感度分析 采用IS6110引物时ST-PCR方法对质粒DNA样品的最低检测下限为103拷贝,而MDA-PCR方法对质粒DNA样品的最低检测下限为10拷贝,后者的检测敏感度较前者提高了100倍。采用IS1081引物时,ST-PCR方法与MDA-PCR的最低检测下限分别为103、25拷贝。见表2。
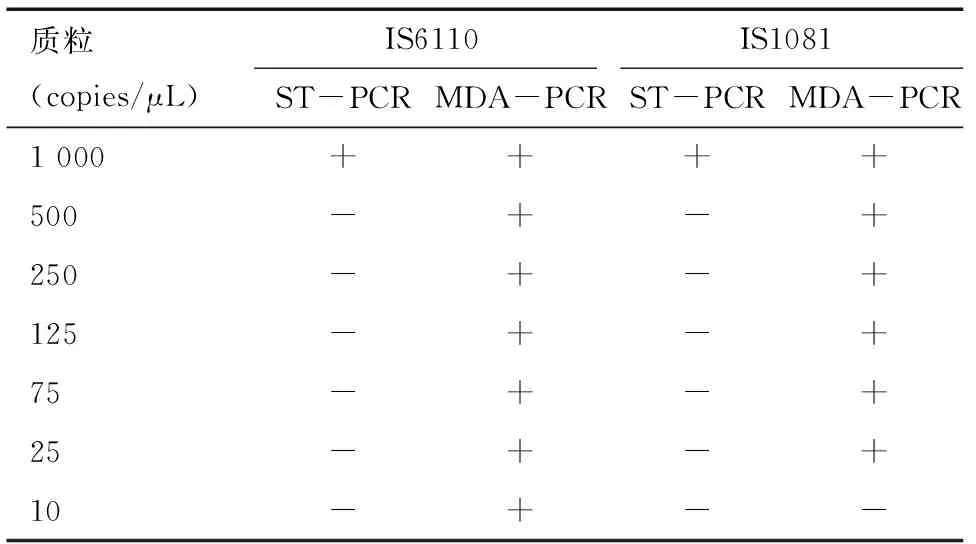
表2 ST-PCR及MDA-PCR对质粒DNA标准品的扩增结果
2.3 MDA-PCR方法的特异度分析 分别采用IS6110和IS1081引物时,MDA-PCR方法对M.tbH37Ra基因组DNA扩增出目的条带,而对其他5种细菌基因组DNA均未扩增出目的条带,并且无非特异性扩增出现。见表3。

表3 MDA-PCR方法对细菌标准株基因组DNA的检测结果
2.4 MDA-PCR方法对模拟TBM患者CSF标本的检测 采用IS6110引物时,ST-PCR (图2-A) 对模拟标本中M.tb的最低检测下限为104CFU,而MDA-PCR方法 (图2-B) 对模拟标本中M.tb的最低检测下限为1 CFU。采用IS1081引物时,ST-PCR (图3-A) 对模拟标本中M.tb的最低检测下限为105CFU,而MDA-PCR方法对模拟标本中M.tb的最低检测下限为1 CFU (图3-B)。
3 讨论
本研究旨在应用MDA-PCR技术建立检测CSF中痕量M.tb核酸的新方法,为达到对整个M.tb复合群的覆盖提高检出率,选择将IS6110和IS1081序列均作为目的检测基因。IS6110序列是M.tb基因组中一个多拷贝基因,在M.tb复合群基因组可表达6~20个拷贝,扩增效率及敏感性高,但在某些临床分离株基因组中可能会出现表达缺失[13]。Collins等[14]在牛型M.tb基因组中发现了IS1081序列,该序列可在所有M.tb复合群基因组中稳定表达5~7个拷贝。Boyle等[15]以IS6110和IS1081为检测基因应用重组酶聚合酶扩增 (RPA) 技术实现对肺结核患者痰标本的检测。国内学者李自慧等[16]也曾建立基于IS6110和IS1081序列的微滴数字PCR反应体系用于肺结核患者痰和血浆标本的筛查,均达到了良好结果。

注:A:ST-PCR扩增IS6110基因,1~6号泳道:依次为105、104、103、102、101、1 cfu/mL 的H37Ra基因组DNA;7号泳道:无菌去离子水为阴性对照;B:MDA-PCR扩增IS6110基因,1~6号泳道:依次为105、104、103、102、101、1 cfu/mL 的H37Ra基因组DNA的MDA扩增产物;7号泳道:无菌去离子水为阴性对照
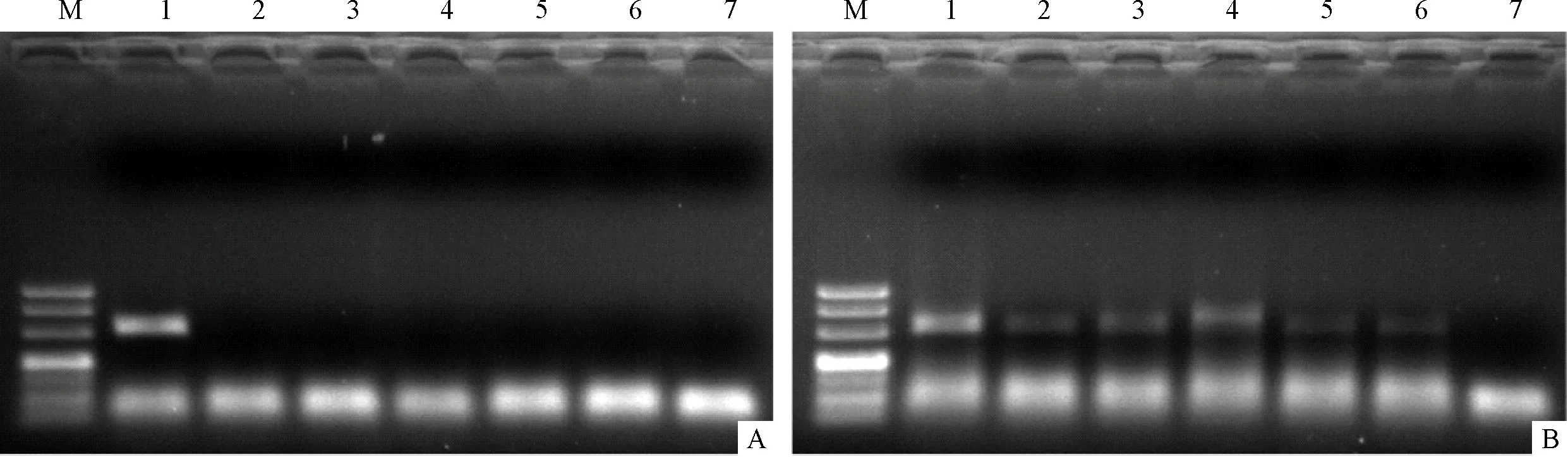
注:A:ST-PCR扩增IS1081基因,1~6号泳道:依次为105、104、103、102、101、1 cfu/mL 的H37Ra基因组DNA;7号泳道:无菌去离子水为阴性对照;B:MDA-PCR扩增IS1081基因,1~6号泳道:依次为105、104、103、102、101、1 cfu/mL 的H37Ra基因组DNA的MDA扩增产物;7号泳道:无菌去离子水为阴性对照
在实验中,我们对包含两种目的基因的新鲜质粒DNA样品先进行了MDA反应,随后再通过MDA-PCR检测分析该方法的检测敏感度。实验结果表明,MDA-PCR方法对MDA预处理后质粒DNA标准样品IS6110、IS1081基因的检测敏感度分别是ST-PCR的100、40倍。我们猜测,通过MDA反应后质粒DNA模板数量得到大量增加,然后再以MDA扩增产物为模板进行二次PCR可明显提高该方法对标准质粒DNA的检测范围。Dean等[17]曾报道,使用随机引物及Phi 29高保真DNA聚合酶可以使来自单个菌落或斑块的M13或质粒DNA模板在数小时内扩增10 000倍。另外,为验证MDA-PCR方法的特异性,我们在实验中分别以M.tb标准株和5种其他细菌标准株的基因组DNA为对照进行了MDA-PCR检测。分别采用IS6110和IS1081引物时,该方法仅对M.tbH37Ra的基因组DNA扩增出目的条带,而对其他5种细菌标准株的基因组DNA检测阴性,并且无非特异性反应发生。结果证实MDA-PCR方法具有较高的检测特异性。文献报道显示,MDA反应依靠随机引物引发聚合,导致了DNA扩增,同时可能会污染DNA[18]。幸运的是,本研究中并未发现MDA-PCR在检测过程中出现非特异性扩增。Gonzalez等[19]应用MDA技术富集环境样本的基因组DNA模板,通过MDA-PCR可将基因检测敏感度提高10倍。国内学者陈玲等[20]将MDA技术应用于法医学微量DNA的检测研究,结果显示应用该方法可将模板DNA总量增加104~106倍。
为进一步探索MDA-PCR方法检测CSF中M.tb的可行性,我们对系列稀释的模拟TBM患者CSF标本进行了检测验证。结果表明,MDA-PCR方法对模拟TBM患者CSF标本中M.tb的最低检测下限可达到1个CFU,该方法对CSF中M.tb的检测敏感度比ST-PCR高104~105倍,并且具有很好的重复性和特异性。然而,值得注意的是,虽然MDA-PCR方法对模拟TBM患者CSF标本IS6110和IS1081基因的检测敏感度一致,但是ST-PCR方法检测2个基因的敏感度却存在差异,猜测这可能与2种基因在M.tb基因组中的表达量不一致有关。
Wu等[21]应用MDA-PCR对200份痰标本进行了IS6110基因的检测,该方法诊断肺结核的敏感性及特异性较普通PCR提高了15%~20%。与之比较,本研究针对CSF标本同时检测IS6110和IS1081基因将有助于提高对M.tb的检出率,可尽可能避免假阴性结果而导致漏诊。
本研究虽然基本解决了如何富集CSF中痕量M.tb核酸的问题,并初步建立了MDA-PCR检测CSF中M.tb核酸的新方法,但是对临床确诊或疑似TBM患者标本未进行检测验证,以及与传统检测方法比较分析。因此,在下一步研究中,我们将通过设计临床试验,纳入大样本量患者,进一步探索和评估该方法在TBM早期诊断中的价值。
综上所述,基于MDA技术建立的检测CSF中痕量M.tb核酸的新方法有助于解决TBM核酸诊断面临的CSF中M.tb数量或核酸不足的难题,该方法可能提高对TBM患者CSF标本中M.tb的检测效率,为TBM早期诊断提供了一种新的研究策略,具有一定的应用前景。
利益相关声明:所有作者均声明不存在任何利益冲突。
作者贡献说明:周林甫负责实验设计、实验及撰写论文;万群负责分析数据、撰写论文。赵钢、张红鸭负责指导及论文修改。
