吉西他滨联合顺铂联合程序性细胞死亡受体1抗体免疫治疗转移性鼻咽癌有效性及安全性分析
2022-07-08林先桃王发鹏
林 冰, 周 平, 刘 沙, 张 爽, 林先桃, 杨 屏, 王发鹏
1.海南医学院第一附属医院 放疗科,海南 海口 570102;2.海南省肿瘤医院 放疗科,海南 海口 570300
鼻咽癌为常见头颈部肿瘤,约75%患者就诊时已是中晚期,以放化疗结合的综合治疗为首选治疗方案,5年生存率可达80%,但仍有部分患者死于远处转移及局部复发[1]。综合治疗后进展的转移性鼻咽癌患者预后较差,目前尚无标准治疗方案,以铂类为基础的姑息性化疗仍为目前首选方案。吉西他滨联合顺铂(GP方案)的疗效与耐受性优于其他方案,目的在于减轻患者症状,延长生存期[2]。程序性细胞死亡受体1(programmed death-1,PD-1)/程序性死亡受体配体1(programmed death-ligand-1,PD-L1)单抗被证实具有明显抗肿瘤作用,但抗PD-1免疫治疗在鼻咽癌治疗领域的起步较晚,直到2020年中国临床肿瘤学会指南才正式推荐PD-1抑制剂用于复发/转移鼻咽癌的临床治疗[3-4]。本研究旨在探讨GP方案联合PD-1抗体免疫治疗转移性鼻咽癌的有效性与安全性。现报道如下。
1 资料与方法
1.1 一般资料 选取自2019年2月至2022年2月海南医学院第一附属医院与海南省肿瘤医院收治的98例转移性鼻咽癌患者为研究对象。采用随机数字表法将其分为A组与B组,每组各49例。纳入标准:治疗前至少有1个可测量的客观病灶;年龄18~75岁;预计生存时间≥3个月。排除标准:对治疗药物过敏者;伴器官功能障碍、呼吸道疾病或不能控制的高血压、糖尿病等慢性疾病者;伴严重活动性出血或感染、周围或中枢神经系统障碍、精神疾者。A组:男性32例,女性17例;平均年龄(52.25±5.98)岁;转移灶(2.85±0.41)个。B组:男性34例,女性15例;平均年龄(50.28±6.32)岁;转移灶(2.78±0.37)个。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准。所有患者均签署知情同意书。
1.2 治疗方法 A组患者采用GP方案治疗:吉西他滨1.0 g/m2,溶于100 ml生理盐水静脉滴注;顺铂70 mg/m2加入500 ml生理盐水静脉滴注。21 d为1个周期。静脉滴注前30 min,使用5-羟色胺3受体拮抗药预防呕吐并给充分水化,常规给予地塞米松、苯海拉明和西咪替丁抗过敏,并适当补液、水化利尿等。B组患者在A组基础上联合PD-1抗体免疫治疗。特瑞普利单抗(苏州众合生物医药科技有限公司,国药准字S20180015,规格0.24 g)240 mg,静脉滴注。至少化疗2个周期。行磁共振、CT等影像学检查。治疗期间每周监测血常规、肝肾功能及电解质。结合实际情况给予止吐药物、降压药物及营养支持治疗。
1.3 观察指标及疗效评价标准 检测并比较两组患者CD3+、CD4+/CD8+、自然杀伤细胞(natural killer cell,NK)等外周血免疫指标。截至2021年10月,记录两组患者的无进展生存时间(progression-free survival,PFS)、总生存时间(overall survival,OS),采用Kaplan-Meier法绘制OS与PFS的生存曲线。记录并比较两组患者不良反应发生情况。疗效评价标准[5]:完全缓解(complete remission,CR),所有目标病灶消失;部分缓解(partial remission,PR),基线病灶长径总和缩小≥30%;稳定(stable disease,SD),基线病灶长径总和缩小但未达PR或长径有增加但未达进展(progressive disease,PD);PD,基线病灶长径总和缩小≥20%或出现新病灶。
客观缓解率(overall response rate,ORR)=(CR+PR)例数/总例数×100%
疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%
1.4 统计学方法 采用SPSS 19.0统计学软件对数据进行处理。计量资料用均数±标准差(±s)表示,组间比较采用t检验。计数资料用例(百分率)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较 两组患者DCR比较,差异无统计学意义(P>0.05);B组患者ORR高于A组,差异有统计学意义(P<0.05)。见表1。
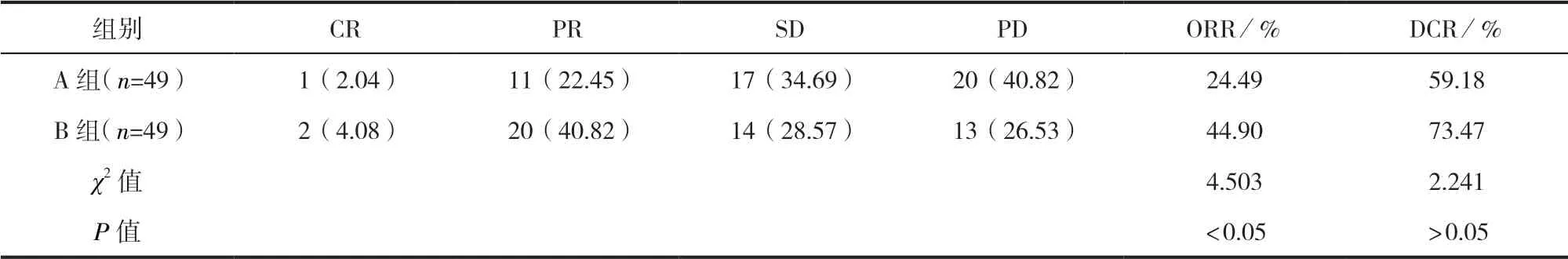
表1 两组患者临床疗效/例(百分率/%)
2.2 两组患者外周血免疫指标比较 治疗前,两组患者的外周血CD3+、CD4+/CD8+、NK比较,差异均无统计学意义(P>0.05)。治疗后,两组患者CD3+、CD4+/CD8+较治疗前均升高,NK较治疗前降低,且B组CD3+、CD4+/CD8+均高于A组,NK低于A组,差异均有统计学意义(P<0.05)。见表2。
表2 两组患者外周血免疫指标比较(±s)
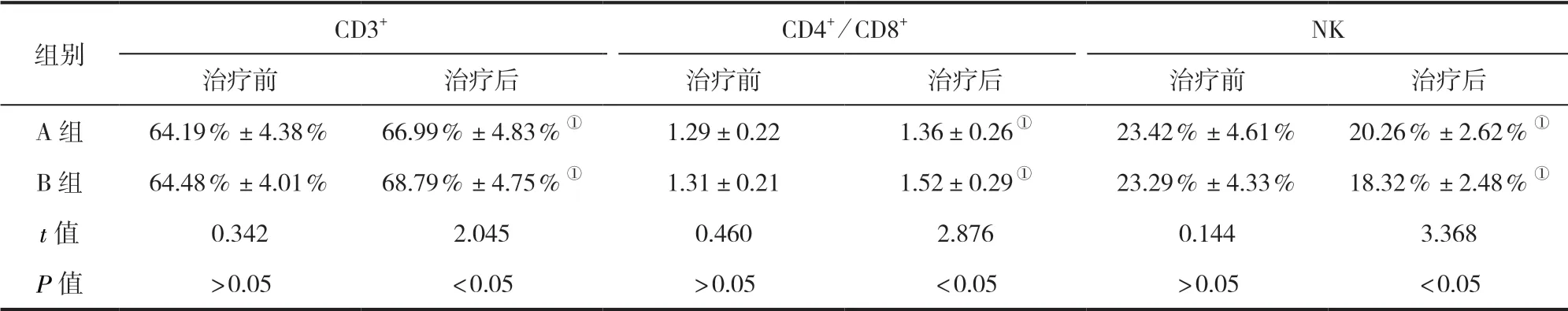
表2 两组患者外周血免疫指标比较(±s)
注:与本组治疗前比较,①P<0.05
组别CD3+ CD4+/CD8+ NK治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A组 64.19%±4.38% 66.99%±4.83%① 1.29±0.22 1.36±0.26① 23.42%±4.61% 20.26%±2.62%①B组 64.48%±4.01% 68.79%±4.75%① 1.31±0.21 1.52±0.29① 23.29%±4.33% 18.32%±2.48%①t值 0.342 2.045 0.460 2.876 0.144 3.368 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3 两组患者生存分析 两组患者均完成随访,无脱落病例。A组:PFS 2~7个月,中位PFS(4.37±1.01)个月;OS 7~12个月,中位OS(9.87±2.99)个月。B组:PFS 3~8个月,中位PFS(5.14±1.06)个月;OS 9~16个月,中位OS(12.31±3.23)个月。Kaplan-Meier生存曲线结果显示,B组患者中位PFS、OS均高于A组,差异均有统计学意义(P<0.05)。见图1、2。
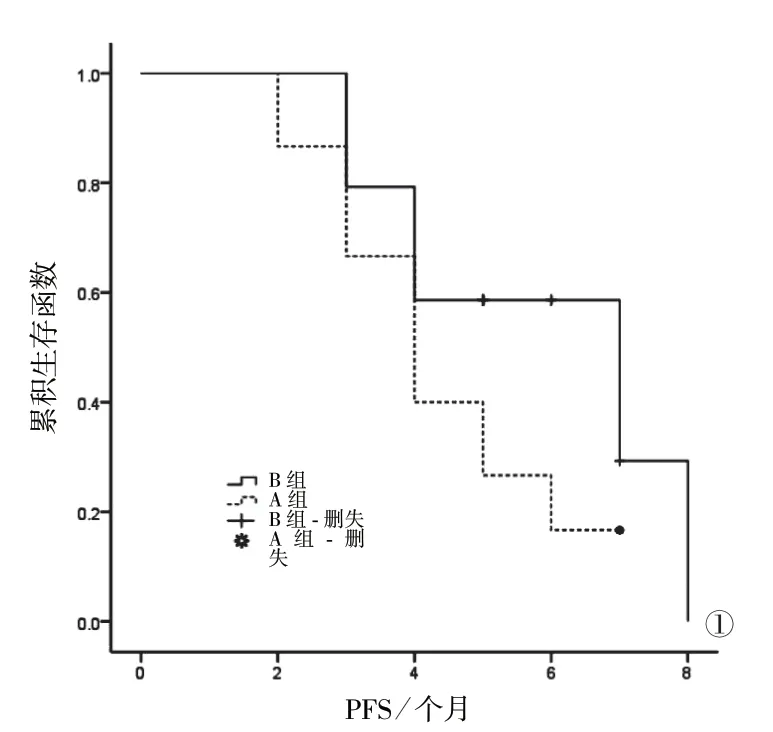
图1 两组患者PFS的Kaplan-Meier曲线
2.4 两组患者不良反应发生情况比较 两组患者贫血、中性粒细胞减少、胃肠道反应、高血压、白细胞减少发生率比较,差异均无统计学意义(P>0.05)。见表3。
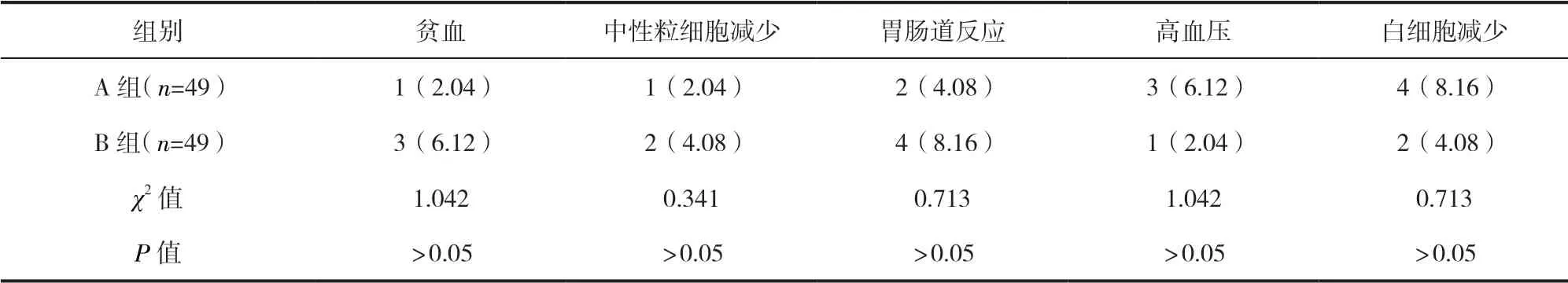
表3 两组患者不良反应发生情况比较/例(百分率/%)
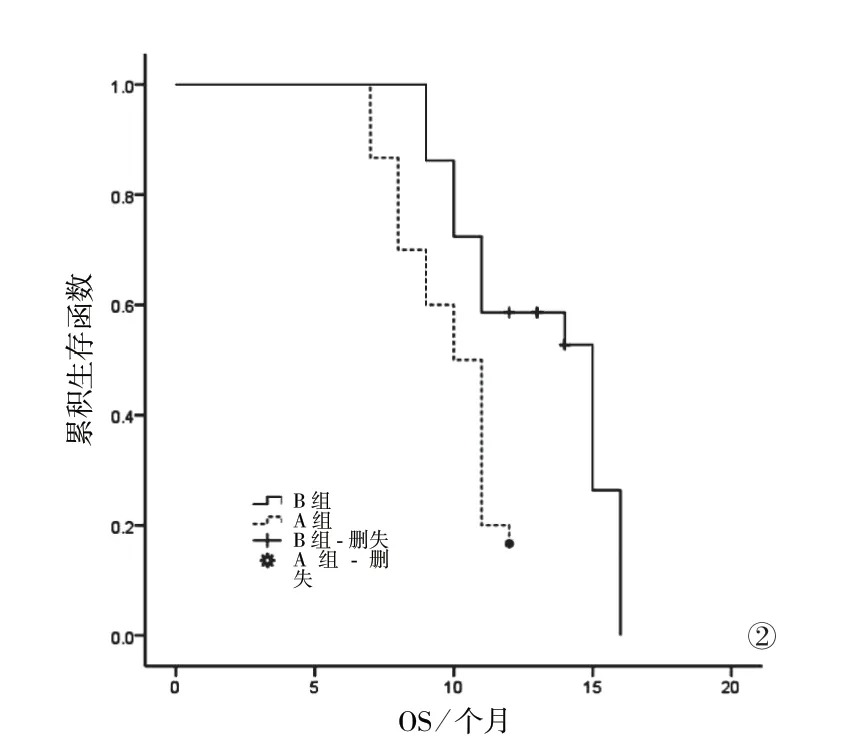
图2 两组患者OS的Kaplan-Meier曲线
3 讨论
肿瘤一旦转移意味着疾病由局部病变转变为全身性疾病,临床治疗以姑息性化疗为主,但由于既往治疗时已使用各类化疗药物,药物敏感性降低,往往治疗效果欠佳[6-7]。鼻咽癌化疗敏感,中位OS仅10~15个月。本研究中,B组患者在单纯GP化疗的基础上联合PD-1抗体免疫治疗,ORR由24.49%提高至44.90%,近期疗效获得提高,与国外有关研究结论一致[8]。目前认为,PD-1在活化的T细胞、B细胞、NK细胞、巨噬细胞上均有表达[9-10]。因此,使用PD-1抗体用于恶性肿瘤的治疗可通过增强机体免疫的途径发挥抗肿瘤效应,协同化疗强化治疗效果。正常机理下,机体免疫系统可特异性识别和摧毁突变细胞,阻止肿瘤的发生与进展。但部分肿瘤细胞可通过免疫逃逸机制免受防御机制的杀伤,使肿瘤细胞不断增殖。T细胞是免疫应答的重要组成,需在多种共刺激分子的参与下发挥正常生理功能[11]。共刺激分子的异常表达会抑制T细胞生理功能,并在T细胞接触抗原后抑制相关细胞因子的产生及效应T细胞的激活,抑制T细胞活性并使T细胞耗竭,造成病理性免疫耐受,使机体无法发挥正常免疫功能,为肿瘤细胞提供免疫逃逸的条件[12]。PD-1主要表达于CD4+T细胞和CD8+T细胞表面,作为一种共刺激分子,其可与PD-L1结合后可介导PD-1/PD-L1信号通路,阻碍T细胞活化并诱导其功能失活,增强肿瘤细胞的免疫耐受,从而参与肿瘤细胞免疫逃逸,使肿瘤细胞躲避机体免疫细胞的攻击进而无限增殖[13]。有研究认为,T淋巴细胞的免疫应答是抗肿瘤免疫的重要组成,T细胞亚群的变化可有效反映治疗方式对机体的影响[14]。
本研究结果显示,治疗后,两组患者CD3+、CD4+/CD8+较治疗前均升高,NK较治疗前降低,且B组CD3+、CD4+/CD8+均高于A组,NK均低于A组,差异均有统计学意义(P<0.05)。提示PD-1抗体免疫治疗可有效提高T淋巴细胞活性。有研究发现,肺癌、乳腺癌等恶性肿瘤的外周血中存在T细胞表面共抑制分子PD-1过表达现象,肿瘤细胞可能是通过上调共抑制分子PD-1表达来抑制T淋巴细胞的活化增殖,从而削弱T淋巴细胞的抗肿瘤免疫效应[15-16]。本研究结果显示,B组患者中位PFS与中位OS均长于A组。这提示,PD-1抗体免疫治疗可延长转移性鼻咽癌患者的中位PFS与中位OS,考虑与PD-1抗体提高了T淋巴细胞活性,并强化了抗肿瘤效应有关。有研究认为,以抗PD-1/PD-L1通路为代表的免疫检查点抑制剂是激活抗肿瘤免疫活性的有效手段[17]。另有研究发现,PD-1抗体的治疗效果与免疫组化检测出的PD-1表达水平有明显相关性,且患者基础营养水平、炎症状态、肿瘤细胞乏氧程度等也被证实可能会影响免疫疗效[18]。本研究中,两组患者严重不良反应主要包括贫血、中性粒细胞减少、胃肠道反应、高血压、白细胞减少,但程度并不严重,经对症处理后缓解。这表明,PD-1抗体在转移性鼻咽癌患者显示出可接受的安全性。
综上所述,GP方案联合PD-1抗体免疫治疗可提高转移性鼻咽癌患者的ORR,延长PFS与OS,且安全性较高。
