抗菌肽Tachyplesin Ⅰ的分子设计、结构与活性分析
2022-07-07蔡寅川蒋思雨
孙 栋,蔡寅川,蒋思雨,李 璇,郝 刚*
(1.西南民族大学食品科学与技术学院,成都 610041;2. 四川阿坝州工业经济研究所,汶川 623000;3. 重庆市计量质量检测研究院,重庆 401120)
抗生素的滥用导致细菌耐药性增加,因此寻求新的抗生素替代品尤为迫切。抗菌肽是生物体为抵御环境中微生物入侵而产生的一类阳离子宿主防御多肽,可在不同形式生命体的不同组织、细胞中存在,具有广谱抗菌、抗病毒、抗真菌、抗肿瘤、促进组织修复和调节免疫系统等活性。抗菌肽的研究开发有望克服传统抗菌药物存在的毒副作用大、易产生耐药性等一系列问题,在医疗卫生、食品工业、畜牧业和农业生产等领域发挥积极作用。但目前天然抗菌肽仍存在活性不高、作用靶细胞易产生溶血活性等问题。因此,围绕抗菌肽的结构特性进行分子设计改造是当前的研究热点。
抗菌肽tachyplesin I(TP Ⅰ)是Nakamura等从东方鲎血淋巴细胞分离纯化的由17个氨基酸残基组成的肽。相对分子质量为2 268 u,带有6个 正电荷,等电点12.3,由半胱氨酸(Cys)配对形成分子内2个二硫键(Cys3-Cys16、Cys7-Cys12),表现为稳定刚性的β-折叠二级结构。TP Ⅰ的两亲β-折叠结构被认为是其抗菌活性的必要条件。研究表明,高度的疏水性、刚性紧密的结构会对正常细胞产生毒性。Ramamoorthy等通过直接删除TP Ⅰ结构中的4个Cys得到其衍生肽CDT,测定抗菌活性发现其抵抗细菌与真菌的能力与TP Ⅰ相当,同时CDT的溶血副作用相比于TP Ⅰ降低,可见TP Ⅰ结构中Cys形成的二硫键对抗菌活性可能不是必须的。Shi等合成了TP Ⅰ的2个二硫键同分异构体3C7C和3C12C,发现两种异构体大量构象的改变和两亲性变化在导致溶血性降低的同时,抗细菌活性显著降低。基于TP Ⅰ具有高抗菌活性但细胞毒性较高等特点,本研究以提高抗菌活性的同时降低肽的溶血性为目的,运用相关生物信息学软件对TP Ⅰ进行分子结构优化设计,对设计肽进行理化特性分析及结构活性预测。化学合成后,检测其抑菌活性、溶血活性和内毒素中和能力,圆二色谱仪测定其在不同溶液环境中的二级结构。以期得到一种毒性更小、抗菌活性更强的TP Ⅰ衍生肽,便于研究TP Ⅰ及其衍生物的结构-活性关系和抗菌作用机制。
1 材料与方法
1.1 材料及仪器
抗菌肽:抗菌肽TP Ⅰ及TP Ⅰ-Y4均委托江苏吉泰肽业科技有限公司采用固相化学合成法进行合成。运用标准Fmoc方法,C18反相高效液相色谱纯化,经氨基酸分析及质谱鉴定,C-端酰胺化,纯度≥95%。
菌种:枯草芽孢杆菌()、英诺克李斯特菌()、铜绿假单胞菌()、黑曲霉 ()、白假丝酵母()购自海博生物技术有限公司;大肠杆菌()、金黄色葡萄球菌()、弗氏柠檬杆菌()、鼠伤寒沙门菌()购自北京贝北纳创联生物技术研究院。
细菌培养采用LB培养基,真菌培养采用马铃薯培养基(PDA);三氟乙醇(TFE)购自Macklin公司;Chirascan圆二色光谱仪购自英国应用光物理公司;318C+型酶标仪购自上海沛欧分析仪器有限公司;内毒素检测鲎试剂盒购自厦门鲎试剂生物科技股份有限公司。
1.2 抗菌肽的理化特性分析
运用抗菌肽数据库APD3(http://aps.unmc.edu/AP/main.php)中的Prediction分析工具以及生物信息学网站Expasy(https://www.expasy.org/)的预测软件ProtParam对抗菌肽的理化特性进行预测。预测参数包括抗菌肽的净电荷、相对分子质量、总疏水比、亲水性指数(GRAVY)、疏水性氨基酸残基比例、理论等电点、不稳定指数和脂肪指数等。
1.3 抗菌肽的二级结构分析
运用在线蛋白质序列分析服务器NPS@(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_seccons.html)中的二级结构预测工具对设计肽的二级结构进行组成预测分析。
1.4 抗菌肽TPⅠ-Y4的抗菌活性及跨膜预测
利用在线软件CAMPR3(http://www.camp.bicnirrh.res.in/index.php)中的支持向量机(SVM)、随机森林、判别分析器3种计算方法来预测设计肽的抗菌活性。跨膜预测则使用跨膜螺旋预测软件TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行。
1.5 圆二色光谱分析
室温下运用圆二色谱仪测定两种肽在10 mmol·L磷酸盐缓冲溶液(PBS,pH=7.4)、50%(/)TFE/PBS溶液环境下的二级结构,肽液终浓度为200 μg·mL。采用0.1 cm径长石英皿,狭缝1 nm,扫描速度50 nm·min,波长扫描范围设定190~260 nm,每种样品扫描3次取其平均值,结果扣除对照。圆二色谱结果用平均残基摩尔椭圆度表示,单位为度·厘米·分摩尔(deg·cm·dmol)。
1.6 抗菌肽抑菌活性的测定
采用最小抑菌浓度测定法(minimal inhibitory concentration,MIC)对两种肽的抑菌活性进行测定。具体方法如下:将培养至对数生长期的待测菌液用LB培养液重悬至10CFU·mL,吸取100 μL加入96孔细胞培养板,而后各孔加入100 μL 经倍比稀释后的肽溶液,使孔内抗菌肽的终浓度分别为0.03、0.06、0.125、0.25、0.5、1.0、2.0、4.0、8.0、16.0 μg·mL。阳性对照为100 μL的0.4%多聚甲醛溶液,阴性对照为100 μL无菌超纯水。细菌置于37 ℃恒温摇床上培养6 h,真菌置于28 ℃恒温摇床上培养8 h后,使用全自动酶标仪在λ=630 nm处测各孔吸光值,试验重复3次,取其平均值。与未培养前初始吸光值相比,未有显著变化的抗菌肽浓度定义为对该菌的最小抑菌浓度(MIC)。
1.7 抗菌肽体外溶血活性检测
小鼠红细胞溶血试验用来评估两种肽对哺乳动物正常细胞的溶血活性,溶血率<5%认为没有溶血活性。采用摘除眼球法收集正常小鼠新鲜血液,肝素钠抗凝离心管保存,在4 ℃下1 000×离心10 min后取沉淀,生理盐水洗涤3次后按10%(/)重悬。将100 μL不同浓度肽液与100 μL红细胞悬液混匀后在37 ℃恒温箱孵化60 min后,取出4 ℃下1 000×离心10 min吸取上清液100 μL置于96孔细胞培养板中,全自动酶标仪在590 nm处测其值。以100 μL的0.1%的Triton X-100溶液作为阳性对照,85 μL生理盐水与15 μL超纯水混合液作为阴性对照,试验重复3次,取其平均值。根据公式计算溶血率,溶血率(%)=(试验组值-阴性对照值)/(阳性对照值-阴性对照值)×100。
1.8 抗菌肽中和内毒素活性检测
参照内毒素检测鲎试剂盒(试管定量显色基质法)说明书略做修改后进行检测,具体方法简述如下:将不同浓度的抗菌肽溶液20 μL加入无内毒素试管中,置于冰浴后加入20 μL用内毒素检测用水稀释好的1 EU·mL内毒素母液,各试管加60 μL 内毒素检测用水。再加入100 μL鲎试剂混匀后在37 ℃水浴锅中温育10 min,取出置于冰浴中,各个试管里加入中100 μL显色基质溶液轻晃混匀,再置于37 ℃水浴锅中温育5 min后冰浴,各个试管中加入500 μL反应终止剂(偶氮化试剂1)后轻晃混匀,使反应终止并开始进行染色。依次加入偶氮化试剂2、3溶液于各试管中,轻荡混匀后静置5 min,紫外可见分光光度计在545 nm处测得吸光度值。阳性对照组为100 μL鲎试剂,加内毒素母液20 μL和80 μL内毒素检测用水。阴性对照为100 μL鲎试剂加100 μL内毒素检测用水,试验重复3次,取其平均值。抗菌肽中和内毒素的中和率按照公式进行计算:中和率(%)=[(阳性组值-阴性组值)-(抗菌肽值-阴性值)] /(阳性值-阴性值)×100。
2 结 果
2.1 抗菌肽TPⅠ的分子设计
天然TP Ⅰ由17个氨基酸残基组成,其中Cys3与Cys16、Cys7与Cys12形成两个二硫键,C端残基酰胺化。本研究以抗菌肽TP Ⅰ分子结构为模板,经过生物信息学软件对其进行氨基酸序列分子设计,确定使用芳香族氨基酸酪氨酸(Tyr)替换序列中4个Cys。酪氨酸作为β-折叠强形成者(=1.47),其β-折叠形成能力大于Cys(=1.19),Tyr的取代可增强肽的β-折叠结构;同时Tyr(疏水值0.26,Eisenberg标度)的疏水性小于Cys(疏水值0.29,Eisenberg标度),理论上可降低设计肽的疏水性。Cys被取代后,设计肽的结构没有二硫键稳定,分子刚性将被削弱,分子柔韧性将提高。因此,通过增强设计肽的β-折叠结构,降低疏水性及分子刚性,从而提高设计肽的抗菌活性,降低溶血活性。设计肽命名为TP Ⅰ-Y4,保持与母肽相同的序列长度与C端酰胺化。表1列出了2个抗菌肽的序列组成(单字母编码)。
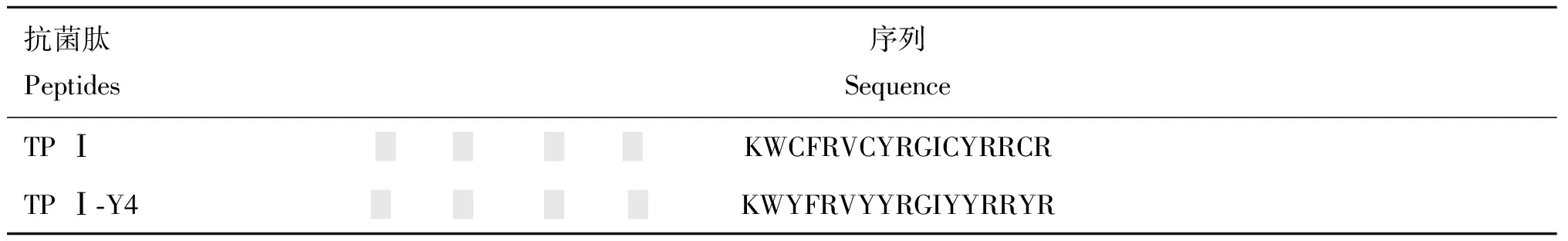
表1 TPⅠ/TPⅠ-Y4的氨基酸序列
2.2 TPⅠ/TPⅠ-Y4的理化特性分析
通过对理化特性的计算分析来预测TP Ⅰ-Y4的阳离子性、热稳定性、亲水性及疏水性等指标,结果如表2所示。不稳定指数用于估测多肽的稳定性,数值小于40被预测为稳定,反之则不稳定。脂肪指数定义为多肽中脂肪族氨基酸(Ala、Val、Leu、Ile)所占的相对比例,可推断多肽热稳定性。GRAVY指数(grand average of hydropathicity)是一种用于计算肽的疏水性/溶解度的方法,正值表示疏水性,负值表示亲水性。TP Ⅰ和TP Ⅰ-Y4序列长度、电荷数相同,热稳定性好,都是阳离子抗菌肽,TP Ⅰ-Y4的等电点及稳定性较原肽有所提高。从疏水性比例及GRAVY指数来看,经过设计后TP Ⅰ-Y4疏水性比例与原肽相当,同时两个抗菌肽都具有较强的亲水性,其中TP Ⅰ-Y4的GRAVY值为-1.412,亲水性表现更强。
2.3 TPⅠ/TPⅠ-Y4的二级结构分析
二级结构分析结果如图1所示。从预测可以明显看出,两种肽的二级结构主要以β-折叠为主,N-端是肽链的主要β-折叠形成区。对比图1A和图1B,两种肽的折叠开始与结束位置基本一致,但相对于TP Ⅰ,从第14位氨基酸开始时TP Ⅰ-Y4的β-折叠趋势要大一些。TP Ⅰ的独特刚性β-折叠结构在于分子内4个Cys形成的2对二硫键,但值得关注的是,预测发现使用Tyr替换Cys后的TP Ⅰ-Y4的β-折叠趋势较TP Ⅰ有所增强,可能在于Tyr是β-折叠的强形成者,作为芳香族氨基酸在破坏二硫键的同时改变了主链原子的空间位置排布。除了β-折叠结构外,TP Ⅰ及TP Ⅰ-Y4其余部分都以无规则卷曲状态为主。

表2 TPⅠ/TPⅠ-Y4的理化特性分析
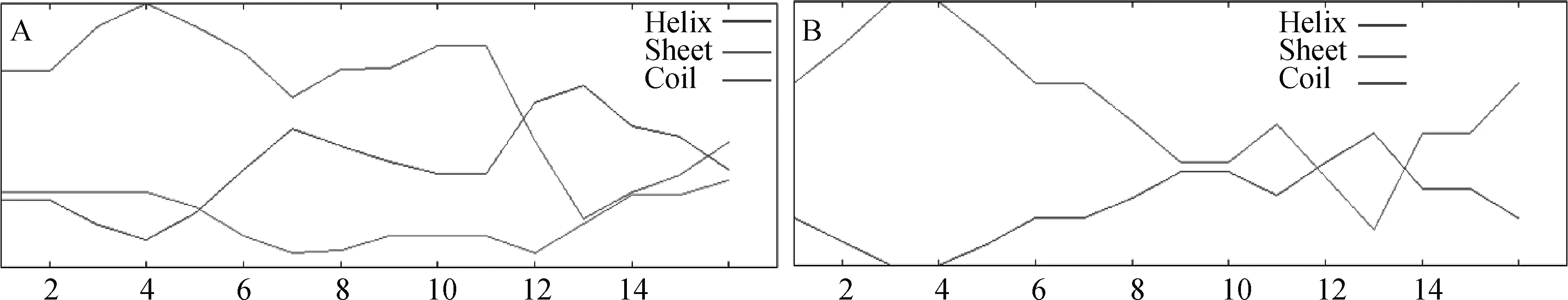
图1 NPS@预测TP Ⅰ (A)和TP Ⅰ-Y4 (B)的二级结构Fig.1 NPS@ predicted secondary structure of TP Ⅰ (A) and TP Ⅰ-Y4 (B)
2.4 TPⅠ/TPⅠ-Y4的抗菌活性及跨膜预测
抗菌活性预测结果如表3所示,3种计算方法都预测TP Ⅰ-Y4具有较强的抗菌活性。运用TMHMM服务器2.0对两个肽的跨膜区域进行预测,结果如图2所示。跨膜区域长达19个氨基酸时才能构成跨膜序列。抗菌肽TP Ⅰ和TP Ⅰ-Y4只含有17个氨基酸残基,缺少形成跨膜区域的条件,而TMHMM2.0预测结果也证实了两种肽都没有跨膜区域,TP Ⅰ-Y4与母肽TP Ⅰ可能具有相似的抑菌方式。

表3 TP Ⅰ-Y4的抗菌活性预测

图2 TP Ⅰ和TP Ⅰ-Y4的跨膜预测Fig.2 The transmembrane prediction of TP Ⅰ and TP Ⅰ-Y4
2.5 TPⅠ/TPⅠ-Y4的圆二色谱(CD)分析
运用以上生物信息学软件能够便捷地对抗菌肽结构、活性等信息进行预测分析,但理论上的分析预测还需要检测抗菌肽在不同溶液环境中的结构来证实。抗菌肽TP Ⅰ及TP Ⅰ-Y4经化学合成后,对其二级结构进行圆二色光谱测定分析,如图3所示。图3A中TP Ⅰ在水相环境和模拟细胞膜环境溶液中都显示出明显的峰带,在PBS溶液中,TP Ⅰ的光谱在215 nm处有一个负极小值,在198~200 nm处有一正峰,这是典型的β-折叠构象谱图,与其他研究人员报道的相似。在50%TFE溶液中时,TP Ⅰ在195~200 nm处有强烈的正峰值,216 nm有一负极小谱带,230 nm处有强阳性谱带,这符合β-折叠结构的CD谱图特征,说明在疏水环境中TP Ⅰ也采用β-折叠结构。从图3A可观察出TP Ⅰ在两种不同环境中的β-折叠含量差别不大,这可能是由于TP Ⅰ结构中二硫键维持着独特的刚性结构,限制了疏水环境诱导其二级结构产生太大变化。图3B中,在PBS溶液和50%TFE溶液中,TP Ⅰ-Y4在215 nm~218 nm区域处都有广泛的最大负峰值,这也是典型的β-折叠结构CD峰的位置,说明TP Ⅰ-Y4在上述环境中都呈现β-折叠结构。并且50%TFE溶液中TP Ⅰ-Y4的β-折叠吸收峰明显大于其在PBS溶液中的吸收峰,说明细胞膜疏水性环境会诱导抗菌肽的β-折叠含量提高。对比图3中A、B两图,缺少二硫键的衍生肽TP Ⅰ-Y4在两种溶剂环境中依旧表现出β-折叠结构特征,也未因介质环境的变化而改变其二级结构;且在接触细胞膜疏水环境时所诱导出的β-折叠趋势明显高于TP Ⅰ。这也从侧面说明TP Ⅰ-Y4具有更高的分子柔韧性。圆二色谱检测结果证实了本研究的设计思路以及生物信息学的结构预测。
2.6 TPⅠ/TPⅠ-Y4的抑菌活性
抗菌肽TP Ⅰ和TP Ⅰ-Y4对不同革兰阳性(G)和革兰阴性(G)细菌、真菌的抑菌活性如表4所示。总体来看,设计肽TP Ⅰ-Y4不仅保持了与母肽TP Ⅰ相似的抗菌活性,甚至对部分细菌和真菌的抑菌活性要更强于母肽TP Ⅰ。如食品和饲料中常见的大肠杆菌、鼠伤寒沙门菌的最小抑菌浓度降低至0.125和0.06 μg·mL,抑菌活性提高了2~4倍。 相比之下TP Ⅰ-Y4对细菌的抑菌效果比真菌要强一些,这可能在于它对细菌和真菌的抑菌机理不同有关。抑菌活性检测结果与前期抗菌活性等预测指标相印证。典型β-折叠结构的TP Ⅰ的二硫键被破坏后,TP Ⅰ-Y4在疏水环境中展现出更强的β-折叠结构,且抑菌活性总体强于母肽,这说明对抗菌肽TP Ⅰ的分子设计思路是正确的。
图3 TP Ⅰ (A)和TP Ⅰ-Y4 (B)的圆二色谱图Fig.3 CD spectra of TP Ⅰ (A) and TP Ⅰ-Y4 (B)

表4 TP Ⅰ和TP Ⅰ-Y4的最小抑菌浓度
2.7 TPⅠ/TPⅠ-Y4的体外溶血活性
通过测定新鲜小鼠红细胞悬浮液中释放的血红蛋白含量来检测抗菌肽的体外溶血活性。由表5可知,当浓度不超过20 μg·mL时,两种肽都未表现出溶血活性,TP Ⅰ浓度超过40 μg·mL时出现溶血活性,80 μg·mL时溶血率为18.38%。衍生肽TP Ⅰ-Y4在80 μg·mL时才出现轻微的溶血率(6.62%)。相比于TP Ⅰ,TP Ⅰ-Y4对哺乳动物正常红细胞的溶血性大大降低,再次证明了本研究对TP Ⅰ的分子设计是成功可行的。没有二硫键稳定的TP Ⅰ-Y4在水相与疏水环境下具有较大的分子柔性,使其增强抗菌活性的同时降低了体外溶血活性,这与Ramamoorthy等的报道相似。蜂毒素Melittin是一种以破坏细菌细胞膜而杀菌的阳离子抗菌肽,具有很强的溶血活性,超过20 μg·mL的浓度已致使正常红细胞完全溶血。
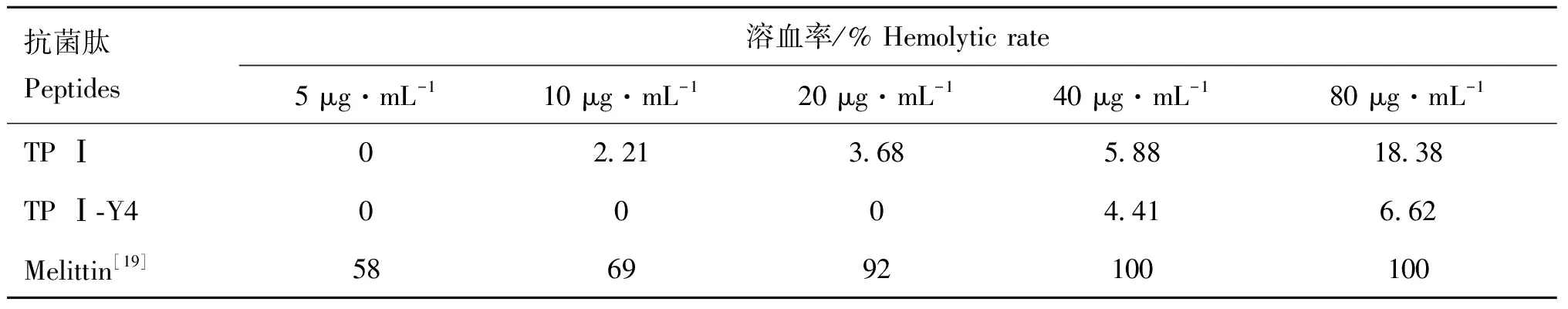
表5 TP Ⅰ和TP Ⅰ-Y4的溶血活性
2.8 TPⅠ/TPⅠ-Y4的中和内毒素活性
中和内毒素活性结果如表6所示,两种肽都表现出了对脂多糖(LPS)的亲和能力,浓度为40 μg·mL时,两种肽的内毒素中和率可达50%以上。相同浓度下,TP Ⅰ-Y4内毒素中和率与TP Ⅰ相当,随着浓度的增加内毒素中和作用愈发显著,表现出很好的剂量依赖关系。TP Ⅰ-Y4在表现出优于TP Ⅰ抗菌活性的同时,保留了很强的内毒素中和能力,可见对TP Ⅰ的分子设计不影响脂多糖的亲和结合能力。

表6 TPⅠ和TPⅠ-Y4对LPS的亲和能力
3 讨 论
TP Ⅰ是具有良好抗菌活性的刚性β-折叠结构抗菌肽,对细菌、真菌、肿瘤以及病毒都有抑制作用。研究表明,影响抗菌肽生物活性的自身因素主要是理化特性和空间结构。本研究在抗菌肽TP Ⅰ的结构基础上重新设计了一种不含二硫键的衍生肽TP Ⅰ-Y4,TP Ⅰ-Y4保持TP Ⅰ的氨基酸残基长度与顺序不变,将TP Ⅰ的2个二硫键删除,用4个芳香族氨基酸Tyr替代4个Cys,Tyr形成β-折叠的能力强于Cys,其β-折叠倾向性因子()为1.47,疏水性低于Cys。经生物信息学软件分析,与TP Ⅰ相比,TP Ⅰ-Y4的热稳定性增强,亲水性增加,可能是Tyr的疏水标度比Cys小造成。分子设计虽然破坏了母肽中稳定β-折叠结构的二硫键,但圆二色谱结果表明,TP Ⅰ-Y4在水相环境、模拟细胞膜的疏水环境中均呈现为β-折叠结构,疏水环境中TP Ⅰ-Y4的β-折叠趋势明显高于水相,并且也明显高于不同环境中的TP Ⅰ,这可能与Tyr作为β-折叠的强形成者,氨基酸残基之间存在氢键作用与芳香性侧链的簇集稳定了β-折叠结构。Laederach等对TP Ⅰ及其衍生物的结构进行核磁共振研究中也得到同样结论,这也与生物信息学软件分析的结果一致。
抑菌试验显示,TP Ⅰ-Y4对细菌和真菌都具有很强的抑菌活性。TP Ⅰ-Y4对细菌的抑菌活性要强于TP Ⅰ,以大肠杆菌和鼠伤寒沙门菌为例,TP Ⅰ-Y4的抑菌活性是TP Ⅰ的2~4倍。二硫键的删除并没有导致TP Ⅰ-Y4的抑菌活性降低,说明母肽TP Ⅰ结构中的二硫键及Cys残基对其抗菌活性可能并不是必需的。抗菌肽的空间构象变化如β-折叠结构增强对抑菌活性可能至关重要,缺失二硫键的TP Ⅰ-Y4的抑菌机理和结构活性关系值得后续研究。同时相比于TP Ⅰ,TP Ⅰ-Y4对小鼠红细胞的溶血活性有所降低,在80 μg·mL时才出现轻微的溶血活性,分子设计达到了降低母肽对正常细胞损伤的目的。内毒素(主要成分为脂多糖,LPS)是G菌细胞壁膜的主要成分,更是生物机体重要的致炎症因子,微量的内毒素即可引起一系列炎症反应,导致败血性休克甚至死亡。而研究表明阳离子抗菌肽对细菌的杀伤先是从细胞膜上的脂多糖相互作用开始,因此抗菌肽不论是抗菌还是中和内毒素,与脂多糖结合都是前提条件,阳离子抗菌肽与脂多糖的结合能力可用对内毒素的中和能力来检测。中和内毒素活性显示两种肽对内毒素的中和能力相当,且浓度的增加内毒素中和作用愈发显著,即用Tyr替换Cys后不影响其对脂多糖的亲和结合能力,且表现出很好的剂量依赖关系。
4 结 论
本研究对TP Ⅰ的分子设计思路正确并达到了预期研究目的。结果表明,TP Ⅰ分子中的二硫键结构对抑菌活性、中和细菌内毒素方面没有影响。而设计的衍生肽TP Ⅰ-Y4在增强抑菌活性的同时,还降低了对正常细胞的毒性。这可能与TP Ⅰ-Y4分子中,Tyr作为β-折叠的强形成者,以及氨基酸残基之间存在的氢键作用与芳香性侧链的簇集导致β-折 叠结构的增强,同时缺少了二硫键束缚的β-折叠结构与分子柔韧性提高有直接关系。设计肽TP Ⅰ-Y4展现了作为抗微生物制剂应用于畜牧养殖、食品工业和医药等领域的潜力。芳香族氨基酸取代稳定β-折叠的半胱氨酸残基可能是设计具有特定β-折叠的线性肽的一种可行策略。这为进一步研究抗菌肽TP Ⅰ及其衍生肽的抑菌作用机制,阐述构效关系提供了基础,同时为后续开发抑菌活性高、对细胞毒性小及内毒素中和能力强的抗菌肽设计提供了依据。
