近五年拉曼光谱技术在宫颈癌中的研究进展
2022-07-06申卓未许晓光
申卓未, 李 睿, 王 杨, 许晓光, 肖 祯
大连医科大学附属第一医院,辽宁 大连 116000
引 言
宫颈癌是女性发病率第四位的癌症, 据统计, 2018年全球约有57万的宫颈癌患者, 及31万的死亡患者。 其中我国和印度为宫颈癌重灾区, 承担了近三分之二的病例数[1]。 如果能早期诊断宫颈癌和宫颈上皮内瘤变可大大提高生存率。 尽管现在有诸如细胞学涂片检查(巴氏涂片)和人乳头状瘤病毒(HPV)检测等筛查工具, 但平均灵敏度和特异性令人不甚满意[2]。 细胞学检查假阳性率高, 会带来过度医疗及额外的经济损失; HPV DNA的检测成本高、 缺乏训练有素的实验室人员; 阴道镜检查具有良好的敏感性(>90%); 但其特异性较差(<50%), 假阳性率高, 常导致不必要的活检; 组织病理学检查是目前评估和诊断癌症的金标准, 但它的各种过程, 大约需要1周时间, 存在耗时长、 价格昂贵的缺点[2]。 因此新型的快速、 高效、 便捷的检测技术应运而生, 如只需一小时就能直接从宫腔标本中提取出HPV 16型的DNA的“纸张芯片“、 使用固定焦距相机实现实时检测宫颈状态、 及拉曼显微镜。
拉曼光谱学的基本原理是光的弹性散射。 拉曼光谱技术是一种可靠的新兴的技术, 它可分析物质的分子结构, 并保证受试对象不受破坏且保持完整, 还可以在微米级别的分辨率下分析人体组织的化学成分。 拉曼成像目前已被成功应用于许多领域, 包括分析化学材料, 食品质量监督, 药物分析和法医调查。 在医学研究方面, 拉曼成像已成功应用于鼻咽、 胃肠、 肺、 食管、 肾、 脑癌等[3]。
1 拉曼技术在宫颈癌中的应用
Mahadevan等于1998年记录了宫颈组织的体内及体外拉曼光谱。 随后的研究逐渐伸展, 包括了组织学上正常、 癌前病变及癌组织的区分; 癌组织的低中高分化分类; 宫颈鳞癌腺癌的分类等。 研究也逐渐从组织学慢慢扩展到细胞学及血清学中。
1.1 拉曼技术在组织学上的应用
拉曼光谱技术在宫颈活体组织的研究主要方式是设计拉曼光谱仪和光纤探针, 用光纤探针在活体宫颈表面获得正常和癌前组织的拉曼光谱。 通过分析所得光谱, 分辨出宫颈的正常组织及宫颈癌组织。 所研究分析的拉曼特征光谱集中在红外光谱指纹区(1 300~400 cm-1, 7.69~25 μm), 这个区域的吸收峰特征性强, 可用于区分分子结构的细微变化。

表1 宫颈组织学的拉曼检测Table 1 Raman detection of cervical histology
光学显微镜在临床诊断中的应用日益增加, 如漫反射显微镜和拉曼显微镜, 但Shaikh等的研究发现, 拉曼显微镜的敏感性、 特异性、 阳性预测值和阴性预测值(91%,96%,95%,93%)均高于漫反射显微镜(85%,95%,93%,88%)。 由于成本较低和复杂性较低, 漫反射显微镜更适合作为农村社区的大规模筛查方式, 而拉曼显微镜的诊断准确性更高, 有望成为宫颈癌诊断的首选无创诊断技术[4]。
1.2 拉曼光谱用于诊断宫颈癌[5]
拉曼显微镜在组织学中体外的研究, 大多使用新鲜组织制成冰冻或切成石蜡切片, 或直接扫描新鲜组织的表面, 目的在于区别正常组织、 癌前病变与癌组织, 或癌组织的分类(低中高分化或鳞癌腺癌), 或炎症对于假阳性的意义。
Daniel使用拉曼显微镜观测并对同一组织切片进行苏木精和伊红(H&E)染色, 进行组织病理学报告, 揭示宫颈癌的生物分子结构变化并得出拉曼光谱诊断的灵敏度为92%, 特异性为75%, 准确度为85%[5]。
1.3 炎症对拉曼光谱诊断宫颈癌的影响[7]
之前的研究认为, 炎症的存在会使得拉曼光谱对宫颈癌诊断的假阳性增加。 但近些年的研究表明, 拉曼光谱可以区分宫颈炎、 不同类型的癌前病变、 鳞癌及腺癌。 Wang等收集了210例宫颈组织样本, 并使用SVM(支持向量机)重点分析了炎性组织与其他病理组织的区别, 如表2。

表2 炎症组织与其他五种组织的拉曼对比Table 2 Raman comparison of inflammatory tissue and other five tissues
1.4 拉曼光谱可以用于肿瘤组织的级别分类[6], 及鳞癌腺癌的区分[6,8-9]
Daniel等使用拉曼显微镜分析了新鲜切除的宫颈组织样本中的某些生物分子含量, 分别对比了正常、 癌前及宫颈癌组织, 以及三种类型的癌组织, 并得出如下结论(表3、 表4、 表5)。 该研究表明使用拉曼光谱区分高分化、 中分化和低分化的鳞状细胞癌, 准确率为94.0%。 实验认为拉曼光谱能够成功对宫颈炎、 宫颈癌前病变(CIN Ⅰ,CIN Ⅱ,CIN Ⅲ)、宫颈癌(宫颈鳞状细胞癌、 宫颈腺癌)进行分类, 区分6种宫颈组织的准确率为85.7%[6]。
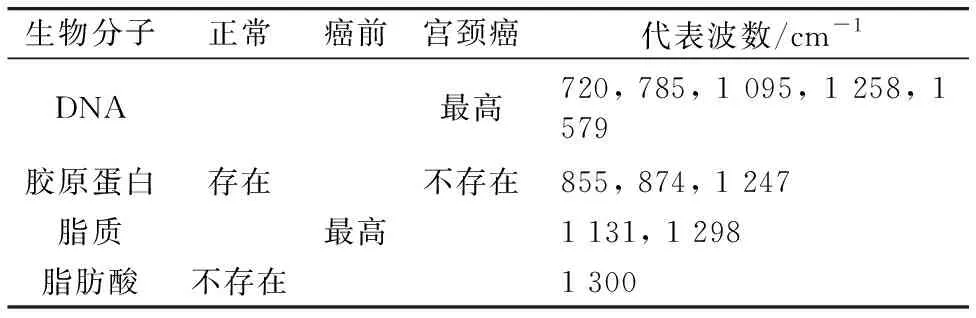
表3 三种组织样本生物大分子对比Table 3 Comparison of biomacromoleculesin three tissue samples

表4 三种类型癌组织生物大分子含量Table 4 Contents of biomacromolecules inthree types of cancer tissues
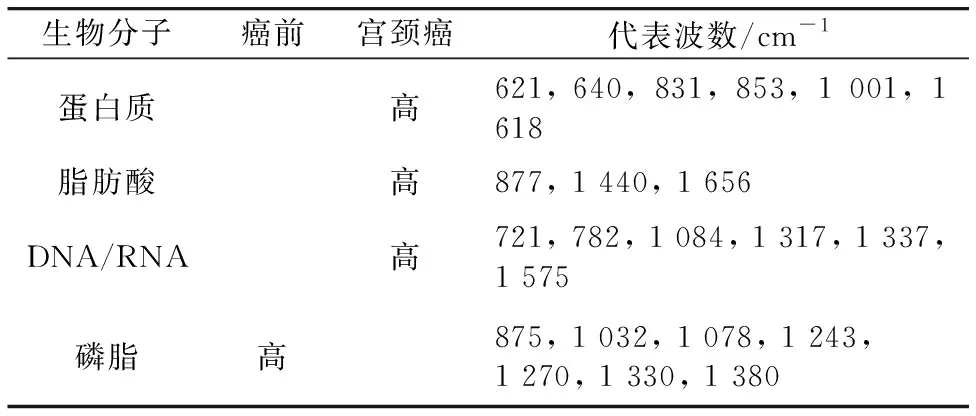
表5 癌前与宫颈癌样本中生物大分子对比
宫颈腺癌相对于鳞状细胞癌来说, 更易发生淋巴结、 卵巢和远处转移, 预后较差。 有研究表明, 宫颈细胞学筛查方法对于宫颈腺癌的准确性并不尽如人意。 有研究总结出了鳞癌腺癌的不同特征峰, 以及组织生化成分的差异。
Zheng等研究发现宫颈鳞状细胞癌的特征波数在415,614,838,880,938,1 002,1 095,1 340,1 452,1 616,1 645和1 670 cm-1处, 这些谱带可以初步划分为脂类、 蛋白质(色氨酸、 苯丙氨酸、 酰胺Ⅰ(α-螺旋))、 碳水化合物、 DNA(核酸)。 宫颈腺癌的特征波数在485,640,695和1 506 cm-1, 可归属于DNA(胞嘧啶)、 蛋白质(酪氨酸、 蛋氨酸)、 糖原等生物分子。 说明了鳞癌腺癌中特征生物大分子的含量不同, 宫颈腺癌组织中碳水化合物含量占总拉曼活性成分的百分比高于宫颈鳞状细胞癌组织, 而宫颈鳞状细胞癌组织中RNA含量相对于总拉曼活性成分的百分比较高。 使用以上特征波长的光谱对宫颈腺癌和宫颈鳞癌的分型准确率为93.125%[8]。
Zhang等应用了偏最小二乘(PLS)、 主成分分析(PCA)、 核主成分分析(KPCA)、 等距特征映射(isomap)和局部线性嵌入(LLE) 5种特征提取算法, 建立了30种模型, 得出如下结论。 腺癌特征性峰强度高于鳞癌的波数有: 540,641,721,784,814,1 060和1 295 cm-1, 表明, 腺癌组织含有更多的葡萄糖、 酪氨酸、 磷脂和脯氨酸; 鳞状细胞癌特征峰强度高于腺癌的波数有: 1 003,1 443和1 670 cm-1, 表明, 鳞状细胞癌组织中苯丙氨酸、 脂类、 酰胺含量更高。 该实验区分宫颈腺癌和宫颈鳞状细胞癌准确率达到96.3%[9]。
1.5 宫颈细胞学的拉曼检测
Shiyamala Duraipandian等收集了35名女性的宫颈中间细胞、 浅表细胞和中间/浅表混合细胞, 并分别用主成分分析(PCA)、 线性判别分析(LDA)和偏最小二乘判别分析(PLS-DA)的方法分析所得光谱, 发现PLS-DA方法的灵敏度和特异性较PCA-LDA均有明显提高。 该研究还认为中间型和浅表型混合细胞可用于HSIL诊断[10]。

表6 宫颈细胞学的拉曼检测Table 6 Raman detection of cervical cytology
Aljakouch等对来自30例样本的宫颈细胞涂片的单个细胞进行拉曼光谱成像, 对比得到的CARS,SHG/TPF和Raman图像, 分析细胞核与细胞质的比例可以100%准确地区分正常和癌变的pap涂片[11]。
Sitarz[12]等研究了96名HPV检测后妇女的宫颈组织。 由于糖原含量因为癌细胞的糖酵解提供燃料而降低, 因此, 作者评估了所有研究组细胞中的糖原水平, 以确定它与细胞核大小和HPV感染的关系。 并得出了以下结论, 除癌症组外, 所有研究组的子宫颈细胞胞浆中的糖原含量都随着细胞核大小的增加而减少; 数据表明, 细胞核直径超过10 μm的宫颈细胞, 其糖原水平明显低于细胞核小直径细胞; HPV感染的细胞糖原代谢高, 糖原含量减少; 与早期癌细胞相比, 晚期癌细胞的糖原水平显著降低。
Karunakaran等使用拉曼显微镜研究了正常、 HSIL及宫颈癌的宫颈组织, 得出拉曼光谱使用单细胞、 细胞团和DNA诊断良恶性的准确率分别为93.84%,74.26%和92.21%。 Karunakaran等还将以上样本绘出的正常、 HSIL及宫颈癌的图谱分别相减, 得到了这三种状态的宫颈中各种生物大分子的差别[13]。
1.6 血液学拉曼检测诊断宫颈病变
Lu等研究了150例女性的血清, 血样均来自早餐前5 mL静脉血。 检测的靶抗原选择了两种: 鳞状细胞癌抗原(SCCA)、 骨桥蛋白(osteopontin, OPN)。 数据汇总分析这两种抗原在健康受试者中的拉曼光谱强度是最低的。 随着病程的发展, 两种抗原的拉曼光谱强度不断增强, 说明拉曼显微镜可以同时检测患者血清中SCCA和OPN水平。 这种做法成本低、 操作简单、 选择性高, 有望应用于宫颈癌的筛查[14]。

表7 血液学拉曼检测诊断宫颈病变Table 7 Hematology Raman detection in diagnosisof cervical lesions
2 拉曼技术在宫颈癌研究中的展望
目前拉曼技术在妇产科领域方兴未艾, 作为一种新型科技, 目前相关研究并不太多, 在现有的文献中, 我们也能发现其中样本数量都不多的问题, 大多文献的样本个数不过百,
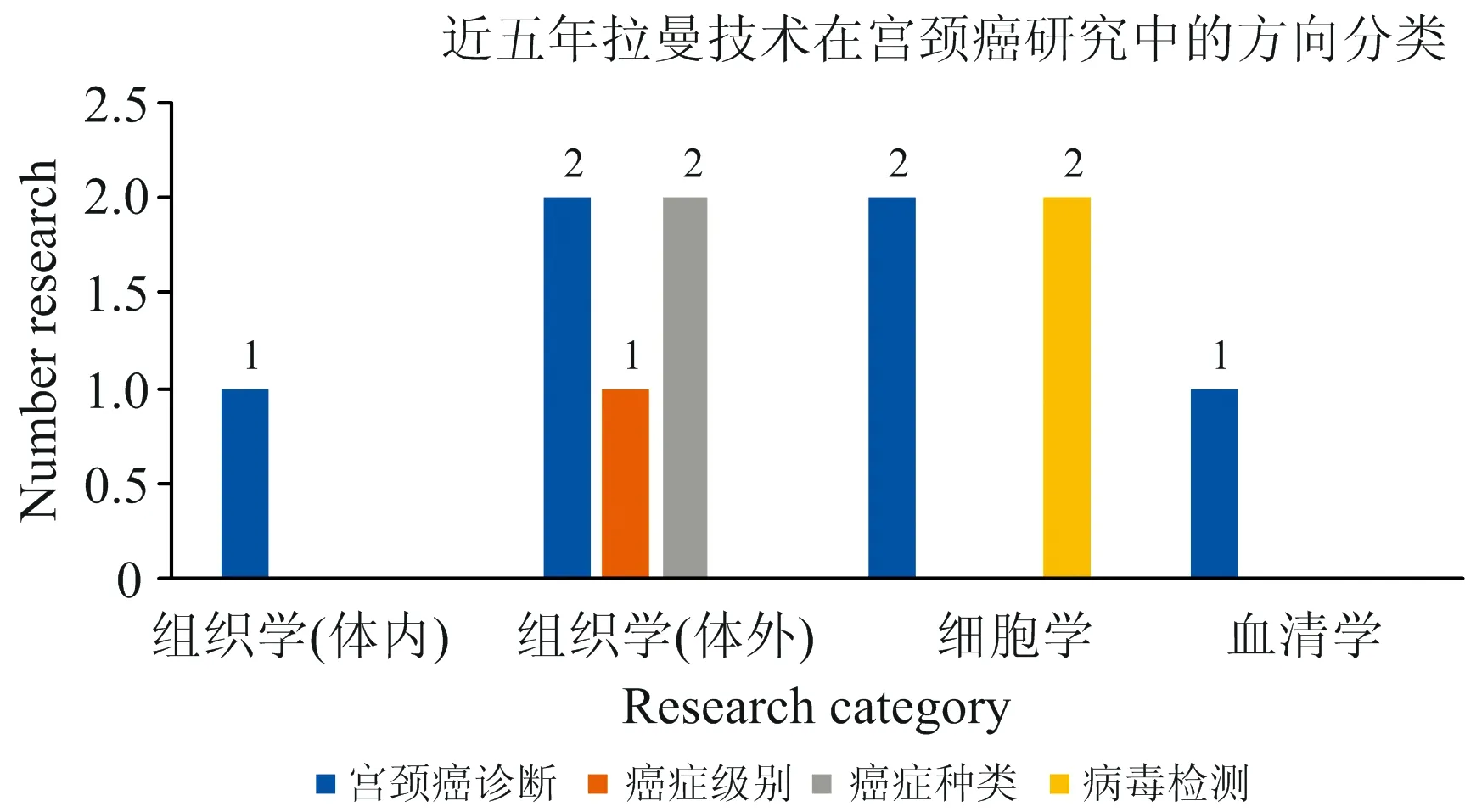
图1 近五年拉曼技术在宫颈癌研究中的方向分类Fig.1 Classification of Raman technology in cervicalcancer research in recent five years

表8 生物大分子代表的波数Table 8 Wave number of biomacromolecules
没有很高的说服力。 本文分类汇总了文中出现的所有文献的研究方向, 制成簇状柱形图放置文末(图1), 还汇总了部分生物大分子所代表的拉曼光谱波数(表8)。 可以看出大部分研究集中在组织学研究, 且体外研究较多, 细胞学以及血清学的相关研究待进一步发展。
同时, 拉曼显微成像技术也存在着一些局限性, 比如拉曼技术的成本与费用高, 拉曼显微镜的高额成本也是其目前研究不多, 以后可能难以推广的原因之一; 还有, 此前的研究大多是在实验室条件下, 是否适用于体内检测还需研究; 由于目前的研究大多还是依赖冰冻切片或者石蜡切片, 虽然少了染色步骤可能带来的误差, 但是切片人员的技术高低也是影响成像清晰度的一大原因, 拉曼显微镜成像清晰度问题对后续研究也有着很大影响。
目前拉曼技术的有关研究都集中在实验室条件下的组织, 关于血清、 分泌物、 代谢产物的研究还有待进一步发展。 拉曼显微镜的优势在于快速、 无创, 目前的研究还局限在制成冰冻或者石蜡切片, 我们期待这一技术可以尽快革新应用于临床, 例如手持便携式拉曼设备, 这种设备更小, 成像更快, 从而实现成本和时间上的高效诊断, 并且可以应用于术中。
