运用生物标志物重建古盐度的研究进展
2022-07-06贾国东
梁 栋, 李 丽, 贺 娟, 贾国东
运用生物标志物重建古盐度的研究进展
梁 栋, 李 丽*, 贺 娟, 贾国东
(同济大学 海洋地质国家重点实验室, 上海 200092)
在古海洋、古环境研究领域, 水体盐度重建是长期以来亟待解决的难题。在无机地球化学作为古盐度计应用日趋成熟的同时, 有机地球化学指标为解决该问题提供了不同的思路和观点。经过数十年来的大量生物培养实验和环境研究, 基于C37:4烯酮的质量分数、古菌膜脂的ACE(archaeol and caldarchaeol ecometric)指数、长链二醇的醇指数指标(diol index, DI)和脂类氢同位素组成等都被证明与水体盐度有相当密切的联系, 可以将它们作为指示区域水体古盐度变化的参考证据。需要指出的是, 由于对这些生物标志物的生物来源和合成过程了解的局限性以及其他环境因素的影响, 本研究也讨论了在具体应用时需要考虑的适用范围及区域校正问题。
盐度; 生物标志物; 氢同位素
0 引 言
盐度是一个非常重要的环境指标, 对全球尺度的海洋循环模式、水文变化和气候变化有重要作用。古盐度重建对于了解区域环境的发展演变过程、不同环境下沉积相的转变和各种矿产资源的富集分布情况有重要的指示意义。但古盐度重建长期以来一直是古海洋和古环境研究领域的难点, 随着分析技术手段的不断发展和研究的逐渐深入, 越来越多的方法和工具被应用于古环境的研究工作中, 并且在研究地质历史时期, 其在海水温度、植被类型、大气CO2浓度、海平面升降和季风活动等多个问题中提供了有力支持。与其他古环境因子相比, 古盐度的研究进展要缓慢得多, 一方面由于海水的流动性, 通常情况下盐度变化幅度并不明显; 另一方面, 造成盐度变化的因素复杂多样, 如蒸发、降水、海冰和河流输入等都能对水体盐度产生影响。长期以来古盐度的研究多借助无机地球化学的手段, 如微量元素比值法(Sr/Ba、Rb/K、B/K等)、磷酸盐法和B、Sr、O同位素等方法(黄思静等, 2016; 毛光周等, 2018)。近年来有机地球化学的应用领域逐渐延伸到古海洋、古环境领域, 多种生物标志物衍生指标相继建立, 在研究古环境变化过程问题上发挥了重要作用, 也为古盐度的研究提供了新的思路和途径, 目前已相继建立多种与盐度相关的有机地球化学指标, 虽然还存在一些尚未解决的问题, 但对当前古海洋、古环境研究工作具有重要参考价值。
1 长链烯酮重建古盐度
长链烯酮是古海洋研究中常见的一类生物标志物, 通常含有2~4个不饱和双键, 主碳链包含36~40个碳原子, 首次在西非海岸外沉积物中被发现(Boon et al., 1978)。该类化合物由少数几种特定藻类产生, 如开放大洋中定鞭藻纲(/)的颗石藻(,)、金藻()、等鞭金藻()和最近发现的阿拉斯加定鞭藻()等(Volkman et al., 1980, 1995; Nakamura et al., 2014; Longo et al., 2016)。这类化合物因为可以重建海水古温度而备受古海洋学家关注(Brasell et al., 1986; Prahl et al., 1987)。相比于其他脂类, 长链烯酮具有来源单一、分布广泛和稳定性强等优点, 是古海洋、古环境研究的理想材料。
1.1 长链烯酮与盐度的关系
烯酮古水温的计算方法利用了含2~4个不饱和键的3种37碳数长链烯酮(C37:2~C37:4, 图1), 通常含4个不饱和键的C37:4烯酮在海洋沉积中的含量较低不易被检测到, 对古水温指标(U37k)影响小, 因而在后来的温度改进关系式中排除了C37:4烯酮(Prahl et al., 1987)。然而, Rosell-Melé (1987)在北大西洋西部的沉积物中检测到C37:4烯酮的含量高达20%, 且对温度重建结果产生明显影响。通过对比海水盐度和C37:4烯酮含量发现两者呈负相关关系, 随海水盐度降低, C37:4烯酮相对含量增加。结合此前在南极埃斯咸水湖中也曾检测到大量C37:4烯酮(Volkman et al., 1988), 推测C37:4烯酮的生物合成可能独立于相对更饱和的C37:2和C37:3烯酮, 因此该研究认为长链烯酮化合物除了作为古温度计的同时也具有指示古盐度的潜力, 并提出以C37:4烯酮在3种C37烯酮中的质量分数作为新的古盐度替代指标, 建立了(C37:4)与盐度的关系式(表1关系式1)。
同样在北大西洋悬浮颗粒物中也有较高的C37:4烯酮, 在大约4℃的环境中(C37:4)可达35%, 虽然(C37:4)与温度和盐度都表现出了相关性, 但与盐度关系更为密切 (Sicre et al., 2002; 表1关系式3)。2000年在白令海东部.勃发时也检测出较高的(C37:4)(18.3%~41.4%), 且同样与盐度呈负相关关系(Rosell-Melé et al., 2002; Bendle et al., 2005; Kaiser et al., 2017; 表1关系式5), 表明该指标适用范围不局限于北大西洋, 也可推广至其他海域(Harada et al., 2003)。此后在北大西洋的边缘海(表1关系式2、4、6)、鄂霍次克海(Seki et al., 2005)和地中海(Blanz et al., 2005)等地都陆续有报道(C37:4)作为盐度指标的可行性。
尽管(C37:4)盐度指标最初建立于北半球高纬度水域, 而之后在陆地湖泊中也陆续得到了验证。但与开阔的海洋不同, 湖泊由于水容量小, 对区域的水文变化更敏感, 在一些湖泊中检测到C37:4烯酮的质量分数最高可达95%(Chu et al., 2005; Liu et al., 2008)。Liu et al. (2008)利用青海湖表层沉积物和集水区的周边湖泊证实了该地区(C37:4)与盐度的相关性(表1关系式7), 而其他环境因素(例如温度)的影响相对小得多。盐度在1.7‰~25‰范围内,(C37:4)相应地从49%减少到15%。随后在青海–青藏高原北部(Liu et al., 2011)、中国西北地区(Song et al., 2016)不同盐度范围(0~300‰)的湖泊中, 对表层湖水和表层沉积物的调查也进一步验证了(C37:4)与盐度的相关性(表1关系式8~10)。
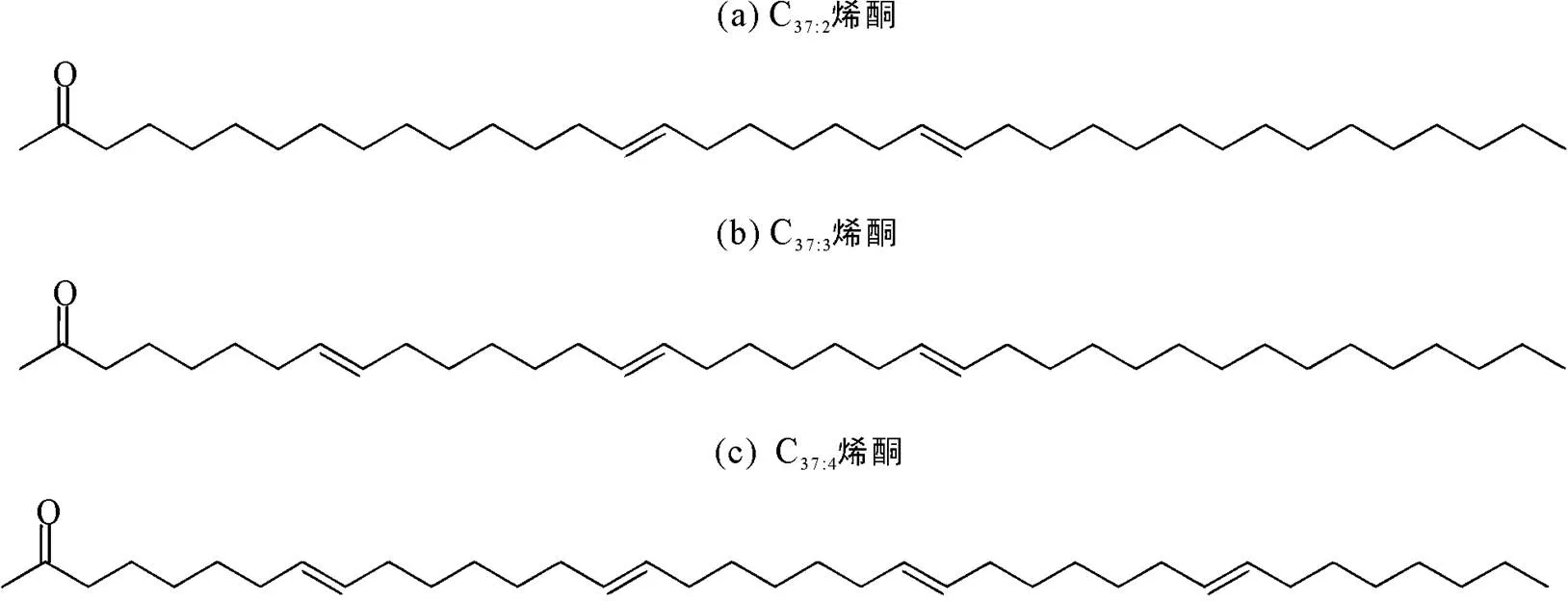
图1 C37:2~C37:4烯酮的分子结构
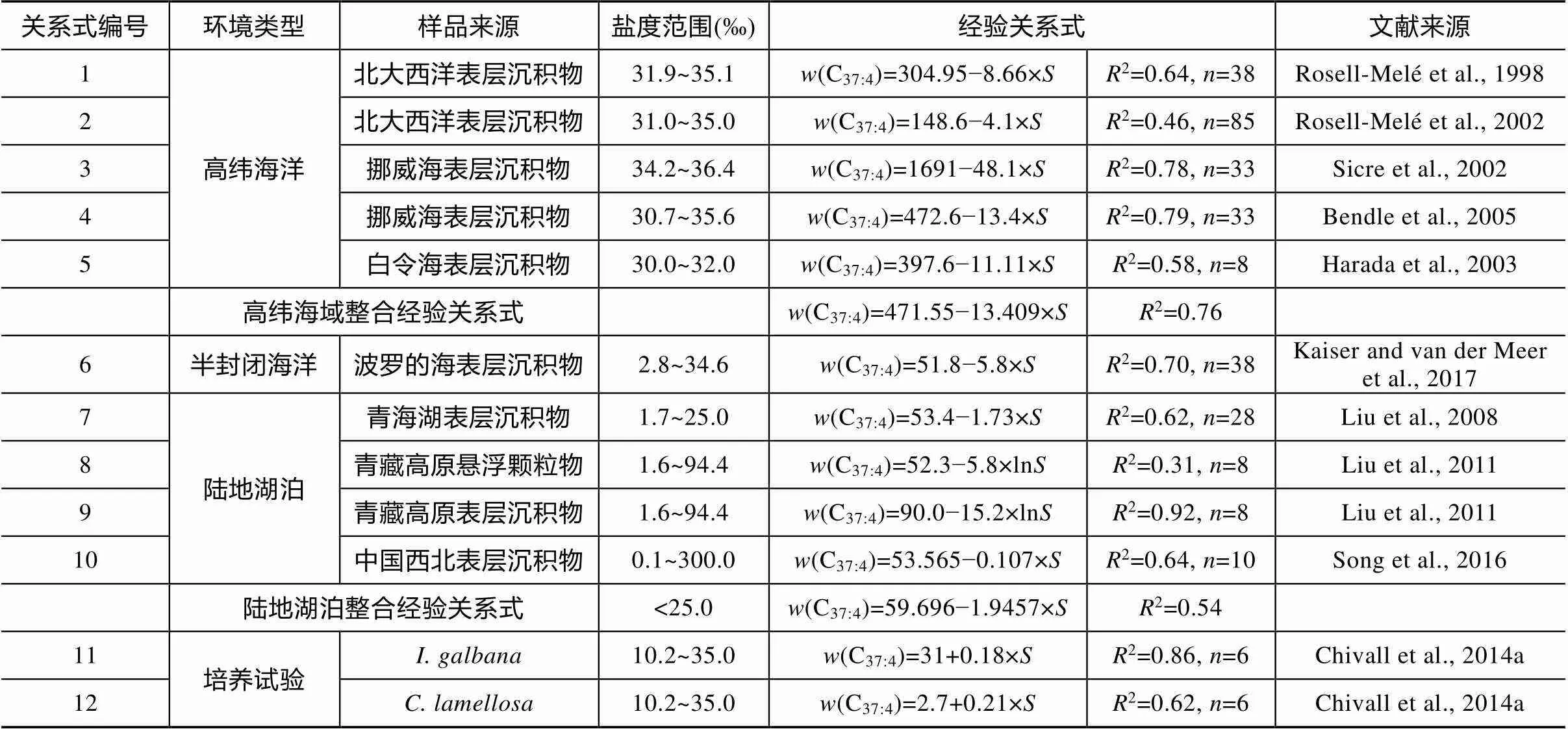
表1 w(C37:4)-盐度关系研究
注: “”表示盐度。
关于(C37:4)对盐度变化的反映机制主要有两种认识, 一种认为盐度对颗石藻本身的生物代谢产生影响, 从而导致C37:4的相对含量变化。Chivall et al. (2014a; 表1关系式11~12)对.和.两种藻类在盐度为10‰~35‰范围内培养后, 发现两种藻类的C37:4相对含量随着单位盐度升高会有0.16%~0.20%的增加, 这与环境观测中(C37:4)随盐度升高而下降的趋势完全不同。同样在美国东海岸切萨皮克湾, 当盐度从4‰增加至31‰,(C37:4)相应地从2%增加至10.5%, 而当地烯酮的生物来源同样是.或., 表明对于单个颗石藻本身而言, C37:4烯酮的合成受盐度控制, 二者呈正相关关系。另一种观点认为单个颗石藻的C37:4合成本身并不受盐度影响, 但是水体盐度梯度变化会使颗石藻属种组成发生相应改变, 从而间接表现为(C37:4)随盐度变化。Ono et al. (2009)曾选择海洋中常见的藻类属种(.和.)在一系列盐度梯度条件下(15‰~34‰, 20℃)进行培养, 均未合成C37:4烯酮。Coolen et al. (2004, 2009)在南极和黑海分别分析了当地定鞭藻的DNA和rRNA信息, 发现与有较近亲缘的新生物类群, 他们的丰度与湖水化学性质特别是盐度变化密切相关, 因而认为长链烯酮含量随盐度变化的实质是盐度梯度变化带来的属种组成的改变。在总结了一些环境来源相近的数据后发现,(C37:4)在不同区域相似环境中对盐度的响应具有相似性, 这说明该指标具有推广应用的可行性。特别指出的是, 在陆地湖泊环境中, 对盐度低于25‰的数据进行统计发现,(C37:4)与盐度具有较好的相关性, 当盐度高于35‰时,(C37:4)与盐度的相关性将大大减弱, 该现象可能与高盐度湖泊水体复杂的化学成分有关, 这可能也表明(C37:4)更适合作为低盐度环境的盐度计。
Xu et al. (2001)在黑海晚全新世沉积物中发现了含有2个双键36个碳的长链乙基烯酮(C36:2烯酮, 图2)。C36:2烯酮的相对含量分布与黑海经历的咸水入侵事件相关, 表明C36:2烯酮含量可能同样受海水盐度控制, 而对该物质的生物来源推测可能不同于2~4个不饱和键的C37~C39烯酮生物源。随后在日本海(Fujine et al., 2006)和佛罗里达的湖泊(van Soelen et al., 2014)也陆续检测到C36:2烯酮。Warden et al. (2016) 在波罗的海发现, C36:2、C37:4和C38烯酮的相对含量都与水体盐度相关, 但C38烯酮与另外两者变化趋势相反, 推测可能是产烯酮藻类属种组成对全新世以来水文条件变化的直接响应结果。同时根据沉积岩心剖面变化和同位素组成差异, 推测C36:2烯酮的前体化合物可能有别于C37~C39烯酮(Xu et al., 2001; van Soelen et al., 2014; Warden et al., 2016)。Coolen et al. (2009)认为该化合物可能来自适应低盐环境的定鞭藻, 但是其具体生物来源目前尚不清楚。此外, 在日本海还检测到含2个双键34碳链的C34:2烯酮, 与C36:2烯酮有良好的相关性, 该物质主要出现在冰期–冰消期转换阶段, 对应浮游有孔虫δ18O负偏, 而在氧同位素正偏时未被检测到, 可能反映了冰盖融化淡水注入导致的低盐环境特征, 具有相似的盐度指示作用(Fujine et al., 2006)。

图2 C36:2烯酮的分子结构
1.2 长链烯酮含量重建古盐度的应用
受分布限制, C37:4烯酮重建古盐度的应用范围主要局限在中高纬、低盐度的边缘海区或湖泊中。例如, 在北海地质记录中, 新仙女木时期(C37:4)的变化表明该时期表层海水盐度下降了1.5‰, 推测与挪威西南夏季海冰的融化有关(Rosell-Melé, 1998)。Warden et al. (2016)在波罗的海分析了全新世以来C36:2、C37:4和C38:2烯酮的相对含量变化发现, 其在7.7~7.2 ka呈现出1次明显的海水盐度剧增的特征, 恰好与同时期的海水侵入事件相对应, 结合Coolen et al. (2013)的18S rRNA的分析结果证实了这一时期主要产烯酮的藻类由于海水盐度的剧变发生了更迭。在白令海南部, 自3.3 Ma起沉积物中开始出现C37:4烯酮, 并且相对含量呈增长趋势, 结合同时期Nd同位素和辐环藻类含量变化, 指示了约3.3 Ma前晚上新世白令海淡水进入北冰洋的事件(Horikawa et al., 2015)。同样位于西北太平洋的鄂霍次克海(Seki et al., 2005), 末次冰期以来(C37:4)出现大幅度波动(4%~35%), 冰期(20%~35%)与暖期(<8%)差别明显, 且与岩心中的冰筏碎屑变化一致2=0.72), 与当时冰期海平面下降导致宫古水道关闭, 阻碍高盐度的暖流进入鄂霍次克海, 使冰期表层盐度降低有关。Martínez-Garcia et al. (2010)发现上新世以来南北极的两个区域(C37:4)呈现同步变化模式, 在1.8~1.6 Ma期间由10%增长到25%, 说明该时期两极变冷以及次极地冷水团向赤道低纬度地区扩张。
相比之下, 长链烯酮在湖泊环境的应用要少得多, 且时间尺度普遍较短。Liu et al. (2006)在青海湖运用长链烯酮对晚全新世约3.5 ka以来的古水温和古盐度进行了恢复, 其中(C37:4)在暖期有较高的值, 指示了该阶段湖水盐度降低, 对应同时期区域的铁氧化物含量增加, 反映了中世纪暖期阶段较长时间的湿润气候和罗马暖期之前的干燥气候, 表明晚全新世温度和盐度同步变化, 为这一时期东亚季风活动增强提供了证据。
综合目前的研究进展,(C37:4)在盐度相对较低的北半球中高纬度冷水中是相当理想的古盐度指示器。另外在一些低盐度半封闭的海洋环境, 如波罗的海、日本海和鄂霍次克海等, 也具有作为古盐度计的应用潜力; 而对于湖泊环境应用(C37:4)的限制条件可能要更复杂, 另外在低纬度海域通常很难检测到C37:4, 也制约了该指标的全球推广。
1.3 长链烯酮重建古盐度的局限性
长链烯酮作为定鞭藻类所合成的特征生物标志物是古环境信息的理想载体, 其在古盐度重建方面也表现出积极信号, 在海洋环境中与其他指标相比, 长链烯酮指标更倾向于指示低盐度的边缘海, 而在大洋环境或其他高盐度体系中往往失效, 主要是由于大洋中定鞭藻类的种类组成相对稳定。
值得注意的是, C37:4烯酮也是陆地湖泊环境中的标志性生物标志物之一, 但是在不同湖泊环境中与盐度相关性的结果并不一致。在格陵兰岛(D’Andrea et al., 2005)、北美(Toney et al., 2010)、西班牙(Pearson et al., 2008)和青海湖(Liu et al., 2008, 2011)等不同类型的湖泊中所得到的(C37:4)与盐度关系之间差别巨大。D’Andrea et al. (2005)检测格陵兰岛湖泊中(C37:4)与盐度响应和相隔不远的北欧海有较大差别。而Toney et al. (2010)调查了北美55个湖泊中仅13个含有烯酮, 只有4个检测到C37:4烯酮, 其含量与盐度之间的相关性极低。Pearson et al. (2008)在调查西班牙内陆湖的54个湖泊中, 只在14个微咸–高咸湖泊中检测到了烯酮化合物, 而在盐度大于40‰时检测不到C37烯酮, 表明盐度是控制产烯酮生物的1个重要指标, 但仅在两个中等盐度的湖泊中检测到C37:4烯酮, 无法评判与盐度的关系。
同时不能忽视温度对C37:4烯酮分布的影响, C37:4烯酮作为构成水温指标U37k的生物标志物之一, 其生物合成过程也受到温度的控制, 潜在的温度效应使得C37:4烯酮对盐度指示更加复杂, 因此该指标在实际应用中还需要考虑温度校正问题(Sikes et al., 2002; Zheng et al., 2016)。
由于2个和3个不饱和键的长链烯酮在生物体内合成过程中主要受环境温度的调节, 而且所有产烯酮藻类在烯酮合成过程中对温度的响应相似, 当温度降低时, 倾向合成更多C37:3烯酮。而C37:4的合成情况受控于母源藻类的种类。海洋型定鞭藻如、一般生活在高盐度的开阔海洋环境中, 其烯酮分布几乎不响应水体盐度变化, 而适应低盐度环境的定鞭藻类, 如、等属种对盐度变化敏感。这对使用(C37:4)进行盐度重建工作造成了不确定性。总体而言, 利用C37:4烯酮质量分数的盐度重建方法主要适用于高纬海域, 特别是存在季节性海冰或半封闭的盐度变化比较大的海域, 以及陆地高盐度湖泊, 而在低纬热带海域由于受温度等影响难以检测到C37:4烯酮, 故该指标在此类场合中受到局限。
2 古菌膜脂化合物重建古盐度
古菌是广泛存在于各种地球环境中的微生物, 可以耐受超出常规温度、pH值、氧化还原和盐度条件的极端环境, 并且能合成特征膜脂化合物: 甘油二烷基甘油四醚化合物(glycerol dialkyl glycerol tetraethers, GDGT)。GDGT生物标志物衍生了一系列古环境指标, 诸如指示海水表层温度的TEX86(Schouten et al., 2002)和表征沉积物陆源输入的支链类异戊二烯四醚指标(branched isoprenoid tetraether, BIT) (Hopmans et al., 2004)等, 这些指标在海洋和陆地相环境研究中均发挥了重要作用(Schouten et al., 2013)。
2.1 古菌膜脂化合物与盐度的关系
大部分古菌能够同时合成archaeol和caldarchaeol (图3)两类膜脂化合物, Kates (1996)研究发现广古菌中嗜盐古菌(halophiles)只合成archaeol而不产生caldarchaeol, 随着水体盐度的上升, 嗜盐广古菌逐渐在古菌群落中占据主导进而影响膜脂的分布特征。Turich and Freeman (2012)根据这一机制用archaeol和caldarchaeol的质量分数建立了ACE指数(Archaeol and caldarchaeol ecometric), 其表达式为:

对4个嗜盐古菌在不同盐度(100‰~300‰)的培养实验中曾检测到饱和、不饱和、多不饱和二烷基甘油二醚结构(包含archaeol), 其中不饱和结构的比例随盐度的增加而增加(Dawson and Freeman, 2012)。环境中随着盐度升高嗜盐古菌逐渐占据主导, caldarchaeol的含量将相应降低。在对全球多个地区20‰~260‰范围内不同盐度环境下的ACE指数进行分析得到了ACE指数与盐度的关系(Turich and Freeman, 2012): 100×ACE=0.35×−5.37(2=0.87,=26)。
图3 Archaeol与Caldarchaeol的分子结构
Fig.3 Molecular structure of archaeol and caldarchaeol
在Turich and Freeman (2012)的调查数据中盐度跨度大, 其与ACE指数之间存在着很强的线性关系, 但在该数据资料中淡水和海洋盐度(<35‰)的数据比较分散, 考虑到该关系式存在的不确定性, 在进一步校准之前, 可以利用ACE指数的强度给出盐度的范围, 而不是特定的盐度值。据此Turich and Freeman (2012)依据ACE指数将盐度划分为3个区间, 见表2。
嗜盐广古菌具有多样性和活跃性, 能够耐受的盐度达到NaCl饱和程度的环境(Oren, 2002)。尽管嗜盐菌依赖于脂类极性头进行渗透调节, 但archaeol和caldarchaeol与渗透调节的关系还不清楚(Wang et al., 2013)。这种盐度重建的脂类生物标志物方法是对现有古盐度替代指标的很好补充。一方面, 古菌可以在更广泛的盐度范围和更古老的地质时期生存繁衍, 远远超过定鞭藻类和其他浮游生物; 另一方面, 它为判断高盐度环境提供了可靠的生物指标, 使我们能够为高蒸发海洋环境(如死海、二叠纪特拉华盆地等)的盐度变化、卤水演化和蒸发岩沉积的研究提供新的帮助。
Wang et al. (2013)研究了青藏高原东北部9个湖泊中(盐度变化范围1‰~325‰)的悬浮颗粒物和表层沉积物的古菌核脂(core lipid, CL)、极性脂质(intact polar lipid, IPL), 它们的盐度和ACE指数之间的相关性类似。ACE值与所有样品的盐度呈正相关关系, 在湖泊的悬浮颗粒物和表层沉积物中的关系分别见式(2)和式(3)。
ACESPM=0.28×+11(2=0.95,=11) (2)
ACESed=0.28×−0.19(2=0.96,=11) (3)
式中:ACESPM为悬浮颗粒物的ACE指数;ACESed为沉积物的ACE指数。CL-ACE值系统地高于IPL-ACE值, 可能与IPL和CL的降解机制差异有关; 表层沉积物的ACE指数值也整体低于悬浮颗粒物ACE指数值, 可能与表层沉积物caldarchaeol的含量偏高有关。但总体看来该指标在青藏高原有很好的适应性, 具有推广到其他地区的价值。

表2 ACE指数范围与对应环境盐度划分
2.2 古菌膜脂化合物ACE指数重建古盐度的应用
在某些高蒸发、高盐度的极端环境且其他地球化学指标可能失效的情况下, ACE指数能够填补这一缺陷, 为盐度指示提供可靠的参考。尽管目前已经初步建立了ACE指数和盐度的线性关系, 但由于存在相当大的不确定性, 除极端高盐度环境以外, Turich and Freeman (2012)建议将ACE指数作为定性判断盐度范围的指标, 这对于高分辨率的古海洋、古环境研究而言还远远不够。目前成功应用ACE指数重建古盐度的报道相对较少, 比较典型的是Wang et al. (2015)对比青海湖约18 ka以来ACE指数和Sr/Ca比值反演的盐度变化模式, 发现两者在几次重要的盐度变化事件上表现出一致性。意大利南部墨西拿石灰岩一直被认为是一般海相蒸发沉积形成的, 而Birgel et al. (2014)和Christeleit et al. (2015)分别对意大利石灰岩和地中海西部海盆的研究表明, 两地区的ACE指数均指示, 在墨西拿盐度剧变时期的碳酸盐沉积可能来源于下层高盐度(>75‰)海水过饱和沉积而非海水蒸发。虽然目前利用ACE指数主要给出盐度范围而不是特定的盐度值, 未来通过更精细的校准, ACE指数将可用于计算绝对盐度值, 从而为深刻理解盐度演变提供了一种可能的方法。目前ACE指数对于高盐度环境是一种合适的古盐度重建的参考指标, 而要将其应用于中低盐度水域还有一定难度, 尤其是要解决其他生物来源的archaeol和caldarchaeol干扰这一问题。
2.3 古菌膜脂化合物重建古盐度的局限性
ACE指数和盐度的关系式建立在较宽的盐度范围(20‰~260‰)内, 二者的相关性在低盐度和正常盐度(<35‰)环境下要明显减弱, 很大程度上与低盐度的边缘海受到陆源输入、上升流等复杂因素的干扰有关。在Turich and Freeman (2012)最初提出的关系式中, ACE指数与盐度成正比, ACE指数高值时对应盐度增加。然而近些年来的研究却发现了相反的情况。Günther et al. (2014)注意到青藏高原西南的咸水湖泊中ACE指数随盐度增加呈轻微的负相关关系, 因此认为ACE指数可能更多地反映了环境中发生的古菌群落的变化。中国西北茶卡盐湖的盐度是一般海水的10倍, 虽然其ACE指数(平均0.41)高于周边河流和土壤(<0.1), 但是显著低于大洋。Li et al. (2016)分析认为周边碱性土壤中高含量的caldarchaeol是产生偏差的重要原因。在地中海墨西拿盐度剧变时期检测到高ACE值(14~67), 对应盐度从61‰增加到201‰, 但缺乏相关岩性证据的支持(Natalicchio et al., 2017), 这些矛盾主要与archaeol和caldarchaeol来源的复杂性有关。建立ACE指数所使用的沉积物和悬浮颗粒中caldarchaeol含量丰富, 其他GDGT含量较少甚至接近于0。因此, 只有当caldarchaeol是主要的GDGT类物质时(caldarchaeol/crenarchaeol值远远大于1.5), ACE指数才能提供可靠的盐度估算值(Natalicchio et al., 2017)。嗜甲烷广古菌和产甲烷广古菌也产生大量的archaeol 和caldarchaeol, 会得到较高的caldarchaeol/crenarchaeol值和盐度(Feng et al., 2014)。在法属西印度群岛的热带水塘中, 低盐度水体中也检测到非常高的ACE指数(>0.9), 主要归因于该湖泊中复杂的古菌群落, 既有广古菌也有奇古菌好热泉古菌(Huguet et al., 2015)。尽管理论上只有嗜盐古菌能够耐受高盐度环境, 但实际在一些高盐度环境中仍检测到有其他来源caldarchaeol的合成。在瑞典南部, Weijers et al. (2009)对当地高盐度的沼泽沉积物进行16S rRNA分析时检出了产甲烷古菌以及caldarchaeol。
以上研究说明, ACE指数不仅取决于盐度, 更取决于用于计算的所有古菌脂类的来源。目前运用单一ACE指数重建盐度仍需谨慎, 往往需要与其他岩石或地球化学证据相结合。总体来看, 在高盐度环境中, 如构造和水文导致盆地隔离(墨西拿地中海、大盐湖)、停滞和缺氧环境(二叠纪特拉华盆地), ACE指数能够为盐度的定性变化趋势提供参考, 但是在一般的海洋或低盐度湖泊环境中盐度本身变化很小, 且古菌脂类来源更加复杂, 并不适合用ACE指数作为盐度的研究手段。
3 长链烷基二醇重建古盐度
长链烷基二醇(long-chain alkyl diols)一般指碳数范围为24~36, 碳链首位和中间位置连接有羟基官能团的类脂化合物, 该类物质普遍存在于海洋、河流和湖泊环境中, 但链长和羟基位置存在一定差异。目前该类物质的生物来源还存在不确定性, 普遍认为1,13-二醇和1,15-二醇可能主要来源于真眼点藻(), 而硅藻()是上升流地区1,14-二醇的主要生物来源(Volkman et al., 1992; 侯笛等, 2019)。已有研究表明, 水体温度、盐度和营养盐等对该类物质的组成有重要影响(Versteegh et al., 1997; Rampen et al., 2012)。
3.1 长链烷基二醇与盐度关系
Versteegh et al. (1997)研究发现海洋沉积物1,15-C30烷基二醇、酮醇是长链烷基二醇的主要成分, 在湖泊沉积物1,15-C32二醇同系物中占比较高。据此, Versteegh et al. (1997)首先提出利用长链烷基二醇类化合物质量分数重建盐度变化, 即基于1,15-C30和1,15-C32二醇(图4)建立了二醇指数(diol index, DI):

式中:D表示二醇指数;表示质量分数。
DI指数计算的结果表明, 这一指标与长链二醇的来源密切相关。培养实验中获得的DI指数均小于10, 在淡水和半封闭的低盐度海域(如波罗的海), DI指数一般在25~67之间, 热带上升流影响区域范围为68~79, 而开放海洋环境中一般大于79。由于DI指数随着环境盐度相应上升, 因而可以用二醇指标指示盐度变化。
3.2 长链烷基二醇DI指数重建古盐度的应用
Versteegh et al. (2000)利用DI指数作为水体盐度变化指标示踪大西洋东南部4个区域的水文特征, 同时指出了南安哥拉海盆深海氧同位素5期事件(marine isotope stage 5, MIS 5)阶段的水文变化, 该时期DI指数变化范围为88~94, 并呈逐渐降低的趋势, 指示了海洋表层水上升流的变化。胡建芳等(2001) 对南海南部0.03 Ma来的沉积中的DI指数的研究表明, 该指数在全新世大于79, 指示了开放的海洋环境, 而在冰期多小于79, 最低为44, 对应相对局限的海洋环境, 该结论与冰期海平面下降约1120 m、陆架大面积出露和南海成为一个半封闭的袋状海湾的海洋环境变迁一致, 同时末次冰期以来的系列快速气候变化事件在DI指数中也有体现。南海北部珠江口盆地沉积物中DI指标也记录了南海季风性气候以及淡水入侵的影响(朱小畏等, 2014)。Pinturier-Geiss et al. (2002)通过对近两百年来挪威邦妮湾沉积物DI的研究, 指出了该区域从典型的海洋环境(DI>68)逐渐演变为半封闭的咸水环境(DI<67), 并对期间的淡水入侵事件也有很好的记录(DI<10)。Kotthoff et al. (2017)在IODP347航次中对西波罗的海全新世的海水盐度进行多指标重建, 其DI指数结果表明约7.4 ka区域海水盐度突变, 此后在7.4~4.1 ka中逐渐升高, 直至4.1 ka的另一次盐度降低事件。在该研究中DI指数与其他盐度指标的变化趋势高度吻合, 表明其确实具有作为古盐度指示器的参考意义。这些研究体现了DI指数在研究海洋环境变化时的可行性。
图4 1,15-C30和1,15-C32二醇的分子结构
3.3 长链烷基二醇DI指数重建古盐度的局限
由于1,15-C30二醇和1,15-C32二醇均由淡水藻产生, 其对盐度的指示更多来源于陆源输入影响, 因此, DI指数作为研究古盐度的指标只能对环境进行大致判断和分类, 要定量建立盐度关系有较大难度。此外Méjanelle et al. (2003)的研究指出海洋生物的摄食作用也会对DI指数产生较大的影响, 在两种生物及其粪便中所提取的二醇在经过摄食作用后, DI指数均发生了变化, 若使用统一划分标准不可避免产生误差。
4 脂类氢同位素重建古盐度
水的氢同位素组成无论在海洋还是陆地环境中都是研究古水文的重要手段之一, 蒸发、降水、冰川发育和河流输入等一系列水循环过程及相关环境因子都会对体系的氢、氧同位素组成产生不同程度的影响。其中氢原子可以被自养生物的细胞所利用合成各种脂类化合物, 这使水中的氢同位素组成变化可以在各种脂类生物标志物中得到直接反映。Englebrecht and Sachs (2005)对的重水培养实验表明, 其合成的烯酮D/H值与培养水体的D/H值有显著相关关系(2=0.999,=5)。同时在自然界中水体氢同位素通常和盐度关系紧密, 如Sachs and Schwab (2011)在切萨比克湾检测到当地海水δD值与盐度呈正相关关系(2=0.91), 在Schouten et al. (2005)的培养实验中水的δD值与盐度同样呈强烈的正相关关系(2=0.96), 因此脂类氢同位素作为水文信息载体无疑具有成为古盐度计的潜力。
由于分析技术条件制约, 早期的研究只能分析样品中总有机质的氢同位素组成, 如Krishnamurthy et al. (2000)分析了地中海腐泥层沉积的总有机质δD值认为, 其沉积过程表层海水可能发生过数次盐度变化, 然而其局限也显而易见, 沉积物中的成分组成复杂, 自养与异养、原核与真核生物所合成的产物δD值有显著差别, 因此很难反映出准确可靠的古水文信息。直到20世纪90年代单体氢同位素检测技术的成熟使得测定单体化合物δD值成为可能(Sessions et al., 1999), 在此基础上对多种脂类的δD-盐度相关性进行验证产生了一系列研究, 并在多个地区建立起了氢同位素的古盐度计。相比于生物标志物指标, 氢同位素的使用限制相对小得多且更具有普遍性。
4.1 脂类氢同位素与盐度的关系
Schouten et al. (2005)最早在和培养实验中发现盐度每升高1‰, 其合成的烯酮δD值相应地会提高约3.3‰, 为了校正水体本身的同位素变化影响, 通常以脂类相对水体的分馏系数lipid-water探讨环境因素对脂类氢同位素的影响。
lipid-water=(D/Hlipid)/(D/Hwater)=
(1000+δDlipid)/(1000+δDwater) (5)
式中:lipid-water为脂类与环境水体之间的分馏系数; D/Hlipid为脂类里氢的两种同位素D和H的比值; D/Hwater为环境水体中氢的同位素D和H的比值; δD值代表D/H值与维也纳标准平均海水(Vienna Standard Mean Ocean Water, VSMOW)的D/H比值的差值。实验发现温度对于氢的分馏的影响相对于盐度要小得多, 而不同属种藻类对于盐度变化的敏感有所差别,的分馏程度要更强一些(表3关系式1和2)。之后陆续有一系列培养实验对多种脂类的δD值与盐度关系进行探究, Sachse and Sachs (2008)在赤道太平洋圣诞岛对当地蓝藻脂类进行分析发现, C17正构烷烃、植烯氢同位素分馏和盐度正相关关系明显(表3关系式50~52), 在切萨比克湾对甲藻甾醇氢同位素分析(Sachs and Schwab, 2011)也发现了相似的关系(表3关系式44~45)。总体而言, 单位盐度增加对应脂类氢同位素分馏程度有0.7‰~2‰的增加。由于长链烯酮是海洋环境中常见的脂类分子, 其生物来源相对单一, 因此培养实验研究主要以定鞭藻类作为培养对象, 如van der Meer et al. (2013)、Chivall et al. (2014b)、M’boule et al. (2014)和Sachs et al. (2016)分别对多个属种和种系的定鞭藻产生的长链烯酮的氢同位素进行了分析, 虽然其对盐度的响应程度有所差异, 但是都与Schouten et al. (2005)的结果一致(表3关系式3~17、19)。Maloney et al. (2016)和Sachs et al. (2016)对和的培养发现, 其合成的脂肪酸氢同位素也有类似规律(表3关系式20~22, 23~26)。Gould et al. (2019)在大西洋和太平洋的大范围调查研究也说明海洋中烯酮的氢同位素和盐度呈正相关关系(表3关系式30), 该关系式与培养实验烯酮分馏系数、盐度的关系式有非常相似的斜率和截距, 反映了大洋中盐度对生物合成烯酮中的氢同位素起关键控制作用。
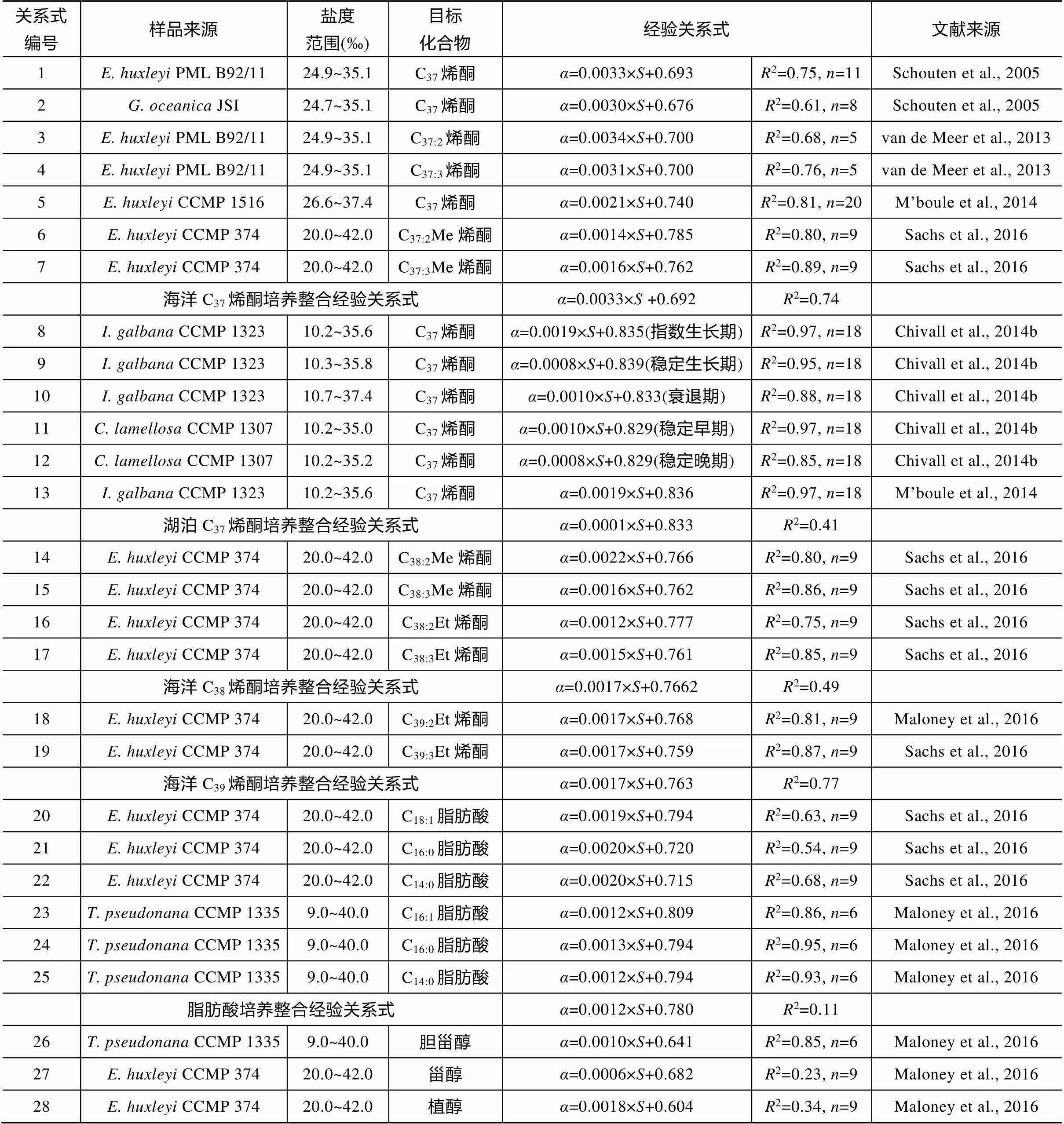
表3 脂类氢同位素–盐度关系研究

续表3:
关于盐度对于脂类分子氢同位素的影响机制, 一种观点认为, 盐度增高所引起的细胞渗透压的改变会对细胞内外水交换产生抑制, 导致细胞内大量滞留富集D的代谢水, 最终使合成的脂质δD值升高(Sachse and Sachs, 2008); 另一种观点认为盐度会改变脂类合成所利用的H的来源, 通常情况下脂类合成利用胞内水、还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate, NADPH)和氧化型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate, NADP), 后者更加亏损D, 如果胞内水的利用比例增加势必会造成合成脂类δD值相应提高(Schwab and Sachs, 2011)。还有研究表明, 区域的生物组成变化也可能造成脂类δD值的变化(Zhang and Sachs, 2007), 但是缺乏进一步的证据支持。环境中水的δD值与最终产生的脂类分子δD值的差别主要来源于细胞内生物合成过程中的分馏作用。生物合成分馏产生的δD值差异范围为200‰ ~ −400‰(Sauer et al., 2001; Chikaraishi and Naraoka, 2003; Zhang and Sachs, 2007; Zhang et al., 2009), 目前对生物标志物在细胞内的具体转化过程还有待进一步了解, 现有的研究指出, 生物标志物δD值的差异来源有4个方面: ①生物标志物在细胞内的合成过程伴随着一系列复杂的酶催化反应, 而不同的反应系列往往伴随着不同程度的氢同位素分馏; ②脂类生物标志物的合成路径主要有3条, 一是生成烷基脂类的产乙酸途径(the acetogenic pathway), 二是合成甾类、萜类和藿烷类的甲戊酸(mevalonic acid)途径, 三是合成类异戊二烯化合物的脱氧D-木酮糖-5磷酸(1-deoxy-D-xylulose-5-phosphate, DOXP)或2-甲氧基-4丙基苯酚(2-methylerythroyl-4-phosphate, MEP)途径, 不同的合成途径中氢同位素分馏不同(Lichtenthaler, 1999; Schmidt et al., 2003; Chikaraishi et al., 2004); ③即使是同一途径合成的脂类也可能有很大的氢同位素分馏差异, 如不同饱和度的脂肪酸、烯酮等, 这种化合物的饱和度变化带来的分馏有时达到200‰ (Schwab and Sachs, 2009), 与酶催化过程的同位素效应有关; ④去羟基过程, 如链烷酸转化为烷烃, 也会伴随着δD值16‰~25‰的变化(Chikaraishi andNaraoka, 2007)。
从自由水经卡尔文循环进入NADPH中的氢是细胞合成脂类的直接氢来源, 但是产生NADPH的水并不一定来自细胞外界环境。自养生物细胞中NADP转化成NADPH的过程中利用的水有相当一部分来自细胞内部代谢产生的水, 因而NADPH与培养水体氢同位素分馏可达600‰(Schmidt et al., 2003)。因为不同的代谢过程产生的水的氢同位素各不相同(Yakir and Deniro, 1990), 在不同生长阶段, 细胞内代谢水的比例也有差异, 这些因素都对最终产物氢同位素产生影响。
以上重点探讨了盐度对脂类生物化学合成过程中分馏系数的影响, 在环境中源水的氢同位素组成差异也会对脂类的氢同位素产生影响, 当温度升高或相对湿度减小的情况下水气蒸发作用加剧, 相对重的HDO比相对轻的H2O更倾向于留在液相中, 最终导致水体中富集D, 而大气中的水相对贫D, 导致了降水的δD值时空分布差异, 以及源水不同的同位素特征。此外海水和河流中的δD值特征不同, 前者富D, 后者贫D, 造成了在边缘海或半封闭海域, 海水δD值除了受蒸发和降水影响, 很大程度与河流淡水输入有关, 大量淡水输入会显著降低海水的δD值。地质历史时期, 在冰期阶段大规模冰川形成会带走海水中比较轻的H2O而留下更重的HDO, 从而使海水δD值上升, 而冰消期则会相应地将D亏损的H2O释放回海洋从而降低海水δD值。因此在不同地区的脂类δD值对盐度变化的响应存在差异。由于生物合成过程的复杂性以及对细胞内运作机制了解的局限, 要进一步探究具体的同位素变化还需要更多的实验室培养及野外研究, 同位素示踪技术可能为这一问题提供帮助。
4.2 脂类氢同位素在古盐度重建中的应用
自从建立了脂类氢同位素与盐度的关系, 不少研究者尝试用其对古盐度进行重建。van der Meer et al. (2007)对东地中海124~129 ka前S5(Saprople5)腐泥层沉积中的C37烯酮的δD值进行了分析, 依据Schouten et al. (2005)建立的相关关系对该时期盐度变化进行反演, 结果表明, 在末次间冰期当地盐度从39‰降至33‰; 在巴拿马盆地的C37烯酮的δD值记录反映了27 ka以来降雨量造成的盐度波动情况, 由此指示了赤道辐合带南移事件(Pahnke et al., 2007);而在东非西部的几内亚湾, Leduc et al. (2013)对比了约10 ka以来C37:2烯酮δD值、δ18O值和Ba/Ca比值记录, 从中发现了三者在记录降雨导致的盐度变化方面的一致性, 从10 ka至3 ka总体上δD值有10‰左右的增幅, 结合Rohling (2007)提出的δ18O值与δD值相结合的模式计算, 盐度从10‰升至29‰, 并据此提出大气环流和低纬度地区降水之间的联系。
Kasper et al. (2014)和Simon et al. (2015)在南非厄加勒斯角分别对末次冰期以及MIS 6/5时期的烯酮δD值进行分析, 两个阶段均有约14‰的下降, 推测在期间产生了1.7‰~1.9‰的盐度变化, 这一结论与Mg/Ca比值数据相吻合, 由此指示了冰期–间冰期海水在印度洋–大西洋通道的交换情况; Kandiano et al. (2017)对北大西洋的研究认为在MIS 11时期海冰引起的海水盐度变化是引起烯酮δD值变化的直接原因, 单位盐度所引起的δD值升高, 范围在4‰~5‰之间, 由此根据古盐度与其他指标对MIS 11变暖事件的响应重建了冷水团的运动情况, 并指出北大西洋MIS 11事件可能是由表层淡水输入所引发。此外, Sachs et al. (2018)在北极地区研究了十六酸的δD值, 发现其变化幅度高达118‰, 反映了约21‰的盐度变化, 在验证了其盐度相关性后, 该研究同时对加拿大麦肯齐河的十六酸δD值进行了测试, 发现区域海水表层盐度在早全新世经历了从20‰到16‰再回升到24‰的变化过程, 据此认为阿加西冰川湖的洪水经由麦肯齐河进入北冰洋可能是新仙女木事件的触发事件之一。此外, 对地质历史上冰期旋回时期利用烯酮的δD值重建古盐度时, 除考虑冰盖扩张和消融对大洋水源的氢同位素的影响, 冰期和间冰期之间的温度差异也需要考虑, 尤其在非赤道地区的北大西洋或者北冰洋, 因为温度对生物标志物的D/H分馏有着明显的影响。
4.3 脂类氢同位素在古盐度重建中的局限性
虽然盐度对生物合成脂类的氢同位素有重要影响, 但培养和野外调查的工作表明, 盐度以外的其他环境因子也会对细胞合成脂类的D/H比值分馏产生不同程度影响, 例如温度(Anhäuser et al., 2014)、光照(van der Meer et al., 2015; Weiss et al., 2017; Sachs et al., 2017)、生长速率(Wolhowe et al., 2009; Sachs and Kawka, 2015)、生长阶段(Wolhowe et al., 2009; Heinzelmann et al., 2015)、生物种属(Chivall et al., 2014b; M’Boule et al., 2014)、碱度(Weiss et al., 2017)和细胞代谢物的类型、数量(Heinzelmann et al., 2015)等。Schwab and Sachs (2011)和Sachs and Schwab (2011)在切萨皮克湾的研究发现, 区域的甲藻甾醇氢同位素随盐度升高有明显的分馏变化(0.99‰), 而烯酮氢同位素虽然也随盐度增加相应升高, 但是烯酮与海水的分馏系数并没有变化, 意味着当地烯酮氢同位素变化来源于海水本身的D富集而非盐度影响, 对此的解释之一是生成烯酮的定鞭藻类在沿盐度梯度变化时种类发生了变化, 而合成甲藻甾醇的甲藻或许不存在这一问题, 又或不受这一因素影响(Chivall et al., 2014b)。从全球范围来看, 无论低纬度还是中高纬度、海洋环境还是陆地环境, 脂类δD值和盐度普遍具有相似的相关关系和比较接近的分馏变化, 考虑到不同环境生物组成的差异性, 很难说都是由生物组成变化所引起的, 要进一步探究生物组成变化与盐度、脂类氢同位素的关系可能需要借助DNA或RNA分析进行确定。
Schouten et al. (2005)在培养实验中就发现生长速率与合成长链烯酮来源水之间的分馏系数呈负相关关系; Zhang et al. (2009)的分析发现的生长速率在盐度为24‰~32‰之间几乎保持不变, 但是到了36‰时, 生长速率降低了近一半, 表明该藻类对盐度有一个适应区间, 在该区间内细胞可以维持正常的代谢, 但是过了这个点, 会非常不适应, 从而反映出生长速率的强烈变化, 以及对应D/H分馏系数的变化; 藻类的生长阶段对氢同位素分馏的影响也很明显, 在指数发育阶段脂类合成对盐度最敏感(Wolhowe et al., 2009; Chivall et al., 2014b); 营养盐对脂类合成的氢同位素也有不同影响, 例如两种淡水绿藻在缺氮条件下合成的甾醇等异戊二烯结构的脂类 δD值偏重, 而对线性脂类, 如脂肪酸等的同位素分馏没有显著影响(Zhang et al., 2009); 5种淡水绿藻的培养结果也表明, 相同脂类的氢同位素在不同属间的差异可达100‰, 同属不同种类间也有10‰~15‰的差异(Zhang et al., 2007)。硅藻培养中光照与植醇、C14:0脂肪酸的δD值呈正相关关系, 而与菜籽甾醇的δD值呈负相关关系。而在的培养实验中, 烯酮的δD值则没有表现出与光照的显著相关关系(van der Meer et al., 2015; Weiss et al., 2017; Sachs et al., 2017)。
相比培养实验, 自然环境中脂类的δD值与盐度关系要复杂得多。总结几个主要的培养实验得到了C37烯酮-盐度的经验关系式, 两者具有较高的相关性(2=0.74), 表明同源的生物标志物在氢同位素分馏过程中对盐度变化的敏感程度相似, 但是对区域研究数据的综合分析则难以呈现这种相关性。亚马逊悬浮颗粒物中的C37烯酮、C16:0脂肪酸的δD值与盐度之间不存在显著相关关系(Häggi et al., 2015; 表3关系式29、53); 在美国切萨皮克湾河口以及盐度范围为10‰~133‰的北美湖泊中, 多种C37、C38烯酮分馏系数与盐度之间相关性偏弱, 甚至出现负相关关系(Schwab and Sachs, 2011; Nelson and Sachs, 2014a, 2014b; 表3关系式32~34、37、39~42)。邢磊等(2016)对长江口表层悬浮颗粒物的研究也发现, 脂肪酸、水的分馏系数与盐度呈负相关关系, 可能是其他因素(光照强度或脂肪酸的生物来源)而不是盐度引起。综上所述, 进一步了解不同脂类分子在细胞内的生物合成过程以及所伴随的同位素分馏变化是提高氢同位素盐度计可信度和适用性的关键, 在今后的研究中仍需要不断完善这方面的工作。
5 结 语
定量描述海水盐度变化面临诸多问题, 基于生物标志物的有机地球化学在重建古盐度的应用中有以下特点:
(1) 生物尤其是自养生物对水体盐度的细微变化十分敏感, 并且能以生物标志物的形式将这些变化记录下来。
(2) 当前受技术手段和认知的制约我们尚且不能了解生物对环境变化响应的作用机制, 因此脂类的细胞内生物合成过程是需要重点研究的一项内容, 这有助于进一步准确解读各种分子化石的古环境意义。
(3) 重建古盐度是一个复杂的过程, 需要考虑其他环境因素影响且需要与元素地球化学、地层构造、生物特征等相结合, 这样才更有助于得到准确可信的古环境记录信息。
致谢: 浙江大学张朝晖教授和中国海洋大学邢磊教授在审稿过程中提供了诸多宝贵的修改意见, 在此表示衷心感谢。
侯笛, 张俊杰, 邢磊, 周阳. 2019. 长链烷基二醇在海洋环境重建中的研究进展. 地球科学进展, 34(2): 140–147.
胡建芳, 彭平安, 房殿勇, 贾国东, 汪品先. 2001. 南海沉积物中C30-C32烷基二醇的检出及可能的古环境信息. 地球化学, 30(6): 569–578.
黄思静, 李小宁, 胡作维, 刘四兵, 黄可可, 钟怡江. 2016. 四川盆地东部开江–梁平海槽东西两侧三叠系飞仙关组碳酸盐岩碳氧同位素组成对比及古海洋学意义. 地球化学, 45(1): 24–40.
毛光周, 刘晓通, 安鹏瑞, 孟令强, 杨锋杰, 陈雷. 2018. 无机地球化学指标在古盐度恢复中的应用及展望. 山东科技大学学报(自然科学版), 37(1): 92–102.
邢磊, Sachs J P, 张海龙, 李莉, 季仲强, 赵美训. 长江河口区悬浮颗粒物中十六烷酸和十八烷酸的氢同位素. 2016. 中国科学: 地球科学, 46(2): 191–198.
朱小畏, 孙永革, 茅晟懿, 管红香, 吴能友. 2014. 珠江口盆地Site4B柱状沉积物中长链烷基二醇和酮醇类化合物的检出及意义. 地学前缘, 21(6): 321–334.
Anhäuser T, Sirocko F, Greule M, Esper J, Keppler F. 2014. D/H ratios of methoxyl groups of the sedimentary organic matter of Lake Holzmaar (Eifel, Germany): A potential palaeoclimate/-hydrology proxy., 142: 39–52.
Bendle J, Rosell-Melé A, Ziveri P. 2015. Variability of unusual distributions of alkenones in the surface waters of the Nordic seas., 20(2): 1–15.
Birgel D, Guido A, Liu X L, Hinrichs K U, Gier S, Peckmann J. 2014. Hypersaline conditions during deposition of the Calcare di Base revealed from archaeal di- and tetraether inventories., 77: 11–21.
Blanz T, Emeis K C, Siegel H. 2015. Controls on alkenone unsaturation ratios along the salinity gradient between the open ocean and the Baltic Sea., 69(14): 3589–3600.
Boon J J, van der Meer F W, Schuyl P J W, de Leeuw J W D, Schenck P A, Burlingame L A. 1978. Organic geochemical analyses of core samples from Site 362, Walvis Ridge, DSDP Leg 40.: 627–637.
Brassell S C, Eglinton G, Marlowe I T, Pflaumann U, Sarnthein M. 1986. Molecular stratigraphy: A new tool for climatic assessment., 320(6058): 129–133.
Chikaraishi Y, Naraoka H. 2003. Compound-specific δD-δ13Canalyses of-alkanes extracted from terrestrial and aquatic plants., 63(3): 361–371.
Chikaraishi Y, Naraoka H. 2007. δ13C and δD relationships among three-alkyl compound classes (n-alkanoic acid,-alkane and-alkanol) of terrestrial higher plants., 38(2): 198–215.
Chikaraishi Y, Naraoka H, Poulson S R. 2004. Hydrogen and carbon isotopic fractionations of lipid biosynthesis among terrestrial (C3, C4and CAM) and aquatic plants., 65(10): 1369–1381.
Chivall D, M’Boule D, Sinke-Schoen D, Sinninghe Damsté J S, Schouten S, van der Meer M T J. 2014a. Impact of salinity and growth phase on alkenone distributions in coastal haptophytes., 67: 31–34.
Chivall D, M’Boule D, Sinke-Schoen D, Sinninghe Damsté J S, Schouten S, van der Meer M T J. 2014b. The effects of growth phase and salinity on the hydrogen isotopic composition of alkenones produced by coastal haptophyte algae., 140: 381–390.
Christeleit E C, Brandon M T, Zhuang G S. 2015. Evidence for deep-water deposition of abyssal Mediterranean evaporites during the Messinian salinity crisis., 427: 226–235.
Chu G Q, Sun Q, Li S Q, Zheng M P, Jia X X, Lu C F, Liu J Q, Liu T S. 2005. Long-chain alkenone distributions and temperature dependence in lacustrine surface sediments from China., 69(21): 4985–5003.
Coolen M J L, Muyzer G, Rijpstra W I C, Schouten S, Volkman J K, Sinninghe Damsté J S. 2004. Combined DNA and lipid analyses of sediments reveal changes in Holocene haptophyte and diatom populations in an Antarctic lake., 223(1–2): 225–239.
Coolen M J L, Orsi W D, Balkema C, Quince C, Harris K, Slyva S P, Filipova-Marinova M, Giosan L. 2013. Evolution of the plankton paleome in the Black Sea from the Deglacial to Anthropocene., 110(21): 8609–8614.
Coolen M J L, Saenz J P, Giosan L, Trowbridge N Y, Dimitrov P, Dimitrov D, Eglinton T I. 2009. DNA and lipid molecularstratigraphic records of haptophyte succession in the Black Sea during the Holocene., 284(3–4): 610–621.
D’Andrea W J, Huang Y S. 2005. Long chain alkenones in Greenland lake sediments: Low δ13C values and exceptional abundance., 36(9): 1234–1241.
Dawson K S, Freeman K H, Macalady J L. 2012. Molecular characterization of core lipids from halophilic archaea grown under different salinity conditions., 48: 1–8.
Englebrecht A C, Sachs J P. 2005. Determination of sediment provenance at drift sites from hydrogen isotopes in lipids., 69(17): 4253–4265.
Feng D, Birgel D, Peckmann J, Roberts H H, Joye S B, Sassen R, Liu X L, Hinrichs K, Chen D F. 2014. Time integrated variation of sources of fluids and seepage dynamics archived in authigenic carbonates from Gulf of Mexico gas hydrate seafloor observatory., 385: 129–139.
Fujine K, Yamamoto M, Tada R, Kido Y. 2006. A salinity- related occurrence of a novel alkenone and alkenoate in Late Pleistocene sediments from the Japan Sea., 37(9): 1074–1084.
Gould J, Kienast M, Dowd M, Schefuß E. 2019. An open-ocean assessment of alkenone δD as a paleo-salinity proxy., 246: 478–497.
Günther F, Thiele A, Gleixner G, Xu B Q, Yao T D, Schouten S. 2014. Distribution of bacterial and archaeal ether lipids in soils and surface sediments of Tibetan lakes: Implications for GDGT-based proxies in saline high mountain lakes., 67: 19–30.
Häggi C, Chiessi C M, Schefuß E. 2015. Testing the D/H ratio of alkenones and palmitic acid as salinity proxies in the Amazon Plume., 12(23): 7239–7249.
Harada N, Shin K H, Murata A, Uchida M, Nakatani T. 2003. Characteristics of alkenones synthesized by a bloom ofin the Bering Sea., 67(8): 1507–1519.
Heinzelmann S M, Chivall D, M’Boule D, Sinke-Schoen D, Villanueva L, Sinninghe Damsté J S, Schouten S, van der Meer M T J. 2015. Comparison of the effect of salinity on the D/H ratio of fatty acids of heterotrophic and photoautotrophic microorganisms., 362(10): 1–6.
Hopmans E C, Weijers J W H, Schefuß E, Herfort L, SinningheDamsté J S, Schouten S. 2004. A novel proxy for terrestrial organic matter in sediments based on branched and isoprenoid tetraether lipids., 224(1–2): 107–116.
Horikawa K, Martin E E, Basak C, Onodera J, Seki O, Sakamoto T, Ikehara M, Sakai S, Kawamura K. 2015. Pliocene cooling enhanced by flow of low-salinity Bering Sea water to the Arctic Ocean., 6(7587): 1–9.
Huguet A, Grossi V, Belmahdi I, Fosse C, Derenne S. 2015. Archaeal and bacterial tetraether lipids in tropical pondswith contrasting salinity (Guadeloupe, French West Indies): Implications for tetraether-based environmental proxies., 83–84: 158–169.
Kaiser J, van der Meer M T J, Arz H W. 2017. Long-chain alkenones in Baltic Sea surface sediments: New insights., 112: 93–104.
Kandiano E S, van der Meer M T J, Schouten S, Fahl K, Sinninghe Damsté J S, Bauch H A. 2017. Response of the North Atlantic surface and intermediate ocean structure to climate warming of MIS 11., 7(46192): 1–9.
Kasper S, van der Meer M T J, Mets A, Zahn R, Sinninghe Damsté J S, Schouten S. 2014. Salinity changes in the Agulhas leakage area recorded by stable hydrogen isotopes of C37alkenones during TerminationⅠandⅡ., 10(1): 251–260.
Kates M. 1996. Structural analysis of phospholipids and glycolipids in extremely halophilic archaebacteria., 25(2): 113–128.
Kotthoff U, Groeneveld J, Ash J L, Fanget A, Krupinski N Q, Peyron O, Stepanova A, Warnock J, Helmond N A G M V, Passey B H, Clausen O R, Bennike O, Andrén E, Granoszewski, W, Andrén T, Filipsson H L, Seidenkrantz M, Slomp C P, Bauersachs T. 2017. Reconstructing Holocene temperature and salinity variations in the western Baltic Sea region: A multi-proxy comparison from the Little Belt (IODP Expedition 347, Site M0059)., 14(23): 5607–5632.
Krishnamurthy R V, Meyers P A, Lovan N A. 2000. Isotopic evidence of sea-surface freshening, enhanced productivity, and improved organic matter preservation during sapropel deposition in the Tyrrhenian Sea., 28(3): 263– 266.
Leduc G, Sachs J P, Kawka O E, Schneider R R. 2013. Holocenechanges in eastern equatorial Atlantic salinity as estimated by water isotopologues., 362: 151–362
Li J J, Pancost R D, Naafs B D A, Yang H, Zhao C, Xie S C. 2016. Distribution of glycerol dialkyl glycerol tetraether (GDGT) lipids in a hypersaline lake system., 99: 113–124.
Lichtenthaler H K. 1999. The 1-deoxy-D-xylulose-5-phosphate pathway for biosynthesis of isoprenoids., 50: 47–65.
Liu W G, Liu Z H, Fu M Y, An Z S. 2008. Distribution of the C37tetra-unsaturated alkenone in Lake Qinghai, China: A potential lake salinity indicator., 72(3): 988–997.
Liu W G, Liu Z H, Wang H Y, He Y X, Wang Z, Xu L M. 2011. Salinity control on long-chain alkenone distributions in lake surface waters and sediments of the northern Qinghai-Tibetan Plateau, China., 75(7): 1693–1703.
Liu Z H, Henderson A, Huang Y S. 2006. Alkenone-based reconstruction of late-Holocene surface temperature and salinity changes in Lake Qinghai, China., 33(13): 370–386.
Longo W M, Theroux S, Giblin A E, Zheng Y S, Dillon J T, HuangY S. 2016. Temperature calibration and phylogeneticallydistinct distributions for freshwater alkenones: Evidencefrom northern Alaskan lakes., 180: 177–196.
M’Boule D, Chivall D, Sinke-Schoen D, Sinninghe Damsté J S, Schouten S, van der Meer M T J. 2014. Salinity dependent hydrogen isotope fractionation in alkenones produced by coastal and open ocean haptophyte algae., 130: 126–135.
Maloney A E, Shinneman A L C, Hemeon K, Sachs J P. 2016. Exploring lipid2H/1H fractionation mechanisms in response to salinity with continuous cultures of the diatom.., 101: 154–165.
Martínez-Garcia A, Rosell-Melé A, Mcclymont E L, Gersonde R. 2010. Subpolar link to the emergence of the modern equatorial Pacific Cold Tongue., 328(5985): 1550–1553.
Méjanelle L, Sánchez-Gargallo A, Bentaleb I, Grimalt J O. 2003. Long chain n-alkyl diols, hydroxy ketones and sterols in a marine eustigmatophyte,, and in Brachionus plicatilis feeding on the algae., 34(4): 527–538.
Nakamura H, Sawada K, Araie H, Suzuki I, Shiraiwa Y. 2014. Long chain alkenes, alkenones and alkenoates produced by the haptophyte algaCCMP1307 isolated from a salt marsh., 66: 90–97.
Natalicchio M, Birgel D, Peckmann J, Lozar F, Carnevale G, Liu X L, Hinrichs K, Pierre F D. 2017. An archaeal biomarker record of paleoenvironmental change across the onset of the Messinian salinity crisis in the absence of evaporites (Piedmont Basin, Italy)., 113: 242–253.
Nelson D B, Sachs J P. 2014a. The influence of salinity on D/H fractionation in alkenones from saline and hypersalinelakes in continental North America., 66: 38–47.
Nelson D B, Sachs J P. 2014b. The influence of salinity on D/H fractionation in dinosterol and brassicasterol from globally distributed saline and hypersaline lakes., 133: 325–339.
Ono M, Sawada K, Kubota M, Shiraiwa Y. 2009. Change of the unsaturation degree of alkenone and alkenoate during acclimation to salinity change in Emiliania huxleyi and Gephyrocapsa oceanica with reference to palaeosalinity indicator., 25: 53–60.
Oren A. 2002. Molecular ecology of extremely halophilic archaea and bacteria., 39(1): 1–7.
Pahnke K, Sachs J P, Keigwin L, Timmermann A, Xie S P. 2007. Eastern tropical Pacific hydrologic changes during the past 27,000 years from D/H ratios in alkenones., 22(4): 1–15.
Pearson E J, Juggins S, Farrimond P. 2008. Distribution and significance of long-chain alkenones as salinity and temperature indicators in Spanish saline lake sediments., 72(16): 4035–4046.
Pinturier-Geiss L, Méjanelle L, Dale B, Karsen D A. 2002. Lipids as indicators of eutrophication in marine coastal sediments., 48(2–3): 239–257.
Prahl F G, Wakeham S G. 1987. Calibration of unsaturation patternsin long-chain ketone compositions for palaeotemperatureassessment., 330(6146): 367–369.
Rampen S W, Willmott V, Kim J H, Uliana E, Mollenhauer G, Schefuß E, Sinninghe Damsté J S, Schouten S. 2012. Long chain 1,13- and 1,15-diols as a potential proxy for palaeotemperature reconstruction., 84: 204–216.
Rohling E J. 2007. Progress in paleosalinity: Overview and presentation of a new approach., 22(3): 1–9.
Rosell-Melé A. 1998. Interhemispheric appraisal of the value of alkenone indices as temperature and salinity proxies in high-latitude locations., 13(6): 694–703.
Rosell-Melé A, Jansen E, Weinelt M. 2002. Appraisal of a molecular approach to infer variations in surface ocean freshwater inputs into the North Atlantic during the last glacial., 34(3–4): 143–152.
Sachs J P, Kawka O E. 2015. The influence of growth rate on2H/1H fractionation in continuous cultures of the coccolithophoridand the diatom., 10(11): 1–27.
Sachs J P, Maloney A E, Gregersen J. 2017. Effect of light on2H/1H fractionation in lipids from continuous cultures of the diatom., 209: 204–215.
Sachs J P, Maloney A E, Gregersen J, Paschall C. 2016. Effect of salinity on2H/1H fractionation in lipids from continuous cultures of the coccolithophorid., 189: 96–109.
Sachs J P, Schwab V F. 2011. Hydrogen isotopes in dinosterol from the Chesapeake Bay estuary., 75(2): 444–459.
Sachs J P, Stein R, Maloney A E, Wolhowe M, Fahl K, Nam S. 2018. An Arctic Ocean paleosalinity proxy from δ2H of palmitic acid provides evidence for deglacial Mackenzie River flood events., 198: 76–90.
Sachse D, Sachs J P. 2008. Inverse relationship between D/H fractionation in cyanobacterial lipids and salinity in Christmas Island saline ponds., 72(3): 793–806.
Sauer P E, Eglinton T I, Hayes J M, Schimmelmann A, Sessions A L. 2001. Compound-specific D/H ratios of lipid biomarkers from sediments as a proxy for environmental and climatic conditions., 65(2): 213–222.
Schmidt H L, Werner R A, Eisenreich W. 2003. Systematics of2H patterns in natural compounds and its importance for the elucidation of biosynthetic pathways., 2(1): 61–85.
Schouten S, Hopmans E C, Schefuß E, Sinninghe Damsté J S. 2002. Distributional variations in marine crenarchaeotal membrane lipids: A new tool for reconstructing ancient sea water temperatures?, 204(1–2): 265–274.
Schouten S, Hopmans E C, Sinninghe Damsté J S. 2013. The Organic Geochemistry of glycerol dialkyl glycerol tetraether lipids: A review., 54: 19–61.
Schouten S, Ossebaar J, Schreiber K, Kienhuis M V K, Langer G, Bijma J. 2005. The effect of temperature and salinity on the stable hydrogen isotopic composition of long chainalkenones produced byand Gephyrocapsa oceanica., 2(6): 1681–1695.
Schwab V F, Sachs J P. 2009. The measurement of D/H ratio in alkenones and their isotopic heterogeneity., 40(1): 111–118.
Schwab V F, Sachs J P. 2011. Hydrogen isotopes in individualalkenones from the Chesapeake Bay estuary., 75(23): 7552–7565.
Seki O, Kawamura K, Sakamoto T, Ikehara M, Nakatsuka T, Wakatsuchi M. 2005. Decreased surface salinity in the Sea of Okhotsk during the last glacial period estimated from alkenones., 32(8): 1–4.
Sessions A L, Burgoyne T W, Schimmelmann A, Hayes J M. 1999. Fractionation of hydrogen isotopes in lipid biosynthesis., 30(9): 1193–1200.
Sicre M A, Bard E, Ezat U, Rostek F. 2002. Alkenone distributions in the North Atlantic and Nordic sea surface waters., 3(2): 1–13.
Sikes E L, Sicre M A. 2002. Relationship of the tetra-unsaturated C37alkenone to salinity and temperature: Implications for paleoproxy applications., 3(11): 1–11.
Simon M H, Gong X, Hall I R, Ziegler M, Barker S, Knorr G, van der Meer M T J, Kasper S, Schouten S. 2015. Salt exchange in the Indian-Atlantic Ocean Gateway since the Last Glacial Maximum: A compensating effect between Agulhas Current changes and salinity variations?, 30(10): 1318–1327.
Song M, Zhou A F, He Y X, Zhao C, Wu J L, Zhao Y, Liu W G, Liu Z H. 2016. Environmental controls on long-chain alkenone occurrence and compositional patterns in lacustrine sediments, northwestern China., 91: 43–53.
Toney J L, Huang Y S, Fritz S C, Baker P A, Grimm E, Nyren P. 2010. Climatic and environmental controls on the occurrence and distributions of long chain alkenones in lakes of the interior United States., 74(5): 1563–1578.
Turich C, Freeman K H. 2012. Archaeal lipids record paleosalinity in hypersaline systems., 42(9): 1147–1157.
Van der Meer M T J, Baas M, Rijpstra W I C, Marino G, Rohling E J, Sinninghe Damsté J S, Schouten S. 2007. Hydrogen isotopic compositions of long-chain alkenonesrecord freshwater flooding of the Eastern Mediterranean at the onset of sapropel deposition., 262(3–4): 594–600.
Van der Meer M T J, Benthien A, Bijma J, Schouten S, Sinninghe Damsté J S. 2013. Alkenone distribution impacts the hydrogen isotopic composition of the C37:2and C37:3alkan-2-ones in., 111: 162–166.
Van der Meer M T J, Benthien A, French K L, Epping E, Zondervan I, Reichart G, Bijma J, Sinninghe Damsté J S, Schouten S. 2015. Large effect of irradiance on hydrogen isotope fractionation of alkenones in., 160: 16–24.
Van Soelen E E, Lammers J M, Eglinton T I, Sinninghe Damsté J S, Reichart G J. 2014. Unusual C35to C38alkenones in mid-Holocene sediments from a restricted estuary (Charlotte Harbor, Florida)., 70: 20–28.
Versteegh G J M, Bosch H J, Leewu J W D. 1997. Potential palaeoenvironmental information of C24to C36mid-chain diols, keto-ols and mid-chain hydroxy fatty acids; A critical review., 27(1): 1–13.
Versteegh G J M, Jansen J H F, Leewu J W D, 2000. SchneiderR R. Mid-chain diols and keto-ols in se atlantic sediments: A new tool for tracing past sea surface water masses?, 64(11): 1879–1892.
Volkman J K, Barrett S M, Blackburn S I, Sikes E L. 1995. Alkenones in: Implications for studies of paleoclimate., 59(3): 513–520.
Volkman J K, Barrett S M, Dunstan G A, Jeffrey S W. 1992. C30-C32alkyl diols and unsaturated alcohols in microalgae of the class Eustigmatophyceae., 18(1): 131–138.
Volkman J K, Burton H R, Everitt D A, Allen D I. 1988. Pigment and lipid compositions of algal and bacterial communities in Ace Lake, Vestfold Hills, Antarctica., 165: 41–57.
Volkman J K, Eglinton G, Corner E D S, Forsberg T E V. 1980. Long-chain alkenes and alkenones in the marine coccolithophorid., 19(12): 2619–2622.
Wang H Y, Dong H L, Zhang C L, Jiang H C, Liu Z H, Zhao M X, Liu W G. 2015. Deglacial and holocene archaeal lipid-inferred paleohydrology and paleotemperature history of Lake Qinghai, northeastern Qinghai–Tibetan Plateau., 83(1): 116–126.
Wang H Y, Liu W G, Zhang C L, Jiang H C, Dong H L, Lu H X, Wang J X. 2013. Assessing the ratio of archaeol to caldarchaeol as a salinity proxy in highland lakes on the northeastern Qinghai–Tibetan Plateau., 54: 69–77.
Warden L, van der Meer M T J, Moros M, Sinninghe Damsté J S. 2016. Sedimentary alkenone distributions reflect salinity changes in the Baltic Sea over the Holocene., 102: 30–44.
Weijers J W H, Panoto E, Bleijswijk J V, Schouten S, Rijpstra W I C, Balk M, Stams A J M, Sinninghe Damsté J S. 2009. Constraints on the biological source(s) of the orphan branched tetraether membrane lipids., 26(6): 402–414.
Weiss G M, Pfannerstill E Y, Schouten S, Sinninghe Damsté J S, van der Meer M T J. 2017. Effects of alkalinity and salinity at low and high light intensity on hydrogen isotope fractionation of long-chain alkenones produced by., 14(24): 5693–5704.
Wolhowe M D, Prahl F G, Probert I, Maldonado M. 2009. Growth phase dependent hydrogen isotopic fractionation in alkenone-producing haptophytes., 6(8): 1681–1694.
Xu L, Reddy C M, Farrington J W, Frysinger G S, Gaines R B, Johnson C G, Nelson R K, Eglinton T I. 2001. Identification of a novel alkenone in Black Sea sediments., 2001, 32(5): 633–645.
Yakir D, Deniro M J. 1990. Oxygen and hydrogen isotope fractionation during cellulose metabolism inL., 93(1): 325–332.
Zhang X N, Gillespie A L, Sessions A L. 2009. Large D/H variations in bacterial lipids reflect central metabolic pathways., 106(31): 12580–12586.
Zhang Z H, Sachs J P. 2007. Hydrogen isotope fractionation in freshwater algae: I. Variations among lipids and species., 38(4): 582–608.
Zhang Z H, Sachs J P, Marchetti A. 2009. Hydrogen isotope fractionation in freshwater and marine algae: II. Temperature and nitrogen limited growth rate effects., 40(3): 428–439.
Zheng Y S, Dillon J T, Zhang Y F, Huang Y S. 2016. Discovery of alkenones with variable methylene-interrupteddouble bonds: Implications for the biosynthetic pathway., 52(6): 1037–1050.
Progress in paleosalinity reconstruction: A review of biomarker approaches
LIANG Dong, LI Li*, HE Juan, JIA Guodong
(State Key Laboratory of Marine Geology, Tongji University, Shanghai 200092, China)
The reconstruction of salinity in oceans and lakes has long been a topic of sustained interest in paleoceanography. For a long time now, inorganic geochemical parameters, applied as paleosalinity indicators, are being developed, whereas organic geochemistry approaches can provide alternative tools and new insights. Over the past decades, long chain alkenone-based(C37:4), archaeal GDGT based ACE, long chain diols-based Diol Index, and hydrogen isotopes of lipid biomarkers have been developed through several culture experiments and field investigations. However, their applications are still often restricted in certain regions, given the complexity of producers and precursors of biomarkers and influence of environmental factors other than salinity. In this study, we reviewed the development and calibration of these proxies and discussed the limitation of their applications.
salinity; biomarkers; hydrogen isotope
P593
A
0379-1726(2022)03-0316-17
10.19700/j.0379-1726.2020.04.008
2019-11-21;
2020-02-02
国家重点研发计划(2018YFE0202402)和国家自然科学基金(41673042, 41876042, 41776049)联合资助。
梁栋(1995–), 男, 硕士研究生, 海洋科学专业。E-mail: don0209@tongji.edu.cn
李丽(1974–), 女, 教授, 主要从事有机地球化学研究。E-mail: lilitju@tongji.edu.cn
