减瘤手术结合腹腔高温化疗对胃癌伴发腹腔转移患者的治疗效果及对HS-mGPS 评分的影响
2022-07-05周博
周博
(河南科技大学临床医学院河南科技大学第一附属医院胃肠肿瘤外科,洛阳 471000)
胃癌在我国恶性肿瘤的发病率中居首位,主要以腺癌为主。 早期胃癌症状不明显,中晚期胃癌会伴随明显的上消化道症状,如食欲下降、上腹疼痛等[1]。 晚期胃癌常伴随腹腔转移,对于晚期胃癌伴随腹腔转移临床中多采用全身化疗为主[2]。 有报道称, 采用减瘤手术联合高温化疗能够改善患者临床症状[3]。 为探索减瘤手术结合腹腔高温化疗对胃癌伴发腹腔转移胃癌的治疗效果, 我院对部分患者进行临床对比研究,现报道如下。
1 资料与方法
1.1 一般资料 将我院2018 年6 月至2019 年6月收治的98 例晚期胃癌伴腹膜转移的患者作为研究对象。 将患者按随机数字表法分为观察组和对照组,每组各49 例。 两组一般资料相比,差异无统计学意义(P>0.05)。本次研究经我院医学伦理委员会批准。 见表1。
表1 两组一般资料比较(±s)
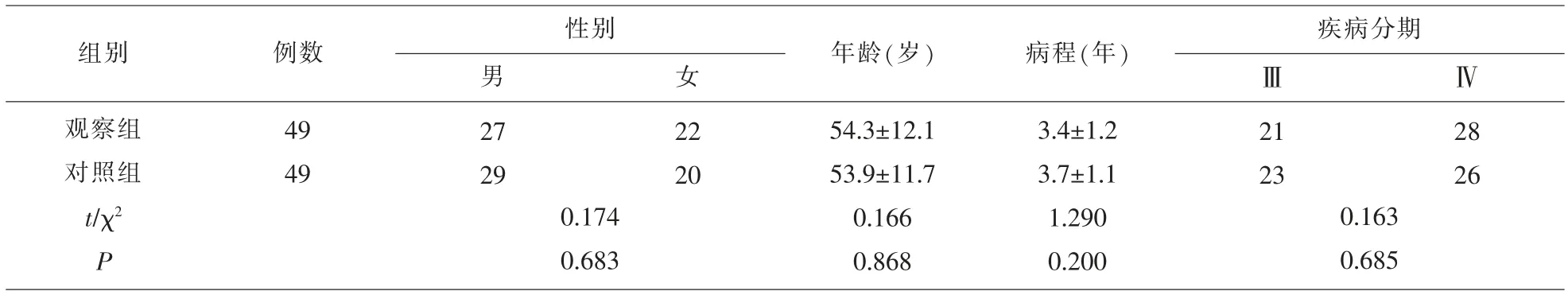
表1 两组一般资料比较(±s)
例数性别男组别 年龄(岁) 病程(年)女疾病分期ⅢⅣ观察组对照组t/χ2 P 49 49 27 29 0.174 0.683 22 20 54.3±12.1 53.9±11.7 0.166 0.868 3.4±1.2 3.7±1.1 1.290 0.200 21 23 0.163 0.685 28 26
1.2 纳入及排除标准 纳入标准:患者符合《胃癌规范化诊疗指南(试行)》中原发性胃癌诊断标准[4];患者胃癌分期为Ⅲ-Ⅳ期;患者伴随腹膜转移;患者对本次治疗方案知情同意。 排除标准:患者预计生存期不足1 年;患者合并肝、肺、骨等远处转移;患者生命体征稳定,能够耐受手术治疗和热疗。
1.3 方法 对照组,紫杉醇注射液(批准文号:国药准字H20066558,生产单位:海南紫杉园制药有限公司)80 mg/(m2·d)静脉滴注d1、d8 给药一次,卡培他滨(批准文号:国药准字H20073023,生产单位:上海罗氏制药有限公司)2000 mg/(m2·d) 分2 次口服,1~14 d 持续服用。 每21 d 为一个化疗周期。 观察组,手术治疗:患者采用全身麻醉,做上腹正中切口。充分暴露胃及周围组织,切除网膜囊,结扎并且断网膜右动脉。清扫周围淋巴结,切断十二指肠,切除胃体。进行食管空肠吻合重建消化道。 热灌注化疗, 化疗药物为洛铂 (批准文号: 国药准字H20050308,生产单位:海南长安国际制药有限公司)100 mg, 多西他赛 (批准文号: 国药准字H20060127, 生产单位: 深圳万乐药业有限公司)120 mg,加入6000 mL 生理盐水,并加热至42 ℃,采用斐讯换腹腔热灌注进行灌注化疗,速度为每分钟100 mL,1 h 内完成灌注化疗。 热灌注化疗后关闭腹腔。 患者术后2 周接收常规术后化疗,化疗方案同对照组。
1.4 观察指标 根据实体瘤疗效评价标准,对患者治疗2 个化疗周期后治疗效果进行评估,治疗效果分为完全缓解(CR)、 部分缓解(PR)、 病情稳定(SD)、疾病进展(PD)。 疾病控制率=(CR+PR+SD)/患者总数×100.0%。 记录患者治疗后死亡情况,计算中位生存时间(MST)。计算两组患者治疗1 年总生存率(OS)。 分别于治疗前及两个化疗周期后采集两组患者空腹静脉血, 检测患者血清C 反应蛋白(CRP)和血清白蛋白(ALB)水平,根 据CRP、ALB 水平评估患者高敏感格拉斯哥评分 (HSmGPS):CRP≥10 mg/L,ALB <35 g/L 记 为2 分,CRP≥10 mg/L 记为ALB≥35g/L 记为1 分,CRP<10 mg/L,ALB>35 g/L 记为0 分。
1.5 不良反应 参照《常见不良反应时间评价标准(CTCAE)》 对患者化疗期间不良反应发生情况进行记录[5]。
1.6 统计学方法 所有数据均采用SPSS 20.0 统计软件分析,以[n(%)]表示计数资料,组间对比分析采用χ2进行;通过(±s)表示计量资料,所有数据均符合正态分布,组间对比分析采用方差分析进行,组间两两比较采用t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组近期治疗效果比较 观察组疾病控制率为75.5%,对照组疾病控制率为59.2%,两组相比,观察组疾病控制率显著高于对照组, 差异具有统计学意义(P<0.05)。 见表2。
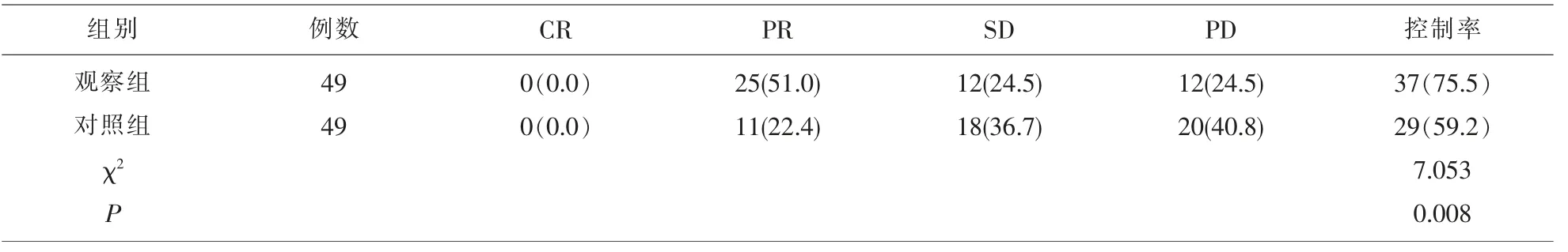
表2 两组患者近期治疗效果比较[例(%)]
2.2 两组患者生存分析 对两组患者入院后12 个月内生存状况进行随访, 观察组患者中位生存时间(15.35±1.26)个月,对照组患者中位生存时间(12.45±1.45)个月。 两组相比,观察组中位生存时间较对照组长(t=10.568,P=0.000)。 观察组患者1年生存率为89.9%(44/49),对照组为63.3%(31/49),观察组一年生存率高于对照组(χ2=9.603,P=0.002)两组患者生存曲线见图1。
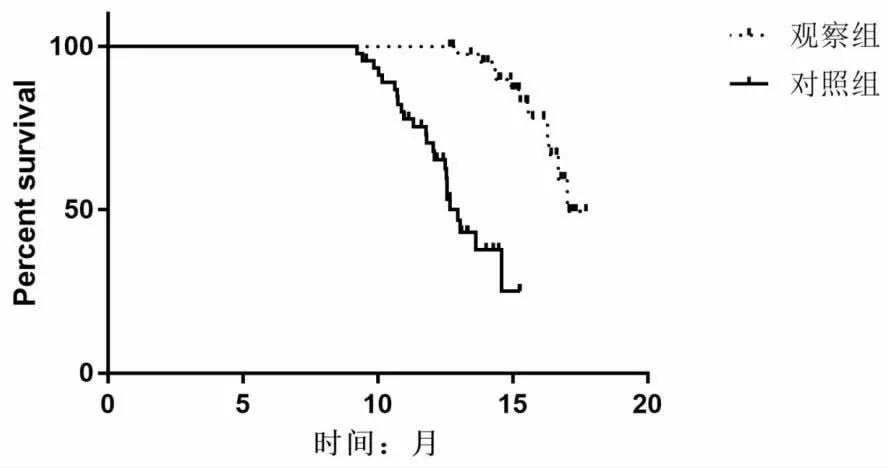
图1 两组患者生存曲线
2.3 两组患者治疗前后HS-mGPS 评分比较 两组患者治疗前HS-mGPS 评分相比,差异无统计学意义(P>0.05);治疗后两组患者HS-mGPS 较治疗前均明显降低,差异有统计学意义(P<0.05);治疗后观察组HS-mGPS 评分低于对照组,差异有统计学意义(P<0.05)。 见表3。
表3 两组患者治疗前后HS-mGPS 评分比较(±s)

表3 两组患者治疗前后HS-mGPS 评分比较(±s)
组别 例数 治疗前 治疗后 t P观察组对照组49 49 39.729 20.533 0.000 0.000 t P 1.87±0.11 1.86±0.12 0.430 0.668 1.13±0.07 1.42±0.09 17.804 0.000
2.4 两组患者化疗期间不良反应比较 两组治疗期间不良反应发生情况相比, 差异无统计学意义(P>0.05)。 见表4。

表4 两组不良反应发生情况比较
3 讨论
腹膜转移是胃癌晚期常见并发症, 其主要指胃癌肿瘤细胞经血液、 淋巴液等循环或以直接种植的方式转移至腹腔内。 胃癌腹膜转移发病率高,患者会伴随腹水,预后较差[6]。 目前,治疗胃癌晚期伴腹膜转移主要以化疗为主, 但是由于腹腔内腹膜的阻隔作用, 大分子药物很难透过腹膜进入肿瘤组织, 因此腹腔内很难维持化疗药物的浓度导致化疗效果欠佳[7]。 有报道称[8],采用热灌注化疗能够提高肿瘤化疗效果,改善预后。 本次研究中,对照组患者采用常规静脉注射化疗药物进行治疗,观察组患者进行减瘤手术联合腹腔热灌注化疗进行治疗。 两组治疗效果比较,观察组疾病控制率为75.5%,对照组疾病控制率为59.2%,观察组近期治疗效果优于对照组(P<0.05)。说明减瘤手术联合腹腔热灌注化疗能够能够提高患者近期治疗效果。根据张则才等研究[9],采用肿瘤细胞减灭术联合腹腔热灌注化疗能够提高胃癌伴腹膜转移治疗效果,研究结果与本次结果相似。
热灌注化疗是通过将化疗药物加热后进行局部灌注化疗的治疗方法。 一方面由于肿瘤组织对热力耐受较低,正常组织对热力耐受较高,因此热灌注化疗能够以热力作用杀灭部分肿瘤细胞[10]。另一方面,热灌注化疗能够促进腹腔内血管舒张,增加腹膜通透性, 促进化疗药物透过腹腔进入肿瘤组织内。 减瘤手术是将无法行根治术的肿瘤进行部分切除,以减轻患者肿瘤负荷[11]。 对两组患者治疗后1 年生存状况进行随访, 结果显示观察组中位中位生存时间、1 年生存率等均高于对照组。 表明采用减瘤手术联合腹腔热灌注能够提高患者生存期。 联合治疗能够提高患者生存期一方面是因为减瘤手术切除大部分肿瘤组织[12];另一方面联合热化疗后提高对残余肿瘤组织的杀灭效果, 能够延缓肿瘤细胞的生长,从而延长患者生存期[13]。
高敏改良格拉斯哥预后评分(HS-mGPS)是在格拉斯哥预后评分基础上进行调整的一种评估患者机体营养状况、 炎症反应及反应患者预后的重要指标[14]。 HS-mGPS 中CRP 主要反应患者炎症水平, 肿瘤患者由于肿瘤组织刺激导致CRP 升高,CRP 能够促进补体系统激活促进炎症反应[15]。白蛋白主要是维持血液渗透压, 维持机体营养的重要物质[16]。 本次研究中,两组患者治疗前HS-mGPS评分相比,差异无统计学意义(P>0.05),治疗后观察组患者HS-mGPS 评分显著低于对照组 (P<0.05)。结果说明,采用减瘤手术联合热灌注治疗能够降低患者炎症反应提高患者营养水平, 利于患者改善预后。 其主要原因一方面是由于采用减瘤手术降低肿瘤负荷, 减少肿瘤组织对机体的刺激作用, 另一方面是由于采用热灌注化疗杀灭残留肿瘤细胞[17]。联合应用能够降低肿瘤细胞引起的炎症反应,减少肿瘤对机体的消耗作用,因此能够提高患者HS-mGPS 评分。
本次研究还对两组患者治疗期间不良反应发生情况进行监测, 结果显示两组不良反应主要以白细胞减少,恶心、呕吐、血小板减少,腹泻等为主,两组间相比差异无统计学意义。 由于本次研究样本量较少,且容易受到地域因素影响,因此本次结果可能具有一定局限性。
综上所述, 采用减瘤手术联合腹腔高温化疗能够明显降低胃癌腹膜转移患者术后HS-mGPS评分,有利于改善患者预后,增加患者生存期。
