LncRNA MALAT1 沉默对人肾透明癌细胞786-O 的生物学影响
2022-07-05宫再兴徐庆刚
宫再兴,徐庆刚
(江西中医药大学附属医院泌尿外科,南昌 330006)
肾透明细胞癌 (Renal Cell Carcinoma, RCC),是泌尿系统常见恶性肿瘤之一, 来源于肾实质泌尿小管上皮系统, 发病率仅次于前列腺癌和膀胱癌[1]。 目前肾癌的病因尚不明确, 可能与遗传、吸烟、肥胖、高血压及抗高血压治疗等因素有关,促使研究者从各个层面研究探讨, 寻求新的治疗策略。 长链非编码RNA(lncRNA)是一类长度大于200 nt 的不能编码蛋白质的RNA 分子, 但是可以从多个层面调控蛋白质的编码基因的表达水平[2]。近年来, 各国学者对lncRNA 的研究不断深入,发现并证实多个lncRNA 的异常表达与恶性肿瘤息息相关[3]。 肺腺癌转移相关转录本1(metastasisassociatedlungadenocarcinomatranscript1,MALAT1)是一个高度保守和丰度的lncRNA,位于人类染色体11q13.1 上,主序列包括了8000 多个核苷酸,广泛分布于人体各组织器官中, 通过多种方式在表观遗传学水平上引起肿瘤细胞的恶性增殖, 侵袭能力上升,凋亡减弱,进而影响肿瘤患者的病情进展及后期药物的治疗效果等。 我们通过干涉非编码RNA MALAT1 的表达,研究对人肾透明细胞癌细胞786-O 的影响, 为肾细胞癌的诊疗提供新的策略。
1 实验材料与方法
1.1 材料 人肾透明细胞癌细胞786-O 细胞由中国科学院(上海)细胞类型培养研究所购得,shRNA由上海依祥生物技术有限公司合成,TRIZOL 试剂购自北京全式金生物技术有限公司,MALAT1 引物、Lipofectamine 2000 reagent 均 购 自 美 国Invitrogen 公 司,qPCR 试 剂 盒 购 自TaKaRa 公 司,RPMI 1640 培养基、牛血清白蛋白(Albumin Bovine V) 均购自美国Gibco 公司,ABI7900 型Realtime-PCR 仪购自美国ABI 公司,CCK-8 Cell Counting Kit 购自诺唯赞生物, 全自动板式酶标仪购自奥地利TECAN 公司,24 孔板用细胞培养池(透明PET膜8.0 μm) 购自美国Corning 公司,PRIMER IPAGE 11-59 BP、FACSCalibur 流式细胞仪购自BD 公司,Annexin V/PI apoptosis kit 购自联科生物。
1.2 方法
1.2.1 转染 实验分三组:实验组(shRNA-MALAT1组)、阴性对照组(shRNA-NC 组)、正常培养组。 用胰蛋白酶消化细胞后并计数,将细胞以1×105/孔接种在六孔板上, 加入2 mL 含FBS 的细胞培养基,放入恒温培养箱中, 当培养的细胞数量≥80%时,按脂质体转染试剂盒LipofectamineTM 2000 说明书依次转染,每组平行3 孔,用荧光显微镜观察转染效率,便于后续试验。
1.2.2 qPCR 检测各组MALAT1 基因的表达 转染36 h 后提取RNA, 逆转录为cDNA,MALAT1 引物为5′-TGCAGCCCGAGACTTCTGT -3′,5′-GCTTC TGCGTTGCTAAAATGG-3′。 GAPDH 引 物 为5′-GGTGGTCTCCTCTGACTTCAACA-3′,5′-GTGGTC GTTGAGGGCAATG-3′。 进行qPCR,95 ℃预变性30 s 后,进入40 个循环:95 ℃10 s; 60 ℃30 s。
1.2.3 CCK8 检测各组细胞生长情况 转染后的各组细胞培养至对数期, 用胰蛋白酶消化成单细胞悬液,接种到96 孔板(每组设定5 个复孔),放置细胞培养箱中培养,分别于接种后0 h、24 h、48 h、72 h 加入10 μL CCK-8 溶液,继续37 ℃孵育2 h,450 nm 波长下利用酶标仪测定各孔板各组细胞的吸光值。
1.2.4 Trsanwell 小室检测各组细胞侵袭能力 用胰蛋白酶将各组细胞消化成单细胞悬液, 收集各组细胞,调整细胞密度至1~10×105个/mL,用移液枪吸取100 μL, 接种于预先铺胶4℃过夜的Transwell 上室, 加入500 μL 含趋化因子的培养基,放入细胞培养箱中常规培养48h,用棉签小心擦去上室内的细胞,4%多聚甲醛固定5 分钟后用PBS 反复淋洗,再4 g/L 的结晶紫溶液染色。 在倒置显微镜下每个样本随机取5 个单独视野并计数拍照。
1.2.5 流式细胞术检测各组细胞凋亡情况 用不含EDTA 的胰蛋白酶将各组细胞消化成单细胞悬浮液, 并用预冷的PBS 洗涤。 先后加入100 μL 1 Binding Buffer 重悬细胞、5 μL Annexin V- FITC、10 μL PI 轻轻混匀,避光、室温反应5 min。 流式细胞仪检测细胞凋亡。
1.2.6 数据统计分析 使用SPSS 26.0 对实验结果进行统计学数据分析,计量资料以(±s)表示,任意两组间的数据分析使用t 检验,三组间数据分析使用单因素方差分析,P<0.05 提示组间数据差异具有统计学意义。
2 结果
2.1 转染效率检测 用荧光显微镜观察转染效率(图1A,1B), 转染成功标准为细胞体内有绿色荧光出现,且荧光细胞占比大于80%,转染48 h 后用于后续实验。
图1 B 阴性空转组(shRNA-NC 组)转染后
图1 A 实验组(shRNA-MALAT1 组)转染后
2.2 各组MALAT1 基因的qPCR 检测 采用实时荧光定量PCR 技术检测实验组、阴性对照组、正常培养组肾透明细胞癌786-O 细胞中MALAT1 的表达量情况, 结果显示, 实验组MALAT1 表达水平(0.326±0.049)明显低于阴性对照组(1.006±0.194)和正常培养组(0.982±0.161),差异有统计学意义(P<0.05,图2)。提示沉默lncRNA MALAT1 效果显著。
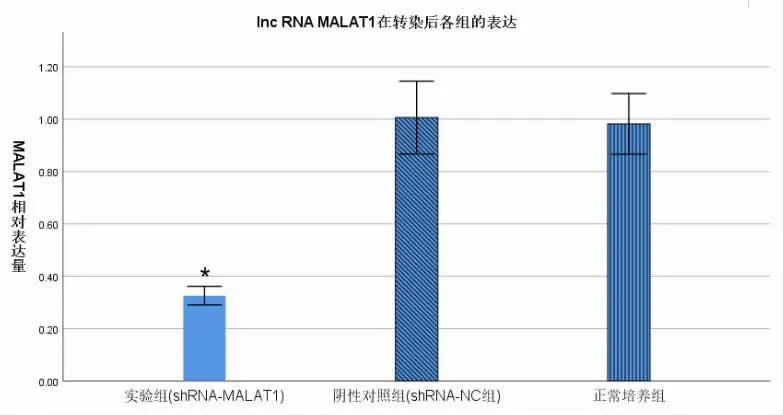
图2 MALAT1 在各组肾透明细胞癌细胞786-O 中的相对表达量(*P<0.05)
2.3 沉默lncRNA MALAT1 的表达对各组癌细胞增殖的影响 采用CCK8 法检测实验组、阴性对照组、 正常培养组肾透明细胞癌细胞786-O 的增殖情况分别为(1.710±0.081),(1.977±0.292),(2.003±0.277),并绘制细胞生长曲线,见图3。 与正常培养组和阴性对照组相比, 实验组癌细胞增殖细胞活性明显降低,差异有统计学意义(P<0.05),提示沉默lncRNA MALAT1 的表达能够明显抑制肾透明细胞癌细胞786-O 的增殖。
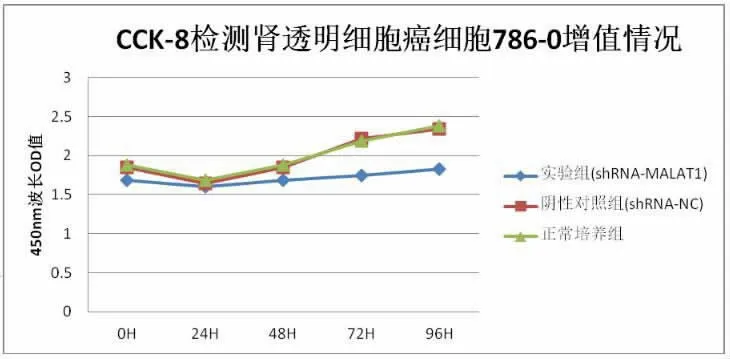
图3 CCK8 检测各组肾透明细胞癌细胞786-O 增殖情况曲线图(*P<0.05)
2.4 沉默lncRNA MALAT1 表达对各组癌细胞侵袭能力的影响 采用Trsanswell 侵袭实验检测实验组、 阴性对照组、 正常培养组肾透明细胞癌细胞786-O 的穿透Matrigel 胶转移到Trsanswell 膜背面的细胞数,与正常培养组(110.40±7.925)和阴性对照组(106.40±4.722)相比,实验组(54.40±7.403)侵袭细胞个数明显降低(图4),差异具有统计学意义(P<0.05),而与正常培养组相比,阴性对照组侵袭细胞数量无明显差异(P>0.05,图5)。 提示沉默lncRNA MALAT1 的表达能够明显降低肾透明细胞癌细胞786-O 的侵袭能力。
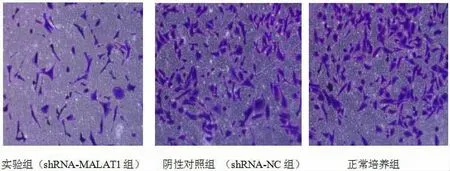
图4 Trsanwell 侵袭实验检测各组肾透明细胞癌细胞数量(400 倍)

图5 Trsanswell 侵袭实验检测各组肾透明细胞癌细胞数量柱状图(*P<0.05)
2.5 沉默lncRNA MALAT1 表达对各组癌细胞凋亡的影响 采用流式细胞术检测实验组、阴性对照组、 正常培养组肾透明细胞癌细胞786-O 的平均凋亡率,与正常培养组(22.456±2.443)%和阴性对照组(21.586±2.285)%相比,实验组的癌细胞凋亡率(80.158±6.181)%明显增高,差异具有统计学意义(P<0.05,图6),而阴性对照组细胞凋亡与正常培养组细胞凋亡无明显差异(P>0.05,图7)。 提示干涉lncRNA MALAT1 的表达能够明显增加肾透明细胞癌细胞786-O 的凋亡。
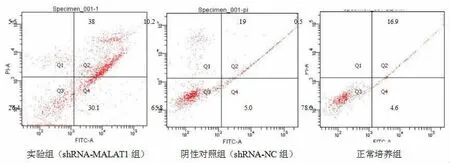
图6 各组流式细胞细胞检测图
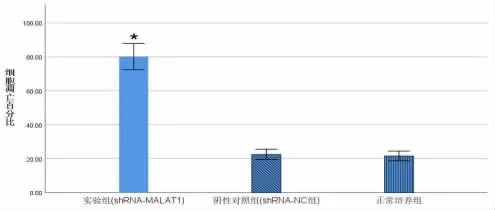
图7 流式细胞仪检测各组肾透明细胞癌细胞凋亡柱状图(*P<0.05)
3 讨论
RCC 作为致死率最高的泌尿系统恶性肿瘤,每年全世界约有40.3 万新发病例[4],尽管早期肾癌可以通过手术治疗达到临床治愈, 但是仍有约35%患者表现为晚期或转移性RCC。 伴随高通量测序与生物信息分析技术的飞速发展, 促进我们从遗传学的角度认识和探究RCC 的诊治, 越来越多的研究证明,lncRNA 在RCC 的发生、 发展和预后中扮演重要的角色[5]。
Ji P[6]等在2003 年预测早期非小细胞肺癌的转移时首次发现肺腺癌转移相关转录本1(MALAT1),在其超保守的3' 端存在一个tRNA 样三叶草的二级结构, 可以被核糖核酸酶P 和Z 识别与切割, 生成近3' 端的短RNA 和两种RNAMALAT1, 剩余的3' 端与RNase Z 结合并剪切,生成一个长度为61nt 的成熟tRNA 样转录本转移至细胞质[7]。多项实验研究证明MALAT1 通过调控选择性剪接、 基因转录、 细胞周期以及充当miRNA的海绵等方式参与恶性肿瘤的发生、发展、转移和预后。
我们通过构建shRNA 载体,沉默非编码RNA MALAT1 在肾透明细胞癌细胞786-O 中的表达,结果发现,下调MALAT1 基因的表达后,肾透明细胞癌细胞786-O 的细胞增殖降低,侵袭能力下降,细胞凋亡增加,提示lncRNA MALAT1 的过表达可能是导致肾透明细胞癌的发生、 发展和转移的重要原因,查阅相关文献,推测MALAT1 可能通过改变mRNAs 前体的选择性剪接[8];或通过与起始复合体(PRC2)结合,阻止组蛋白甲基化转移酶(EZH2)与HIV-1 长末端重复(LTR)启动子结合,使PRC2所介导的组蛋白无法甲基化[9];或通过诱导三甲基化的组蛋白3 赖氨酸(H3K9)合成增多[10],从而达到抑制靶基因的表达,诱发恶性肿瘤的生成。 提示敲除或沉默非编码基因MALAT1 对肿瘤的发生、发展有着明显的抑制作用。 同时MALAT1 可以竞争性地结合miRNA, 使miRNA 与靶基因的结合减少[11], 而上调MALAT1 的表达可以使得miR-101减少,可以促进癌细胞增殖并减少癌细胞凋亡率[12]。提示敲除非编码基因MALAT1 可能抑制肿瘤的转移和侵袭,改善患者预后。
综上所述,通过沉默lncRNA MALAT1 表达能够抑制癌细胞增殖,降低侵袭,增加凋亡。 其作用机制可能涉及P13K/Akt 信号通路和EZH2/βcatenin 信号通路,以及相关蛋白的表达,在后续的动物实验中将进一步探讨lncRNA MALAT1 在肾细胞癌中的机制研究, 为临床上肾透明细胞癌的诊疗提供新的思路。
