腐植酸促进候选细菌丰富植物微生物群以抑制病原体
2022-07-05MauraSantosReisdeAndradedaSilvaOrlandoCarlosHuertasTavaresThiagoGonalvesRibeiroCamillaSantosReisdeAndradedaSilvaCarolinaSantosReisdeAndradedaSilvaJosMariaGarcMinaVeraciaDivanBaldaniAndrCalderGarcRicardoLuizLouroBerb
Maura Santos Reis de Andradeda Silva,Orlando Carlos Huertas Tavares,Thiago Gonçalves Ribeiro,Camilla Santos Reis de Andradeda Silva,Carolina Santos Reis de Andradeda Silva,3,José Maria García-Mina,Vera Lúcia Divan Baldani,Andrés Calderín García,Ricardo Luiz Louro Berbara,Ederson da Conceição Jesus 著 李子东 熊传教 周 欣 余玲玲 刘可星* 译
1 巴西农业研究公司 巴西 23897-970
2 里约热内卢联邦农村大学 巴西 23890-000
3 弗洛米嫩塞联邦大学 巴西 24210-240
4 西班牙纳瓦拉大学 西班牙 31009
5 华南农业大学资源环境学院 广州 510642
腐殖质(HS)通过影响土壤物理、化学和生物特性,进而对植物有益。HS还可以促进植物生长,包括改变根的厚度、长度、分枝和密度,从而改变根的结构(Canellas和Olivares,2014;García等,2016;Tavares等,2020)。但是,它的影响并不局限于根形态上的变化。腐植酸(HA)能调节激素信号通路,一些科学家认为腐殖质组分可以模拟生长素,被细胞受体识别(Canellas等,2002)。另有研究表明(Olaetxea等,2015),HA通过脱落酸(ABA)途径调控胁迫条件下膜水通道蛋白(PIP)的基因表达。HA也可以调节植物的氧化还原代谢,调节活性氧的浓度,刺激过氧化物酶、过氧化氢酶和液泡膜水通道蛋白(TIPs)的表达(García等,2016)。
通过影响植物代谢,HS还可以改变根系分泌物的分布,从而干扰根际微生物群落结构(Puglisi等,2009,2013)。HS结构的复杂性使这些物质诱发多种代谢途径,进而发生与植物相关的微生物相互作用。一些研究报道了外源施用HS和促生菌的益处(Canellas等,2013;Marques Júnior等,2008;Olivares等,2015)。例如施用HA后,血清草菌(Herbaspirillum seropedicae)在玉米根产生特异性的生物膜并定殖(Canellas和Olivares,2017),细菌和HA共接种保护植物免受水分胁迫的不利影响(Aguiar等,2016)。HA刺激氧化代谢酶(超氧化物歧化酶、过氧化氢酶和抗坏血酸过氧化物酶)活性,反过来,细菌诱导植物能保持相对含水量和气孔(Aguiar等,2016)。
在文献中已经证实,植物组织中自然维系着较高的微生物多样性(Hardoim等,2008),这些内生微生物可以通过种子遗传,正如在水稻的研究中已经证明的那样。其中,与第一代种子相关的细菌群落,有45%已经在第二代中被发现(Hardoim等,2012)。这种微生物群落通过多种机制影响植物的生长、健康和生存(Ⅴandenkoornhuyse等,2015;Carrión等,2019),且与植物生理的变化密切相关(Hallmann和 Berg,2006),也与环境条件密切相关(Hardoim等,2012)。尽管HA很重要,但其对这些植物相关微生物群落影响的研究鲜有报道。如上所述,这些物质会影响植物的生理变化,我们有理由认为它们也会影响微生物群落。
在这种情况下,我们假设HA的作用与植物相关细菌群落的调节同时发生,特别是促进植物生长的细菌。为了验证这一假设,我们将HS组分中可溶于碱性pH且在酸性介质中沉淀的HA(Schnitzer,1978),施用于水稻苗的根部,每隔72 h向营养液中添加HA,持续264 h。每间隔24 h采集植物1次,连续采样,评估水稻发育情况。通过对240 h样品的16S rRNA基因测序,对生长量变化和根系形态变化以及细菌群落的分类学特征进行评估。
1 材料和方法
1.1 HA的提取、纯化和表征
从牛粪、蚯蚓粪中分离出HAs,并根据国际腐殖质学会(International Humic Substances Society,IHSS,2020)推荐的方法纯化,详情请参阅补充资料。HAs的理化性质见先前报道(Tavares等,2020)。
1.2 水稻植株根系形态参数的试验设计、取样及 评价
试验采用完全随机设计(Steel和 Torrie,1980)。处理包括:2个因素水平,HA施用(有或没有HA)和采样时间(试验过程中每间隔24 h采样1次,共采样11次),共22个组合,每个组合6次重复,对528个试验样品进行评估。
“Piauí”水稻在光周期为12 h/12 h(光/暗)的条件下生长,光合作用的光子流为480 μmol/m2s,相对湿度为70%,温度为28 ℃/24 ℃(昼/夜)。种子用2%次氯酸钠消毒30 min,然后用蒸馏水洗涤10次。在萌发7天后,将秧苗移栽到有容量为0.7 L霍格兰溶液的盆中(每盆4株)(Hoagland和 Arnon,1950)。
营养液中HAs施用剂量为80 mg /L,当养分浓度改变时,每72 h添加80 mg/L HA到营养液中,对照组不施用HAs。每24 h采集1次植株,直到移栽后264 h(共11天),并测定以下变量:根和地上部干物质量,叶面积,根系长度、表面积、体积以及根尖数量。用光电计(LI-3000,Li-Cor)测算叶面积。使用Epson Expression 10000XL系统扫描根部,该系统带有一个额外的光单元(Turbo Pascal Unit,TPU)。参照前人的研究方法(Tavares等,2020),使用WinRhizo Arabidopsi软件(Régent Instruments Inc.,Quebec,Canada)分析根长(mm)、表面积(mm2)、体积(mm3)和根尖数量。
数据正态性和同方差性分别用Shapiro-Wilk和Bartlett进行检验。参照Steel等(1980)使用的R软件(R Core Team,2020),对数据进行方差分析(P〈0.05)。
1.3 水稻生长的定量分析
根据总干物质量和叶面积对植株生长进行分析。使用非线性回归对原始数据进行调整,推导出生长率,并估算出瞬时速率值(Araújo和 Rossiello,2013)。因此,在Hunt(1982)提出的各种模型中,我们决定使用基于迭代过程的Logistic模型(Hunt,1982;Ritz等,2015)。模型的选择是基于估计系数和决定系数(R2)的显著性,以及被测变量的时间变化的整体趋势(Araújo,2003;Araújo和 Rossiello,2013)。这是一个渐近模型,趋于最大值。由总干物质量或叶面积指数的Logistics函数[公式(1)],得到绝对生长率[AGR,公式(2)]、相对生长率[RGR,公式(3)]和净同化率[NAR,公式(4)],计算公式如下:
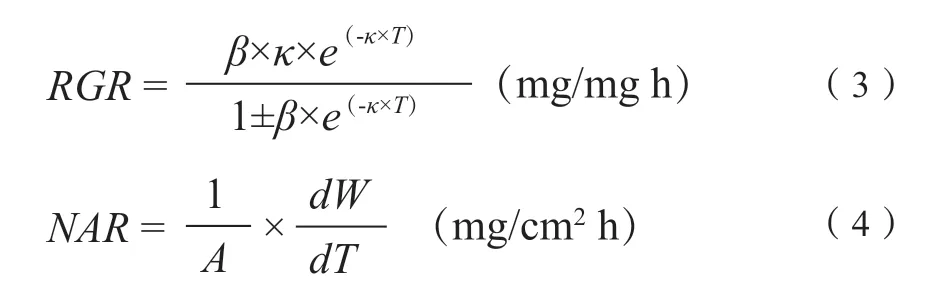
其中,W为观测数据,T为施用HA后的小时数,α,β,κ是非线性回归系数。选择Logistic模型是因为估计系数对观测到的R2的显著性(R2大于70%),以及所得曲线合适的生物学显著性。AGR表示单位时间内生物量生产的速度,RGR表示单位已有材料的生物量生产的速度(Hunt,1982)。通过使用DRC软件包的迭代过程,用数学函数处理叶面积和总干物质量的原始数据(Ritz等,2015)。
用F检验对数据进行方差分析。误差的正态性通过Shapiro-Wilk检验和Bartlett检验来验证差异的同方差性(Neter等,1974;Araujo,2003)。采用R软件(R Core Team,2020)和ggplot2包(Wickham,2016),将数据呈现为具有F检验显著性的箱形图。
1.4 DNA提取和16S rRNA测序
第1次施用HA 240 h后,收集施用或未施用过HA的水稻植株,用于DNA提取和16S rRNA基因测序。根据PowerPlant ®Pro DNA分离试剂盒(MO BIO)的步骤,从地上部和根部提取总DNA。DNA质量检测采用1%琼脂糖凝胶电泳,用溴化乙锭凝胶进行染色,并采用分光光度法在NanoDrop 1000中进行DNA定量。16S rRNA基因的Ⅴ4区测序采用515F(GTGCCAGCMGCCGCGGTAA)和806R(GGACTACHⅤGGGTWTCTAAT)引物(Caporaso等,2012),并遵循地球微生物组项目的协议(http://www.earthmicrobiome.org/protocolsand-standards/16S/)。使用肽核酸(Peptide nucleic acid,PNA)夹钳,阻断叶绿体和线粒体序列的扩增(Fitzpatrick等,2018)。在阿贡国家实验室环境样品制备和测序设备MiSeq测序机上进行测序。
1.5 序列分析
使用CASAⅤA v.1.8(Illumina)将基因文库多路解编,将其存放在基因库序列读取档案中,编号为SAMN5464651至SAMN5464666(补充表1)。序列分析使用了开源软件Mothur v.1.41.1(Schloss等,2009),并按照MiSeq 标准操作程序指南进行(https://www.mothur.org/wiki/MiSeq_SOP)。正向序列和反向序列组装,共产生288780个读取量,范围在247~502个碱基对之间,平均库容量为16043个读取量。去除不明确的序列,大于257 bp的序列,以及含有8个以上均聚物的序列。这些步骤之后,总共保留了245783个序列。将其划分为29572个独特序列,采用标准设置的全局比对方法(Needleman和 Wunsch,1970)与参考数据库(SILⅤA bacterial release 132(Quast等,2012;Yilmaz等,2014) 的Ⅴ4区进行比对。对比序列使用pre.cluster(差异=2)程序进行分组,并使用UCHIME软件检查嵌合体(Edgar等,2011),然后将嵌合体移除。使用核糖体数据库项目分类器工具(Cole等,2009)对操作分类单元(OTUs)分类,引导程序为80%。去除未知OTUs和真核生物、古生菌、线粒体、叶绿体。采用97%相似度(切值cutoff=0.03)的平均近邻算法对序列进行聚类,使序列能在属水平上进行分类(Comeau等,2011)。
将文件导入R软件(R Core Team,2020),并使用软件包phyloseq(McMurdie和 Holmes,2013)、stringr(Wickham,2016)、vegan(Oksanen等,2020)、DESeq2(Love等,2014)、factoextra(Kassambara和 Mundt,2020)、ggpubr(Kassambara,2020)和ggplot2(Wickham,2016)进行分析。首先,在OTU和门水平上,用OTU数据计算相关矩阵并进行主成分分析(PCA)(Legendre和 Legendre,1998)。在vegan软件包中,这种排序方法是基于除趋势对应分析(DCA)测量生态梯度的长度来选择的(Ter Braak和 Prentice,1988),利用decorana函数对稀有物种减量进行计算。使用相关矩阵来避免非常丰富的OTU主导分析。采用k-means方法鉴定样本组(Legendre和 Legendre,1998),通过999排列相似性分析(ANOSIM)评估各组的显著性(P〈0.05)(Clarke,1993;Warton等,2012)。此外,将相同的数据通过Euclidean距离和Ward算法进行分层聚类分析,目的是进一步确认群落是如何根据其分类学组成进行分组的。
利用软件包DESeq2的负二项分布差异基因表达分析(Love等,2014),鉴定了在HA处理植物中丰度差异富集或减少的细菌属。DESeq2估算计数数据的方差-均值相关性,并基于使用负二项分布的模型测试其差异丰度。这种方法最初是为了识别RNA测序分析中的差异表达基因而开发的,同时也被用于识别宏基因组分析计数数据的差异。当显著时调整的P值小于1%(P〈0.01),被认为是差异丰富的类群。箱形图显示了受显著影响的类群的丰度。建立柱状图,用来显示植物门和属的丰度变化,未发现丰度〈2%的类群。
使用R软件包SpiecEasi(Kurtz等,2021)、igraph(Csardi等,2006)和microeco(Liu等,2021)对每个处理进行网络分析,OTUs之间的相关性由Sparcc算法推导(Friedman 和 Alm,2012)。通过100次重复计算相关显著性,网络中仅显示大于0.6或小于-0.6(P〈0.01)的统计上显著的相关性。使用Gephi软件(Bastian等,2009)在Fruchterman-Reingold设计(Fruchterman等,1991)中绘制网络图,并在同一程序中计算其特性。
2 结果
2.1 HA对水稻干物质量、根系生长和发育的影响
HA对根和地上部干物质量累积的影响在整个评估阶段有所不同。第1次施用HA 24 h后,根干物质量降低,48 h后恢复。在施用HA 144和216 h后,根干物质量增加(P〈0.001)(图1a)。地上部干物质量也有类似的变化,在施用HA 144和264 h后显著增加(P〈0.001)(图1b)。
在整个试验过程中观察到干物质量累积的变化,NAR、AGR和RGR的结果显示出HA对植物生长的正效应(图1e、图1c、图1d)。在2个处理中,根据原始数据进行调整后的Logistic模型系数极其显著(P〈0.001)(表1)。总干物质量的R2值在0.92~0.93之间,叶面积指数的R2值在0.90~0.92之间,始终较高,与原始数据吻合。NAR随着HA的施用而增加(图1e),表明HA对光合代谢成分有刺激作用。HA处理的结果表明,100 h时AGR和RGR增加,并一直保持到试验结束(图1c、图1d)。
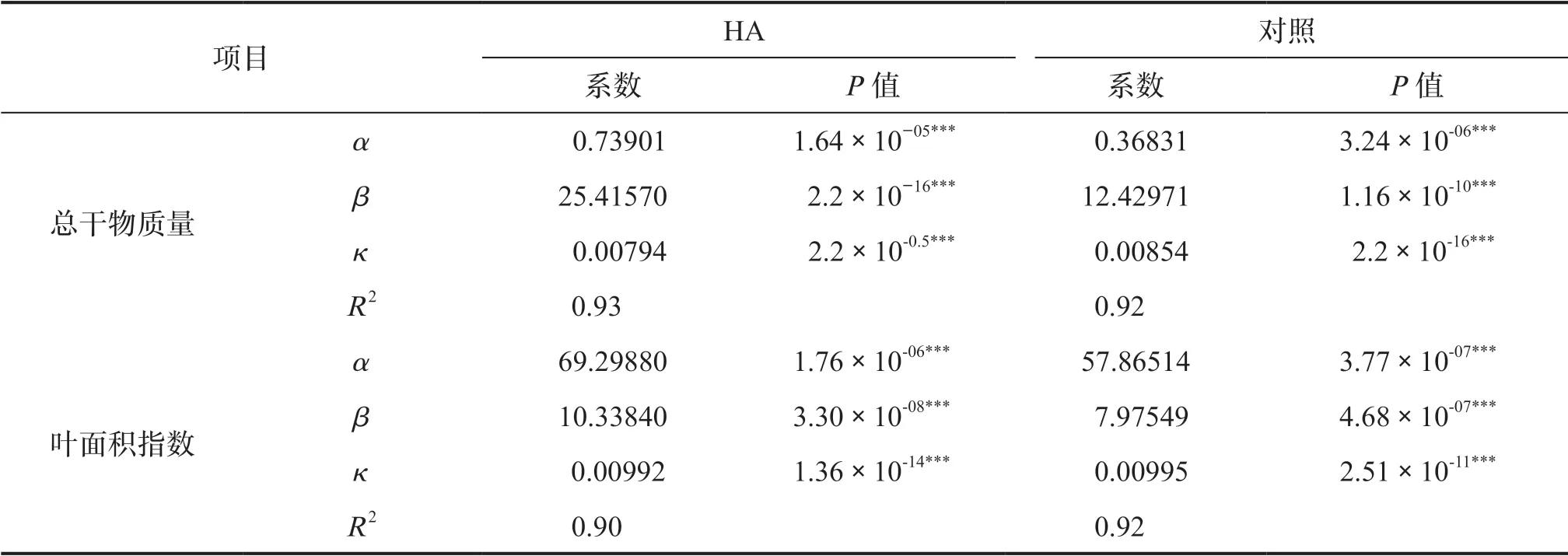
表1 用3参数对施用或不施用腐植酸处理的“Piaui”品种水稻植株总干物质量(TDW)和叶面积指数(LAI)进行Logistics回归调整的决定系数(R2)、估计系数(α、β、κ)和概率(P值)Tab.1 Determination coefficient (R2 ), estimated coefficients (α, β, κ) and probabilities (p-value) of the logistic type regression adjustments with 3 parameters for total dry weight (TDW) and leaf area index (LAI) of the plants of rice var. Piaui treated with and without humic acid
施用HA显著增加了根干物质量,根系长度、表面积和体积(图1a和图2a、图2b、图2c),这些响应随测定时间不同而变化,但所有这些结果都指出了施用HA后水稻根系的形态变化和生长刺激。48 h后和整个试验剩余时间里,根系体积显著增加(图2c),而在144 h后才观察到HA对根干物质量的影响(图1a),根系长度和表面积分别在216 h和192 h后显著增加(图2a,图2b)。根尖数量除了第1次施用144 h出现了不利影响(P〈0.001)外,其余影响并不显著(图2d)。
2.2 HA作用下水稻植株共生细菌群落的变化
第1次施用HA 240 h后,收集施用和未施用HA的水稻植株,用于DNA提取和16S rRNA基因测序。利用PCA,将植物相关的细菌群落分为3大类:一是经过HA处理的根部细菌群落;二是没有施用HA的根部细菌群落;三是在地上部形成的细菌群落(图3)。这种划分在OTU(图3a)和门水平(图3c)都可以观察到,与PCA相似的DCA结果同样支持这一划分(补充图1)。DCA的结果显示,在根部细菌群落中,基于植物单元(根部与地上部)的细菌群落与经HA处理的群落之间存在区别,有更高的变异性,这与地上部相关的群落具有更高的多样性和组成变异性是一致的(图4)。这些结果得到了聚类分析(k-means或分层聚类)(图3b、图3c)和相似性分析(ANOSIM)的支持。ANOSIM分析表明,根部细菌群落与地上部细菌群落差异显著(R=1,P=0.001),经HA处理的也类似(R=0.7526,P〈0.001)。虽然这些分析表明,施用与不施用HA的地上部相关群落之间没有明显不同,但在门和属水平上,某些类群的丰度存在差异,这有待进一步讨论。在地上部细菌群落的多样性更丰富,从门和属的数量较多这一点可以看出(图4和补充图2、图3)。

图1 施用(HA)或不施用(C)80 mg/L腐植酸处理水稻的根(a)和地上部(b)干物质量以及绝对生长率(c)、相对生长率(d)和净同化率(e)Fig.1 Root (a) and shoot (b) dry weight, absolute growth (c), and relative growth (d) rates and variations in the net assimilation (e) of rice plants treated (HA) or not (C) with 80 mg/L of humic acids in their roots
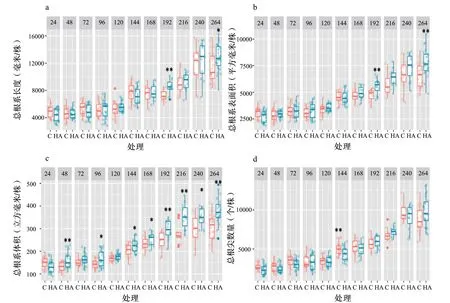
图2 施用(HA)或不施用(C)80 mg/L腐植酸处理水稻根系的长度(a)、表面积(b)、体积(c)和根尖数量(d)Fig.2 Root length (a), area (b), volume (c), and the number of tips (d) of rice plants treated (HA) or not (C) with 80 mg/L of humic acids in their roots
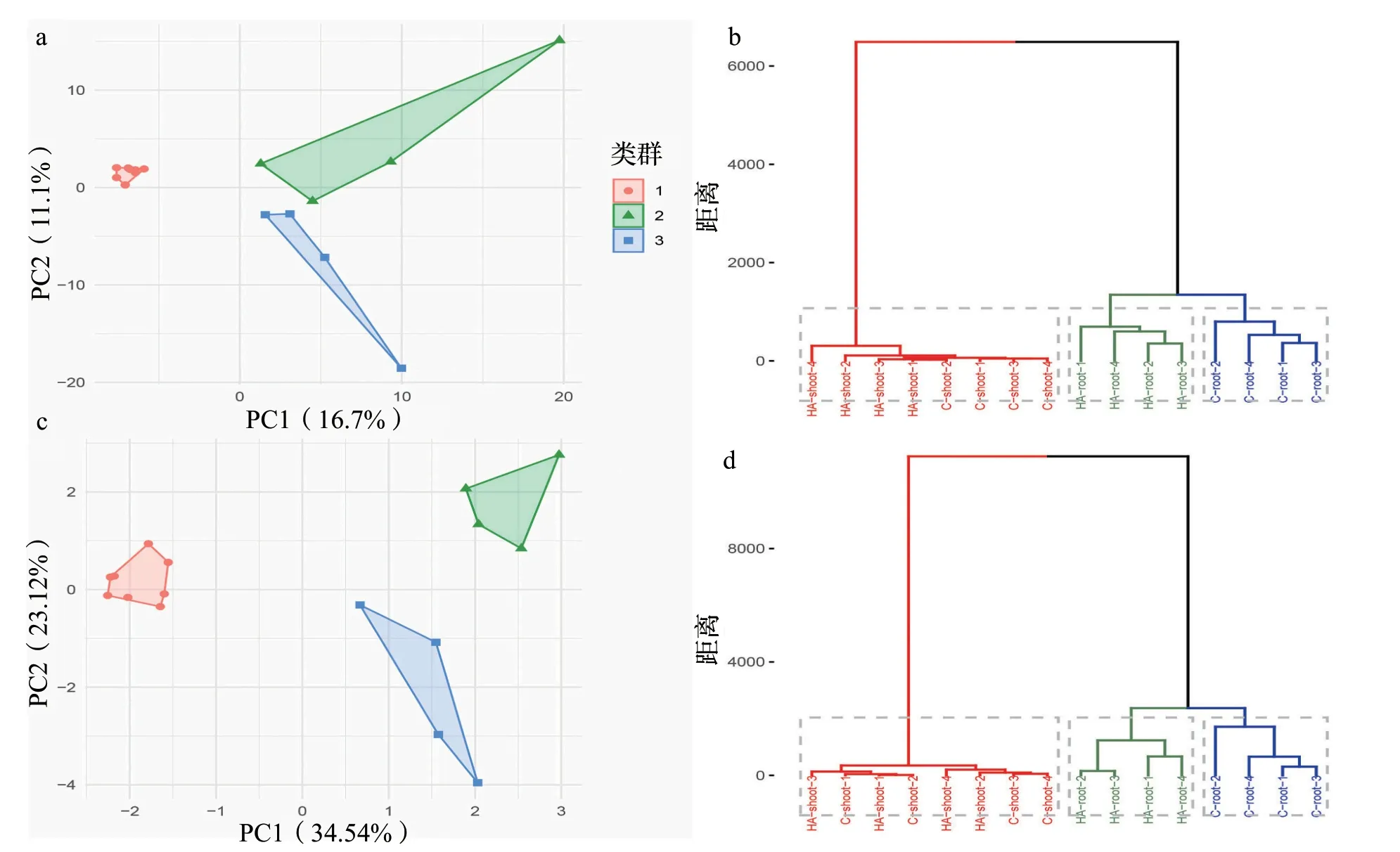
图3 施用(HA)或不施用(C)80 mg/L腐植酸处理水稻根部植株间的细菌群落差异Fig.3 Bacterial communities differed between rice plants treated (HA) or not (C) with 80 mg/L of humic acids in their roots

图4 根部和地上部中按门和属分类的类群相对丰度Fig.4 Relative abundance of taxa in roots and shoot classified at phylum and genus levels
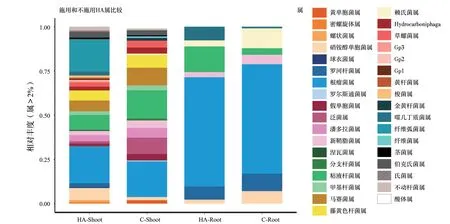
图4 续
通过宏基因组分类方法,可以区分施用与不施用HA植物共生细菌群落的微生物类群,同时,可以区分这些微生物类群对植物生长的刺激。细菌群落的响应是:地上部变形菌门(Proteobacteria)丰度增加,拟杆菌门(Bacteroidetes)丰度减少(图4a)。相反地,拟杆菌门(Bacteroidetes)和酸杆菌门(Acidobacteria)在根部丰度增加。放线菌门(Actinobacteria)在两个植株部位中丰度减少。根瘤菌属(Rhizobium)是最丰富的属(图4b),主要存在于根部,它构成了50%以上的序列。与我们的预期相反,已被报道可促进植物生长的细菌,如赖氏菌属(Leifsonia)、硝铵醇单胞菌属(Sphingomonas)和罗河杆菌属(Rhodanobacter)的丰度在HA处理的根部减少(图4a和图5a、图5b、图5c)。相应地,拟杆菌门(Bacteroidetes)的丰度增加,尤其是粘液杆菌属(Mucilaginibacter)和噬几丁质菌属(Chitinophaga)(图4和图5d、图5e、图5f、图5g),这种增加通过DESeq分析的统计结果得到验证(补充表1)。假单胞菌(Pseudomonas)和 酸 杆 菌 门(Acidobacteria)的一组代表菌(Gp 1)也富集,但丰度较低(图5h、图5i)。虽然PCA分析结果没有显示出不同群落之间的明显差异,但在某些属的丰度上,仍然可以观察到一些不同。例如,在HA处理的地上部,粘液杆菌属(Mucilaginibacter)、泛菌属(Pantoea)、潘多拉菌属(Pandoraea)、假单胞菌属(Pseudomonas)和马赛菌属(Massilia)的丰度降低(图5和补充图4)。
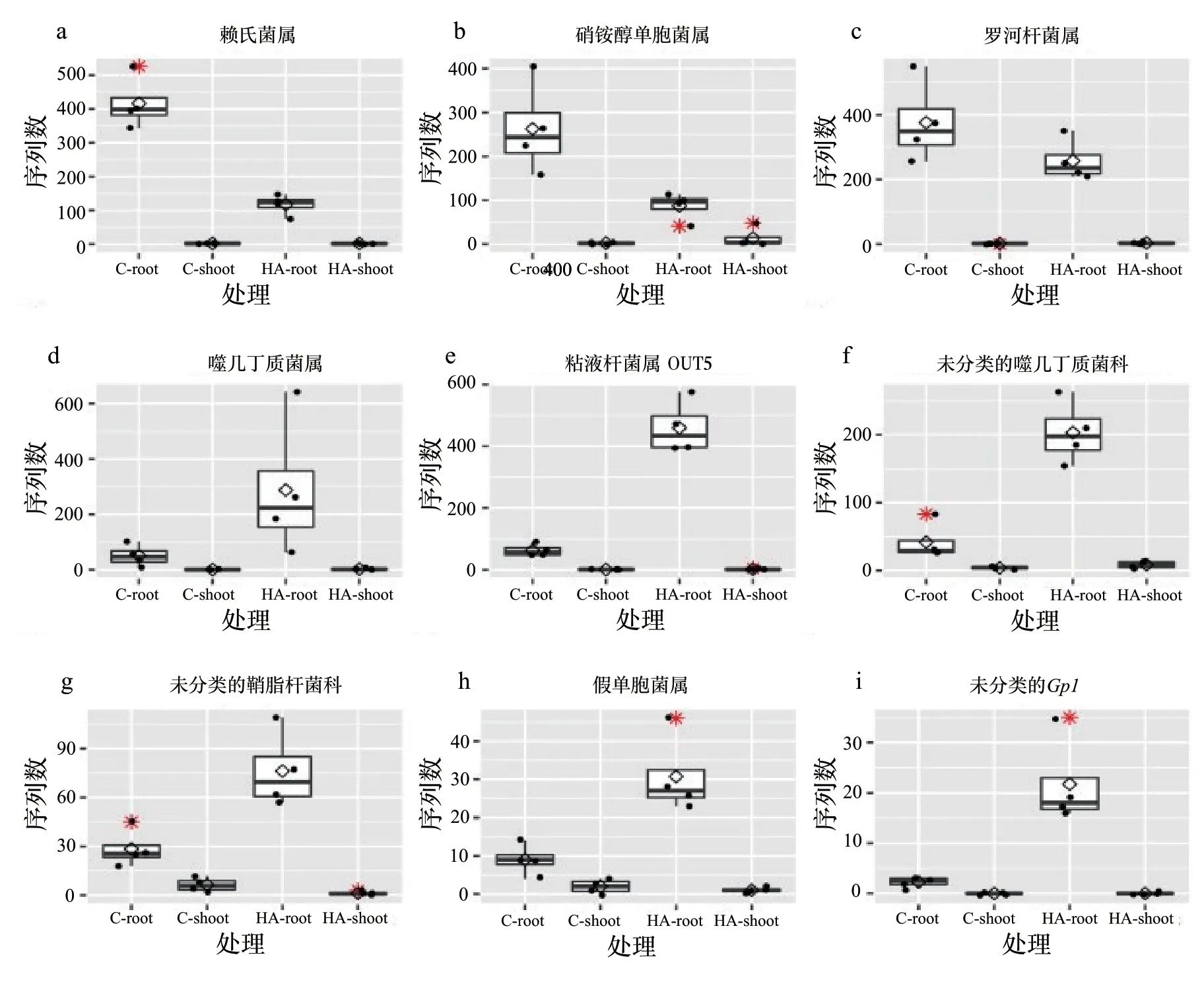
图5 在施用腐植酸(HA)的根中,其丰度不同程度减少(a、b和c)或富集(d至i)的主要类群Fig.5 Major taxa whose abundance were differently decreased (a, b, and c) or enriched (d through i) in roots that received humic acids (HA)
最后,用网络分析来研究HA的施用如何影响细菌群落成员之间的相互作用。与对照植株相比,经HA处理植株的根部细菌网络有更多的节点和连接,且正连接比例较大(图6a,图6b和表2)。该网络模块化更少,每个节点(平均度)的连接数量更大,路径长度更短,表明群落成员之间的连接性更高(表2)。经DESeq分析鉴定不同丰度的一些属,分别是粘液杆菌属(Mucilaginibacter),新鞘氨醇杆菌属(Novosphingobium),Gp 1,鞘氨醇单胞菌属(Sphingomonas)和一种未鉴定的鞘脂杆菌科Sphingobacteriaceae(补充表3),同样属于HA处理植株根部细菌网络的10大中心类群。
与对照相比,HA处理的地上部细菌网络节点和连接较少,负边比例较大(图6c、图6d和表2)。尽管如此,前者显示每个节点的连接数略多,路径长度更短,表明群落成员之间的连接程度更高(表2)。

表2 施用与不施用腐植酸植株根部和地上部细菌的网络属性Tab.2 Attributes of bacterial networks in the roots and shoot of plants treated or not with humic acids
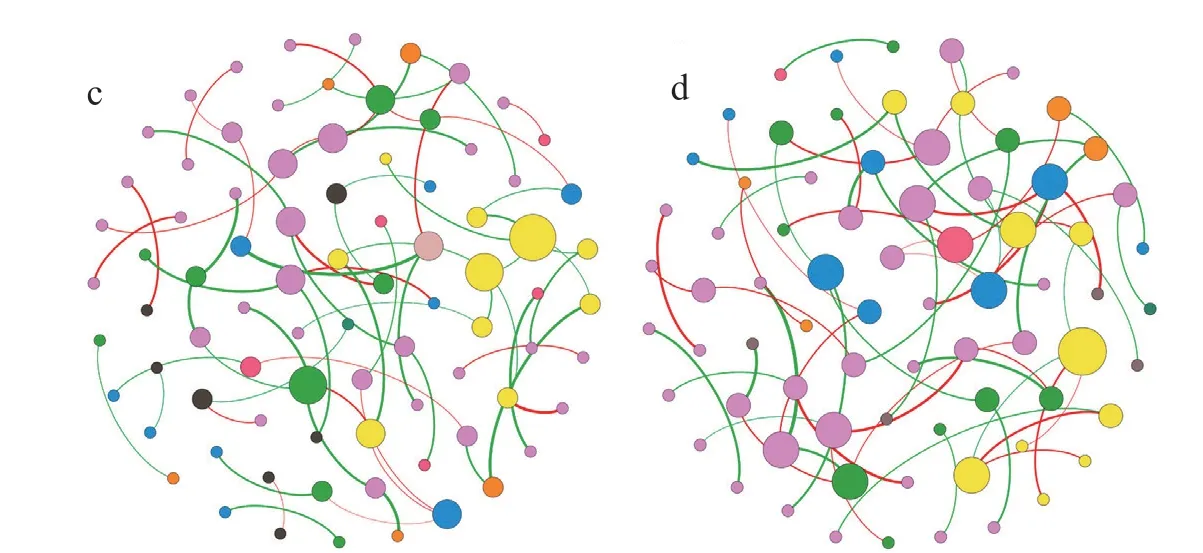
图6 续
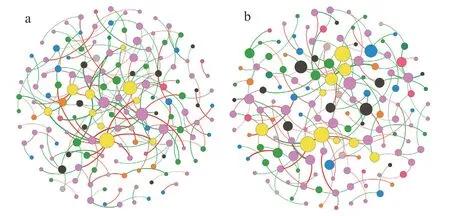
图6 施用(a)和不施用(b)HA处理的植株根部,施用(c)和不施用(d)HA处理植株地上部的细菌网络Fig.6 Bacterial networks in plant roots of HA-treated (a) and no HA-treated (b), and plant shoots of HA-treated (c) and no-HA-treated (d)
3 讨论
在本研究中,我们评估了HA对水稻生长和根系形态的影响,并鉴定了在该条件下筛选出的细菌类群。结果表明,HA与植物相关的微生物群之间具有协同作用,它们都可以调节植物的生理过程,从而对植物有益(Canellas 和 Olivares,2014;Hallmann 和 Berg,2006)。HA的有益作用可能来自于其对植物代谢的直接作用,或通过对植物微生物群的刺激。根系体积受到显著影响,其他几个生长变量在植物生长周期的不同时间受到刺激。HA对植物生长的正影响主要表现为AGR、RGR和NAR的显著提高(图1c、图1d、图1e和表1)。NAR表示每单位总叶面积的干物质产生率,用于衡量植物的光合效率(Hunt,2017);RGR是每单位现有干物质量累计新干物质量的速率,代表植物生产新干物质的效率(Lowry和 Smith,2018);AGR表示干物质量随时间的累积,本试验AGR值越高表明植物生长过程中干物质量增加越快,在100 h后始终较高,直到试验结束。
较高的生长率与较高的干物质量生产效率有关,说明光合效率和养分吸收提高,与我们的数据一致。其他研究报告认为HA可以促进光合作用(Jannin等,2012;Nardi等,2002),也有关于HS刺激植物主要代谢不同组分的影响报道,包括叶绿素a和b的活性(Yang等,2004)以及碳代谢不同组分的活性,主要是与酶刺激(Nardi等,2007),碳水化合物的产生(Merlo等,1991)和能量代谢基因的表达(Trevisan等,2011)有关。也有研究发现,施用HA可显著提高油菜根系的液态光合速率、单个细胞叶绿体数量和淀粉粒数量,这些效应与C、N、S同化量的增加一致(Jannin等,2012)。这些研究者还记录了HA诱导的根生长,在我们的工作中也观察到了这一过程。应用时间评估方法,我们观察到根和植物干物质量的增量随观测时间的变化而变化(图1和图2),以每天的取样来评估这些参数的研究报道不多。然而,HA对根生长发育的刺激作用已有研究(Canellas等,2002;García等,2016;Mora等,2012;Zandonadi等,2010)报道过。
宏基因组分类分析表明,植物相关细菌群落对HA的施用有响应。水培条件下,2种处理的地上部细菌群落多样性均高于根部。HA的施用导致了根部群落的显著变化,而在地上部的影响较小(图3)。主要的变化是根部拟杆菌门(Bacteroidetes)和酸杆菌门(Acidobacteria)的丰度增加,地上部变形菌门(Proteobacteria)的丰度增加而拟杆菌门(Bacteroidetes)的丰度减少。根瘤菌属(Rhizobium)是豆科植物中最丰富的一个属,特别是在根部。有研究报道了该属存在于苜蓿(一种豆科植物)中,且不仅局限于根瘤,也可以在整个植株中发现(Sturz等,1997)。这些研究者还发现,叶部的细菌多样性更高,与我们的观察结果一致。该属能够在水稻上定殖(Hahn等,2016;Rosenblueth等,2018;Yanni等,1997),并被报道单独接种或与巴西偶氮螺旋菌(Azospirillum brasilense)混合接种可促进水稻生长(Hahn等,2016)。
施用HA后,根部丰度最高的属为噬几丁质菌属(Chitinophaga)和粘液杆菌属(Mucilaginibacter)(图3c、图4d、图4e)。这2个属都有产生一系列水解酶的成员,如葡聚糖酶和几丁质酶,还有参与复合多糖的降解,例如真菌、卵菌和线虫卵细胞壁中的多糖(Carrion等,2019;Ramamoorthy等,2001;Sharma等,2020;Yoon等,2012)。施用一种诱导植物系统抗病(Nicot等,2016)并与抑制病原体的植物(Dai等,2020)有关的化合物后,根际土壤中鉴定出这些相同的属。此外,立枯丝核菌(Rhizoctonia solani)对甜菜根的入侵,刺激了在抑病土壤种植植物中的噬几丁质菌科(Chitinophagaceae)成员富集(Carrion等,2019),这组成员对脱分支酶和与真菌细胞壁降解相关的酶库有贡献。结合其他机制(如铁载体的产生),这些功能特征可以从内到外给植物提供保护。
假单胞菌属(Pseudomonas)和放线菌Gp 1(Actinobacteria Gp 1)也在施用HA处理的根部被刺激,尽管它们的丰度比噬几丁质菌属(Chitinophaga)和粘液杆菌属(Mucilaginibacte)的丰度低10~20倍。假单胞菌属(Pseudomonas)被广泛认为是一种促进植物生长的细菌,它通常与植物病原体的控制有关(Ramamoorthy等,2001)。除了诱导植物防御的直接作用外,来自该属的细菌还能合成多种抗菌化合物和水解酶,能够降解真菌细胞壁的成分(Ramamoorthy等,2001;Wang等,2019)。放线菌Gp1(Actinobacteria Gp1)被认为是通过idol-3-乙酸和铁载体产生等机制促进植物生长(Kielak et等,2016)。我们强调的第二种机制也被报道为一种参与抑制植物病原体的机制(Kloepper等,1980)。总而言之,这些特性引起了人们对施用HA处理的植物中筛选出的细菌群落,可能在保护植物免受病原体侵袭方面的关注。
根部的细菌网络在施用HA后,群落成员之间的连接性更高,这表现在它们的节点和连接数量增加(图6和表2)。一些正向的和反向的关键类群被鉴定为属于那些不同丰度的类群,如粘液杆菌属(Mucilaginibacter)、鞘脂杆菌科(Sphingobacteriaceae)和放线菌Gp1(Actinobacteria Gp 1),进一步说明它们可能与施用HA处理的植株根部细菌群落有关,其中还包括被认为能够产生II型多酮(Klein等,2020)的纤线杆菌属(Ktedonobacter)和前面已讨论的在所有处理和2个植物部位均发现的根瘤菌属(Rhizobium)。
近年来的研究表明,抑病土壤根际群落是植物防御的第一道防线(Mendes等,2011),当这一屏障被打破时,病原体需要面对由植物诱导而产生的防御机制(Jones和Dangl,2006)。入侵和进入植物组织后,菌群的调节可以作为另一个保护层,为抵御感染进程的第三道防线(Carrion等,2019)。这方面的最新研究发现,在接种病原体的抑菌土壤种植的甜菜中,假单胞菌科(Pseudomonadaceae)和噬几丁质菌科(Chitinophagaceae)均有富集,特别是第二家族的成员对脱支酶和真菌细胞壁降解的相关酶有贡献。值得注意的是,在施用HA处理后,相似的菌群增加。
这是我们第1次注意到,HAs可能在刺激植物相关的细菌群落成员中发挥作用,从而保护植物免受病原体的侵袭。鉴于这些结果,我们认为植物组建这些微生物是为了应对HA-根相互作用引起的胁迫(Berbara和 García,2014;García等,2016)。当HA被施用于植物根部,HA组分在根表面凝聚,造成轻微和短暂的胁迫,在此基础上,植物通过活性氧调节信号传导,诱导植物进入保护非生物胁迫的生理状态(Berbara和 García,2014;García等,2016)。这种胁迫可能是刺激植物群落组成变化和潜在参与植物防御的细菌富集的机制之一。此前的研究也表明,细菌和HA的共同应用提高了大豆植株对水分胁迫的恢复能力,进一步支持了我们的假设(Olivares等,2017)。这些类似研究的作者报告了在水分限制条件下,不同的甘蔗在使用细菌、HAs和两者混合物时的反应,复水处理后,只有HA处理的植株超氧化物歧化酶、过氧化氢酶、抗坏血酸过氧化物酶等抗氧化酶活性仍较高。研究还指出了HS在植物对生物制剂抗性中的作用,以及对植物次生防御代谢的影响(Abdel-Monaim等,2011;Polak和Pospisil,1995)。HA处理的植株表现出较高的苯丙氨酸(酪氨酸)解氨酶(PAL/TAL;EC 4.3.1.5),它是1种催化酚类化合物生物合成第1步的酶(Canellas等,2013;Schiavon等,2010),是1种次生代谢产物,保护植物免受各种生物和非生物胁迫(Dixon和Paiva,1995)。有研究指出,HAs对苯丙素代谢的影响与它们的化学结构、共纯化的真菌诱导子以及这些物质的其他信号分子有关(Schiavon等,2010)。
将植物暴露于HA引起的假胁迫,可以使植物更有效地耐受未来的胁迫条件,特别是生物胁迫。这种效应被称为“启动”效应,已经在先前施用过HA的玉米幼芽中观察到(Canellas等,2020)。体外使用不同来源的HS,特别是堆肥中的HS,对真菌植物病原体具有抑制作用(Loffredo等,2008)。木霉(Trichoderma)是1种生物防治微生物,能够抑制土传植物病原真菌(Inbar等,1996)。相反,同样的处理刺激木霉菌的生长。这些结果表明,植物代谢和有益微生物的共同作用具有抑制疾病的潜力,而施用HAs后,富集了这些微生物。
我们总结得出,HA的施用可以促进水稻根系生长发育,同时也改变了水稻细菌群落的组成。同时,我们还认为,HA可以激发微生物的富集,并有可能作用于植物的生长和植物对病原体的防御。这些结果在文献中未见报道,并提出了先前开放式的问题,例如需要找到方法来阐明HA对植物生理和植物微生物群落参与的真正作用。我们的研究结果或许可以认为,使用HA作为策略的一部分,通过刺激植物的防御代谢包括组建抑制病原体的微生物来应对生物和非生物胁迫。
4 附录A 补充数据
本文的补充数据可在此网页查阅:https://doi.org/10.1016/j.apsoil.2021.104146。
致谢和参考文献(略)
