云南地区栽培的3种羊肚菌的培养基筛选及生物学特性分析*
2022-07-05罗祥英许天休李文芝杨林雷陆青青沈真辉杨晓君李荣春
罗祥英 ,李 健 ,许天休 ,李文芝 ,曹 瑶 ,杨林雷 ,陆青青 ,沈真辉 ,杨晓君 ,李荣春 **
(1.云南菌视界生物科技有限公司,云南 昆明 651708;2.昆明市(食用菌)企业工程技术中心,云南 昆明 651708)
羊肚菌(Morchella spp.)隶属于子囊菌门(Ascomycota) 盘菌纲 (Discomycetes) 盘菌目 (Pezizales) 羊肚菌科(Morchellaceae),是一类富含营养价值和药用价值的珍稀食用菌。目前,全国广泛推广栽培的羊肚菌品种属于黑色羊肚菌支系(Elata Clade)。虽然已有较多关于羊肚菌生物学特性的研究,但因栽培区域、种类以及菌株等的差异,导致研究结果不尽相同,甚至相反。因此,以云南地区栽培的主要羊肚菌种类六妹羊肚菌(M.sextelata)、梯棱羊肚菌(M.importua) 和七妹羊肚菌(M.eximia)为研究材料,系统研究不同碳源、氮源、2种无机盐对3种羊肚菌共15个菌株的菌丝生长及菌核产生的影响,并优化、筛选最佳培养基配方,为云南地区羊肚菌的大规模生产及栽培提供科学依据。
1 材料与方法
1.1 供试菌株
供试羊肚菌菌株均由云南菌视界生物科技有限公司保存、提供,具体信息详见表1。
表1 供试菌株清单Tab.1 The list of tested strains
1.2 培养基配方
配方1培养基:马铃薯200 g(去皮)、葡萄糖20 g、琼脂粉18 g、VB110 mg,蒸馏水1 000 mL,pH 6.0。
配方2培养基:糊精20 g(碳源)、蛋白胨5 g(氮源)、琼脂粉18 g、VB110 mg,蒸馏水1 000 mL,pH 6.0。
1.3 试验方法
1.3.1 菌种初筛
利用配方1培养基活化供试菌种,获得纯培养菌丝。统计15个菌株的菌丝平均生长速度,筛选出长势最好的3个菌株进行下一步试验。
1.3.2 不同碳源对羊肚菌菌丝生长影响试验
以另外14种碳源分别替代上述配方2培养基中的糊精,包括葡萄糖、蔗糖、麦芽糖、乳糖、半乳糖、果糖、甘露醇、可溶性淀粉、乙醇、丙三醇、几丁质、麦粒煮汁、山梨醇、木糖,均分别称取20 g;以无碳源的培养基作对照。统计分析不同碳源对3个初筛菌株菌丝生长的影响。
以六妹羊肚菌JSJ-M1菌株为试验材料,每隔12小时测量菌落半径,研究其在不同碳源下的生长曲线。
1.3.3 不同氮源对羊肚菌菌丝生长影响试验
以另外10种氮源分别替代上述配方2培养基中的蛋白胨,包括豆饼粉、玉米粉、酵母膏、牛肉膏、硫酸铵、硝酸钠、硝酸铵、硝酸钾、氯化铵、酒石酸铵,均分别称取5 g;以无氮培养基作对照。统计分析不同氮源对3个初筛菌株菌丝生长的影响。
以六妹羊肚菌JSJ-M1菌株为试验材料,每隔12小时测量菌落半径,研究其在不同氮源下的生长曲线。
1.3.4 不同温度对六妹羊肚菌JSJ-M1菌株影响试验
使用筛选出的最佳培养基作为供试培养基,以六妹羊肚菌JSJ-M1菌株为材料,设置恒温培养箱温度分别为4℃、9℃、12℃、15℃、18℃、21℃、24℃、28℃、34℃共9个处理,每个处理5个重复,黑暗条件培养。
1.3.5 不同pH对六妹羊肚菌JSJ-M1菌株影响试验
以六妹羊肚菌JSJ-M1菌株为材料,使用筛选出的最佳培养基作为供试培养基,培养基灭菌前用浓度为 0.1 mol·L-1的 NaOH 和浓度为 0.1 mol·L-1的HCl调节pH,采用PHS-2C型酸度计测定,设置pH为 4.0、4.5、 5.0、 5.5、6.0、6.5、 7.0、7.5、8.0、9.0共10个处理,每个处理5次重复。
1.3.6 KH2PO4和MgSO4对羊肚菌菌丝生长的影响试验
1)单因素试验设计:使用筛选出的最佳培养基作为供试培养基,在培养基中分别加入KH2PO4和MgSO4,均设置6个质量浓度梯度为0.5 g·L-1、1.0 g·L-1、1.5 g·L-1、2.0 g·L-1、2.5 g·L-1、3.0 g·L-1,以不添加无机盐的培养基为对照,每个处理5次重复。
2)双因素组合试验:在单因素的基础上,通过全面试验设计法研究2种无机盐的不同组合对羊肚菌菌丝生长及菌核形成的影响,每个组合设置3个重复。
1.3.7 数据测量方法
试验采用90 mm的一次性灭菌培养皿,每个培养皿倒20 mL的培养基,固定培养基厚度相同。接种块大小为直径5 mm,置于培养皿中央,接种后用1层封口膜封口并置于18℃恒温培养箱黑暗培养。接种后采用划线法每隔12小时划线测量1次菌丝生长速度,并观察菌丝长势以及菌核形成情况。接种培养15天后,挑取菌核,烘干,测量菌核干质量。用Excel记录并进行数据分析,用SPSS 25.0进行均值分析、方差分析、单/双因素ANOVA检验。
菌丝生长速度(V,mm·d-1)的计算公式为:
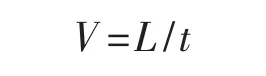
式中:L为菌丝平均直径(mm);t为菌丝培养时间 (d)。
2 结果与分析
2.1 不同菌株在同一培养基内菌丝长势存在差异
15个菌株在配方1培养基上的菌丝生长速度见图1。
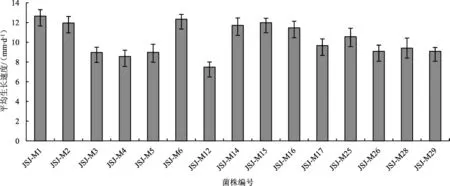
图1 不同菌株在配方1培养基上的菌丝生长速度Fig.1 Growth rate of different strains on formula 1 medium
如图1所示,15个菌株在配方1培养基上的菌丝长势存在差异。其中生长最快的菌株为六妹羊肚菌JSJ-M1,平均生长速度为12.65 mm·d-1;菌株JSJ-M2菌丝生长较快,平均生长速度为11.96 mm·d-1。七妹羊肚菌中菌丝生长较快的菌株为JSJ-M6,平均生长速度为12.34 mm·d-1。梯棱羊肚菌中生长较快的菌株为JSJ-M14和JSJ-M15,平均生长速度分别为11.71 mm·d-1和 11.98 mm·d-1。通过筛选,以菌株JSJ-M1、JSJ-M6、JSJ-M15为材料进行后续试验。
2.2 不同碳源对3个羊肚菌菌株的影响
3个羊肚菌菌株在不同碳源培养基上菌丝的生长速度见图2。
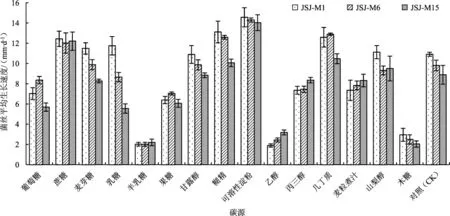
图2 3个羊肚菌菌株在不同碳源培养基上的菌丝生长速度Fig.2 Mycelial growth rate of three Morchella strains on the different carbon sources media
由图2可知,不同碳源对羊肚菌菌丝生长影响较大,JSJ-M1、JSJ-M6和JSJ-M15菌株生长的最佳碳源均为可溶性淀粉,平均菌丝生长速度分别为14.57 mm·d-1、14.30 mm·d-1和 14.04 mm·d-1。其次是糊精、几丁质和蔗糖;其中JSJ-M1菌株对糊精的利用优于几丁质和蔗糖,JSJ-M6菌株对几丁质的利用优于糊精和蔗糖,JSJ-M15菌株对蔗糖的利用优于几丁质和糊精。在以乳糖、麦芽糖、山梨醇、甘露醇为碳源时,JSJ-M1和JSJ-M6菌株的生长速度与不添加碳源的对照组的菌丝生长速度无显著差异,不加碳源的对照组虽然菌丝生长较快,但是菌丝非常稀疏、纤细;3个菌株对乳糖的利用存在较大的差异,以乳糖为碳源时,JSJ-M1、JSJ-M6、JSJM15菌株的菌丝生长速度分别为11.76 mm·d-1、8.66 mm·d-1、5.56 mm·d-1。JSJ-M15 菌株对丙三醇和麦粒煮汁的利用与麦芽糖无异而优于乳糖,这与JSJM1和JSJ-M6菌株相反。3个菌株菌丝生长最差碳源均为半乳糖、乙醇和木糖。
通过观察、统计3个羊肚菌菌株的菌丝生长状态,分析羊肚菌对碳源的综合利用情况,结果见表2。
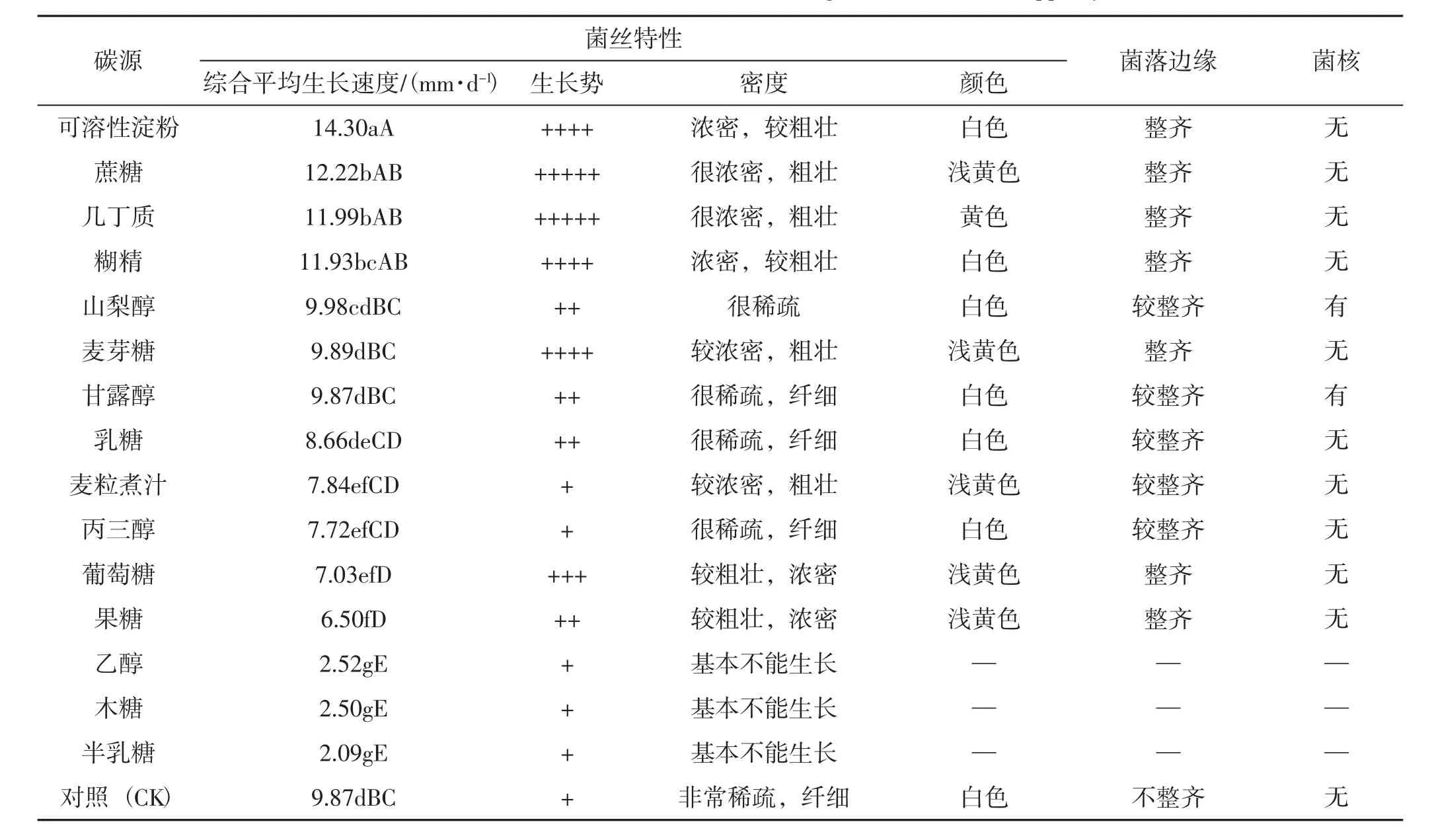
表2 不同碳源对羊肚菌菌丝生长的影响Tab.2 The effects of different carbon sources on the growth of Morchella spp.mycelia
如表2所示,通过统计学数据分析,发现在不同碳源条件下羊肚菌菌丝的生长速度存在显著差异,即不同碳源对羊肚菌菌丝生长的影响较大。在可溶性淀粉为碳源的培养基上3个羊肚菌菌株的综合平均生长速度最快,为14.30 mm·d-1,显著优于其他碳源。其次是蔗糖、几丁质和糊精,综合平均生长速度分别为 12.22 mm·d-1、11.99 mm·d-1和 11.93 mm·d-1,虽然这3个碳源之间无显著差异,但显著优于除了可溶性淀粉以外的其他碳源。在麦芽糖为碳源的培养基上生长的菌丝较粗壮、浓密,长势较好,综合菌丝平均生长速度为9.89 mm·d-1。以山梨醇、乳糖、甘露醇作为碳源以及对照培养基内的菌丝生长速度虽然较快,但是菌丝非常稀疏、纤细,长势很弱,说明羊肚菌菌丝生长不能很好的利用乳糖、甘露醇、山梨醇。以丙三醇、果糖等作为碳源的培养基上菌丝生长较粗壮,但是生长速度很慢。而在以木糖、半乳糖、乙醇作为碳源的培养基上,羊肚菌菌丝基本不能生长。综上所述,羊肚菌菌丝生长的最优碳源为可溶性淀粉;以可溶性淀粉、糊精、几丁质和蔗糖作为碳源时,羊肚菌菌丝粗壮、浓密、长势很好,为羊肚菌栽培的优选碳源。
2.3 不同氮源对3个羊肚菌菌株的影响
3个羊肚菌菌株在不同氮源培养基上菌丝的生长速度见图3。
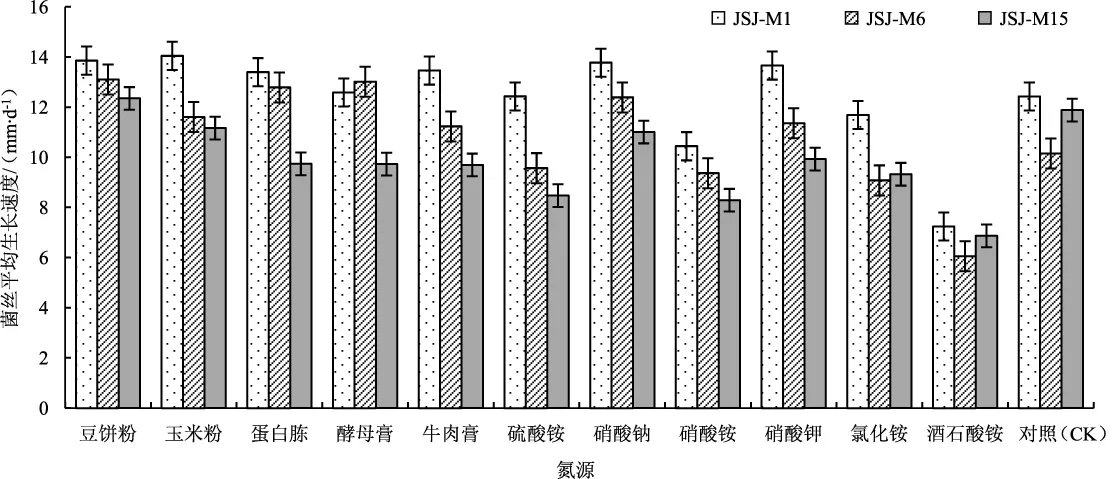
图3 3个羊肚菌在不同氮源培养基上菌丝生长速度Fig.3 Mycelial growth rate of three Morchella strains on the different nitrogen sources media
如图3所示,3个羊肚菌菌株在以酒石酸铵为氮源的培养基上,菌丝生长速度明显低于对照组,此外其他试验组与对照组相差不明显。JSJ-M1和JSJ-M6菌株对氮源的适应利用范围较广,但JSJM15菌株仅在以豆饼粉为氮源的培养基中菌丝生长速度较对照组有所提高。
通过观察、统计3个羊肚菌菌株的菌丝生长,分析羊肚菌对氮源的综合利用情况,结果见表3。

表3 不同氮源对羊肚菌菌丝生长的影响Tab.3 The effects of different nitrogen sources on the growth of Morchella spp.mycelia
由表3可知,羊肚菌菌丝生长可利用的氮源较为广泛,供试的氮源条件下羊肚菌菌丝生长较快。豆饼粉、硝酸钠、玉米粉、蛋白胨、酵母粉、硝酸钾、牛肉膏为羊肚菌菌丝生长的优选氮源,其综合菌丝平均生长速度在 11.46 mm·d-1~13.11 mm·d-1之间,无显著差异,且菌丝粗壮、浓密。以氯化铵、硫酸铵为氮源时,菌丝生长速度与对照无显著差异,但是菌丝较对照组粗壮、浓密、长势较好。以酒石酸铵为氮源时菌丝生长速度最慢,为6.72 mm·d-1;在生长后期形成绒毛状菌丝,白色,易老化。此外,以硝酸钠和硝酸钾作为氮源时,气生菌丝生长茂盛,菌丝粗壮、浓密。
2.4 不同条件下六妹羊肚菌JSJ-M1菌株的生长情况
2.4.1 不同碳源下六妹羊肚菌JSJ-M1菌株的生长曲线
比较初筛获得的最优菌株六妹羊肚菌JSJ-M1在不同碳源下的生长曲线,见图4。
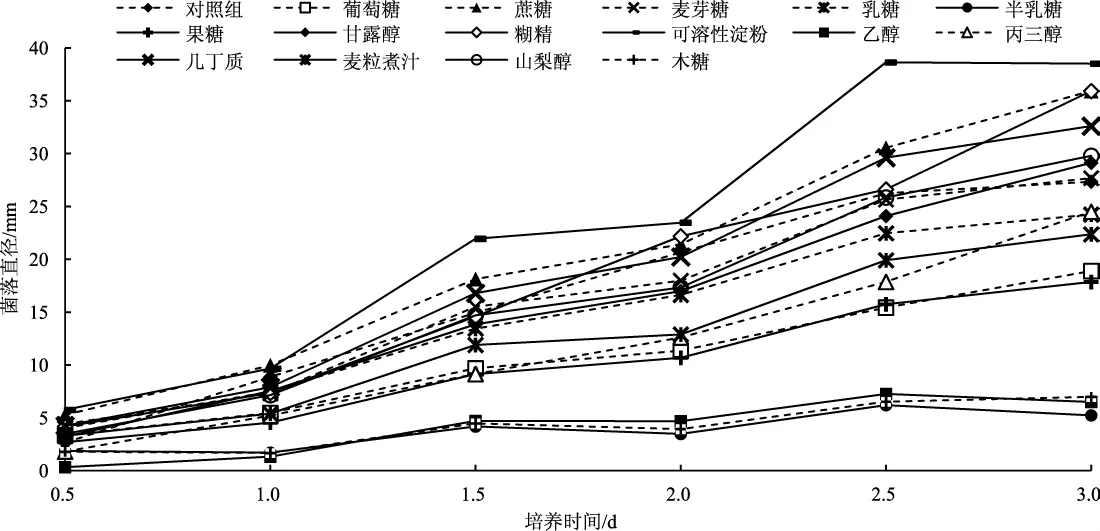
图4 六妹羊肚菌JSJ-M1菌株在不同碳源培养基中的生长曲线Fig.4 The growth curve of Morchella sextelata JSJ-M1 strain on the different carbon sources media
由图4可知,六妹羊肚菌JSJ-M1菌株在半乳糖、乙醇和木糖为碳源时,菌丝生长缓慢,生长速度显著低于对照;供试的其他碳源条件下,菌丝生长趋于线性增长。
2.4.2 不同氮源下六妹羊肚菌JSJ-M1菌株的生长曲线
比较初筛获得的最优菌株六妹羊肚菌JSJ-M1在不同氮源下的生长曲线,见图5。
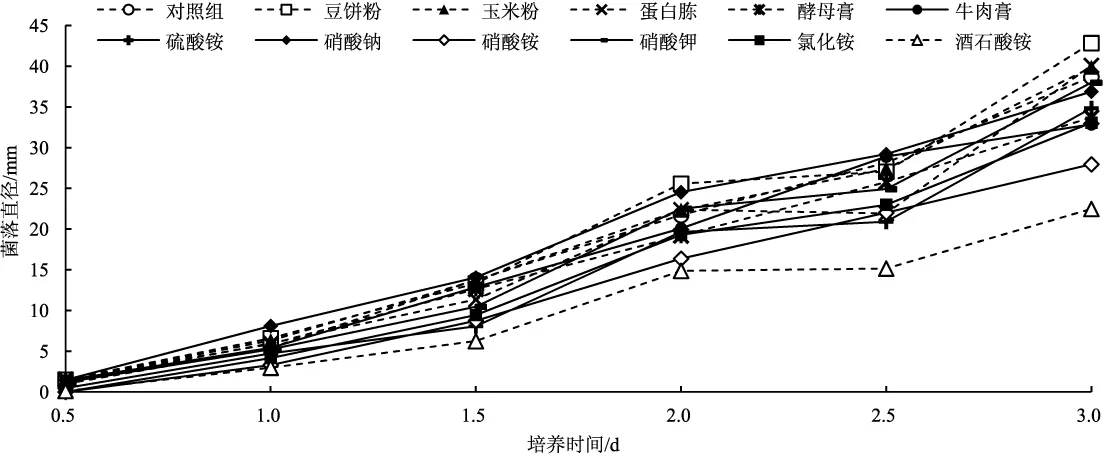
图5 六妹羊肚菌JSJ-M1菌株在不同氮源下的生长曲线Fig.5 The growth curve of Morchella sextelata JSJ-M1 strain on the different nitrogen sources media
由图5可知,在以酒石酸铵为氮源时,六妹羊肚菌JSJ-M1菌株的菌丝生长最缓慢;其他供试的氮源条件下,菌丝均趋于线性增长。
2.4.3 不同温度对六妹羊肚菌JSJ-M1菌株的影响
不同温度下六妹羊肚菌JSJ-M1菌株的菌落形态见图6,菌丝生长速度见图7。
由图6和图7可知,六妹羊肚菌JSJ-M1菌株能够在4℃~28℃的温度范围内生长。在21℃、24℃条件下菌丝生长最快,生长速度分别为13.29 mm·d-1和13.30 mm·d-1。在12℃~18℃时易形成菌核,菌丝分泌色素较少。在28℃时不形成菌核,菌丝分泌大量色素,变黄。34℃时菌丝停止生长。

图6 不同温度下六妹羊肚菌JSJ-M1菌株的菌落形态Fig.6 Colony morphology of Morchella sextelata JSJ-M1 strain at different temperatures
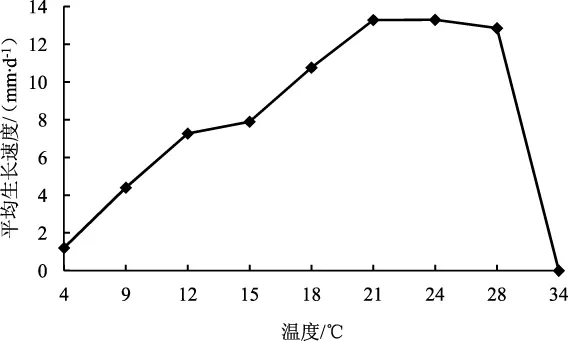
图7 不同温度下六妹羊肚菌JSJ-M1菌株的菌丝生长速度Fig.7 Mycelial growth rate of Morchella sextelata JSJ-M1 strain at different temperatures
2.4.4 不同pH对六妹羊肚菌JSJ-M1菌株的影响
不同pH对六妹羊肚菌JSJ-M1菌株菌丝生长速度的影响见图8。
由图8可知,适合六妹羊肚菌JSJ-M1菌株菌丝生长的pH范围较广,pH 4.0~9.0范围内均能生长;最适pH为5.5~7.0。
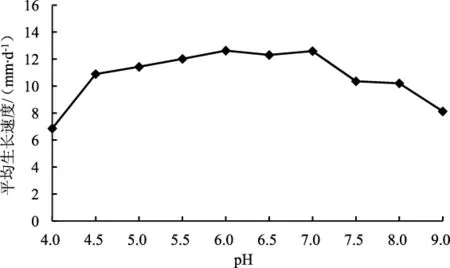
图8 不同pH条件下六妹羊肚菌JSJ-M1菌株的菌丝生长速度Fig.8 Mycelial growth rate of Morchella sextelata JSJ-M1 strain under different pH conditions
2.5 无机盐对羊肚菌菌丝生长及菌核形成的影响
2.5.1 单因素试验
不同质量浓度KH2PO4的培养基以及不同质量浓度MgSO4的培养基中3个羊肚菌菌株的菌丝生长情况及形态分别见图9和图10。
如图9和图10所示,在培养基中单独添加不同质量浓度的KH2PO4均能够促进3个菌株的菌核形成;单独添加不同质量浓度MgSO4时,除了JSJ-M6菌株在1.0 g·L-1MgSO4培养基中可形成菌核外,其他处理均不能形成菌核。
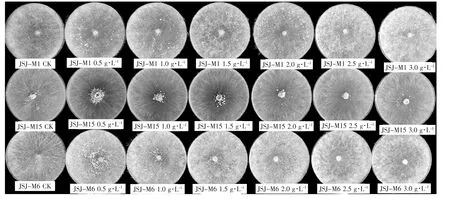
图9 不同KH2PO4质量浓度的培养基上3个羊肚菌菌株的菌丝生长情况Fig.9 Mycelial growth of three Morchella strains on medium with different mass concentrations of KH2PO4

图10 不同MgSO4质量浓度的培养基上3个羊肚菌菌株的菌丝生长情况Fig.10 Mycelial growth of three Morchella strains on medium with different mass concentrations of MgSO4
不同浓度的KH2PO4对羊肚菌菌丝生长速度、菌核形成的影响见图11。
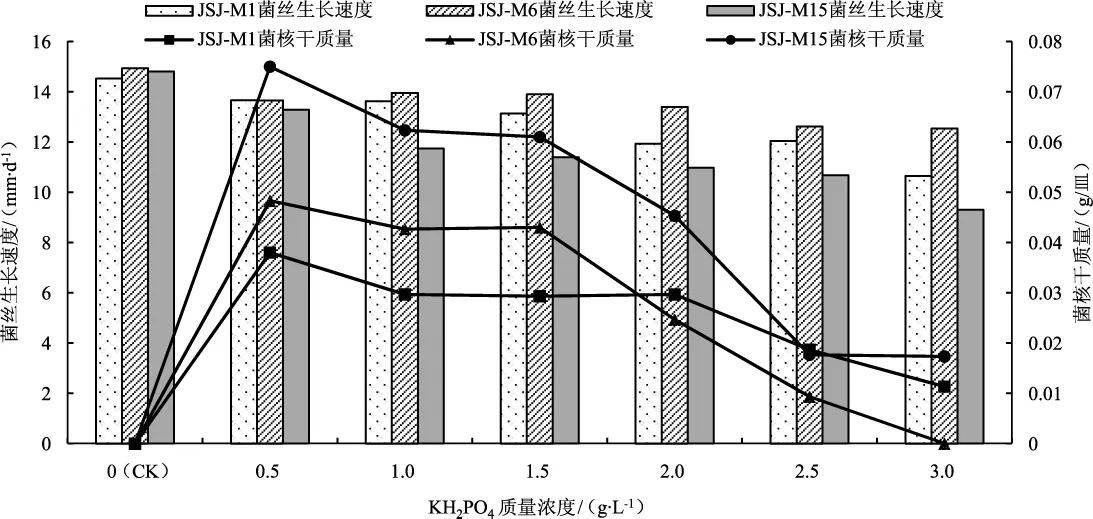
图11 不同KH2PO4质量浓度对3个羊肚菌菌株的菌丝及菌核的影响Fig.11 The effect of different mass concentrations of KH2PO4on the mycelia and sclerotia of three Morchella strains
如图 11 所示,在 0.5 g·L-1~3.0 g·L-1KH2PO4培养基中3个菌株的菌丝生长速度均低于不添加KH2PO4的培养基,但均有菌核形成。在0.5 g·L-1~2.0 g·L-1KH2PO4培养基中,3个菌株形成菌核较多;KH2PO4质量浓度为0.5 g·L-1时形成菌核最多,JSJM1、JSJ-M6、JSJ-M15菌株的菌核干质量分别为0.038 g/皿、0.048 g/皿、0.075 g/皿;KH2PO4质量浓度为3.0 g·L-1时,3个菌株的菌核形成最少;不添加KH2PO4的培养基中无菌核形成。
不同质量浓度的MgSO4对羊肚菌菌丝生长速度的影响见图12。
如图12所示,培养基中添加质量浓度为0.5 g·L-1~2.0 g·L-1的 MgSO4时能够促进羊肚菌菌丝的生长。MgSO4质量浓度为1.0 g·L-1时,JSJ-M1和JSJ-M6菌株的菌丝生长最快,分别达到18.14 mm·d-1和15.87 mm·d-1;而JSJ-M15菌株在质量浓度为0.5 g·L-1时菌丝生长最快,达到16.16 mm·d-1。
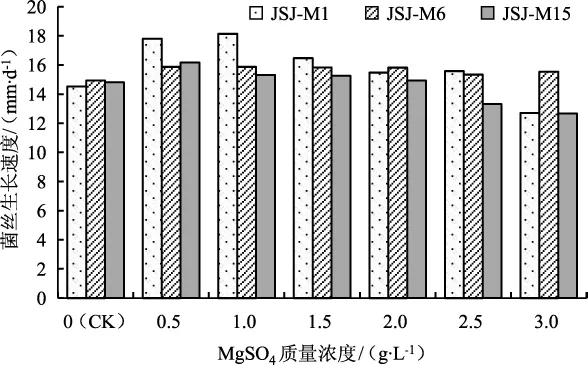
图12 不同MgSO4质量浓度对3个羊肚菌菌株菌丝生长的影响Fig.12 The effect of different mass concentrations of MgSO4 on the growth of mycelia of three Morchella strains
综上所述,培养基中添加KH2PO4可以促进羊肚菌菌核的形成,且质量浓度为0.5 g·L-1~2.0 g·L-1时较好,但对菌丝的生长没有显著的促进作用;培养基中添加MgSO4对羊肚菌菌丝的生长有显著促进作用,且质量浓度为0.5 g·L-1~2.0 g·L-1时较好,但对菌核的形成没有促进作用。
2.5.2 双因素组合试验
在单因素的基础上进行双因素组合试验,统计3个菌株的综合平均菌丝生长速度及综合平均菌核干质量,结果见表4。
由表4可知,MgSO4质量浓度相同时,随着KH2PO4质量浓度的增加羊肚菌菌丝的生长速度呈现下降趋势;KH2PO4质量浓度相同时,随着MgSO4质量浓度的增加羊肚菌菌丝生长速度呈现上升趋势。在不同组合条件下均有菌核形成,菌核的干质量与2种无机盐的添加量之间无明显规律。
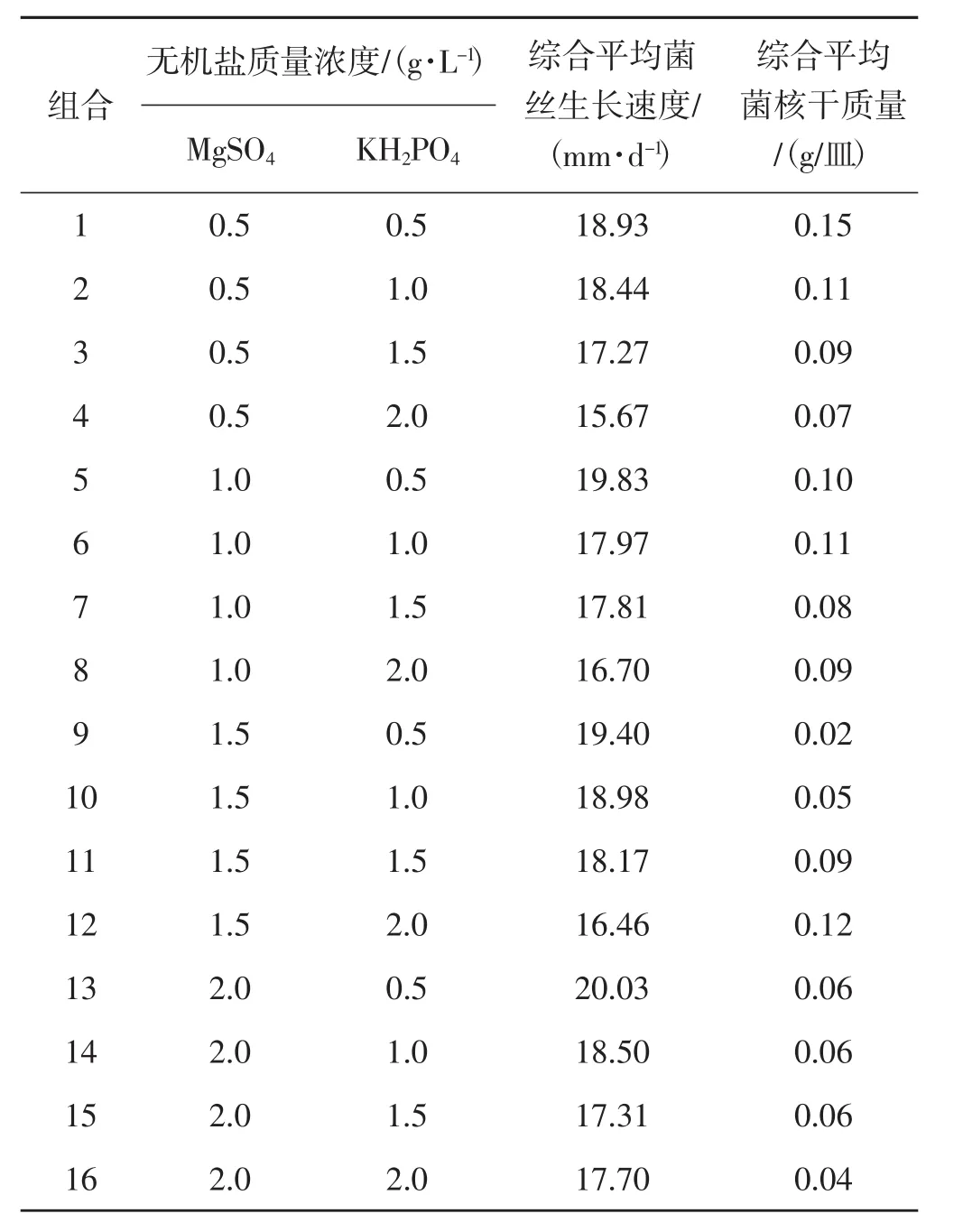
表4 双因素组合试验结果Tab.4 Results of two-factor combination experiment
对组合试验进行方差分析,结果见表5。
由表5可知,MgSO4和KH2PO4对羊肚菌菌丝生长有显著的影响,且2个因素对菌丝生长的影响存在显著的交互作用。
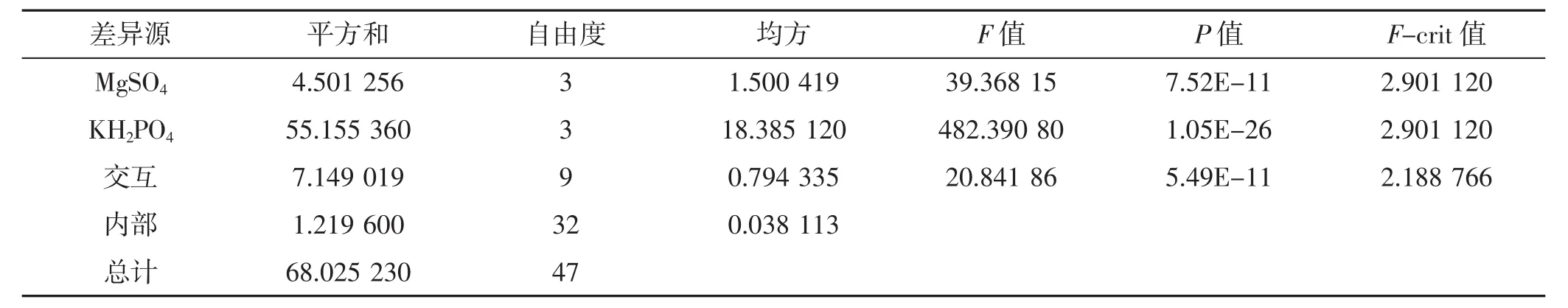
表5 双因素方差分析Tab.5 Two-way analysis of variance
2.5.3 验证试验
结合菌丝生长速度、菌核形成的质量及生产成本等因素,无机盐的添加量应优先选择组合1(KH2PO4的质量浓度为0.5 g·L-1、MgSO4的质量浓度为0.5 g·L-1),此条件下羊肚菌的综合平均菌丝生长速度为18.93 mm·d-1,综合平均菌核干质量为0.15 g/皿。以此条件进行验证试验,结果见图13。
如图13所示,CK为不添加任何无机盐时3个菌株的菌丝生长及菌核情况,综合平均菌丝生长速度为14.81 mm·d-1,培养15天后不形成菌核;添加组合1的培养基中3个菌株的综合平均菌丝生长速度为19.03 mm·d-1,培养15天后测量综合平均菌核干质量为0.17 g/皿。
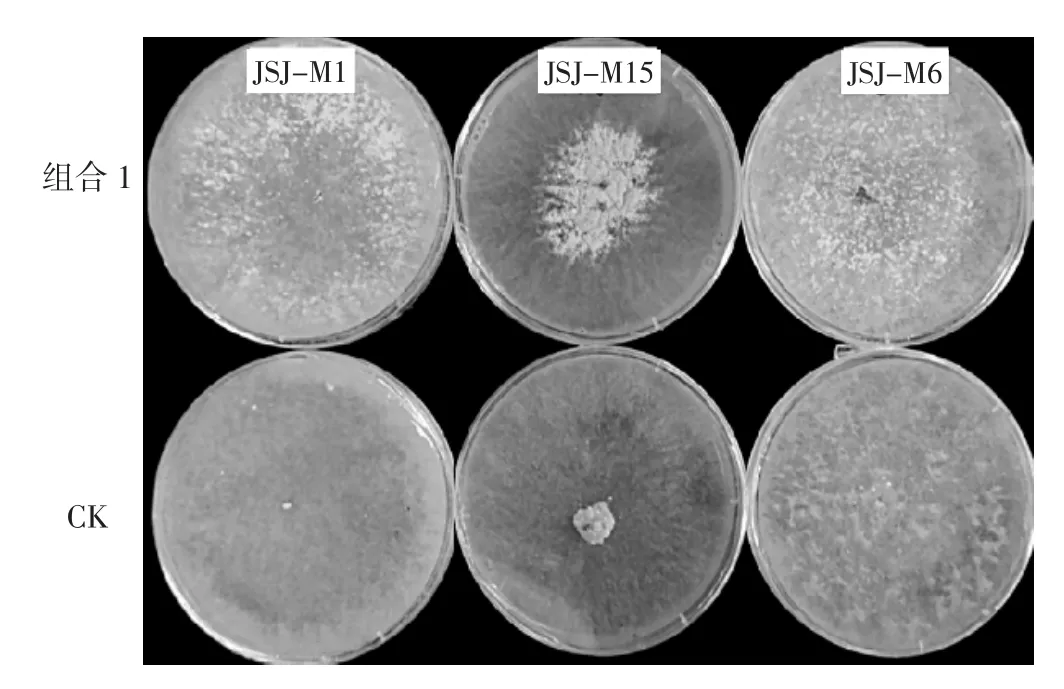
图13 组合1培养基中3个羊肚菌菌株的菌丝生长及菌核形成情况Fig.13 Mycelial growth and sclerotium formation of three Morchella strains in the medium of group 1
2.6 羊肚菌的菌核形态
2.6.1 梯棱羊肚菌JSJ-M15菌核形成的形态变化
羊肚菌菌核在形成过程中形态不断发生变化,以梯棱羊肚菌JSJ-M15为例,其菌核形态变化见图14。
如图14所示,梯棱羊肚菌JSJ-M15菌核形成初期为白色;后期慢慢聚集变大,颜色逐渐变黄,形状不规则;随着培养时间的延长,菌核细胞分泌大量色素,菌核颜色呈现浅黄色、黄色、棕褐色、黑色的顺序变化。

图14 梯棱羊肚菌JSJ-M15菌核形成过程Fig.14 The sclerotium formation process of Morchella importuna JSJ-M15
2.6.2 3个羊肚菌菌株的菌核类型
在对3个不同品种的羊肚菌菌株进行培养的过程中发现出现了不同的菌核类型,见图15。
如图15所示,3个羊肚菌菌丝在试管和平板中的菌核形成情况不同,会出现4种菌核类型及无菌核的现象。出现的菌核类型包括:1)试管I型:菌核聚集在试管壁边缘;2)试管Ⅱ型:菌核分布在培养基表面;3)平板I型:菌核聚集在接种块中央,向边缘扩散;4)平板Ⅱ型:菌核在培养基表面分散分布。
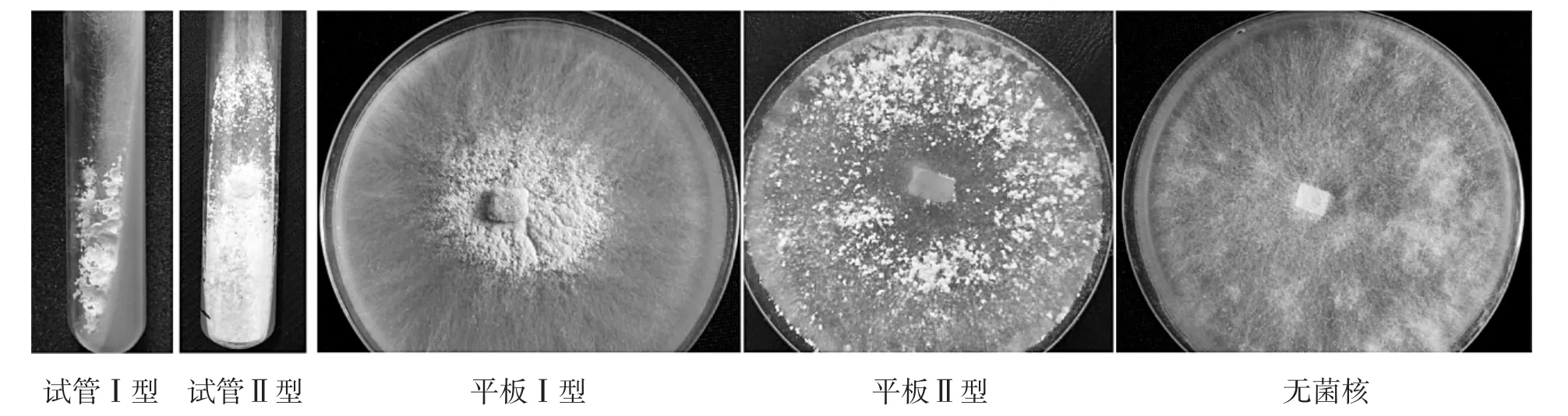
图15 羊肚菌不同的菌核类型Fig.15 Different sclerotium types of Morchella spp.
供试的六妹羊肚菌JSJ-M1、七妹羊肚菌JSJ-M6和梯棱羊肚菌JSJ-M15菌株在相同条件下,菌核的形成率分别为88%、85%和90%。就形成菌核的形态分布而言,六妹羊肚菌JSJ-M1和七妹羊肚菌JSJM6菌株形成的菌核多为试管Ⅱ型和平板Ⅱ型,梯棱羊肚菌JSJ-M15菌株形成的菌核多为试管Ⅰ型和平板I型。
3 结论与讨论
已有研究证明羊肚菌属真菌有土壤腐生型和外生菌根共生型2种生态型[1],因此,在羊肚菌属中仅有少数土壤腐生型品种实现了人工栽培,其中六妹羊肚菌、梯棱羊肚菌和七妹羊肚菌是全国广泛栽培的羊肚菌种类[2]。刁治民[3]、董雪[4]、柴林山[5]、朱永真[6-7]、熊亚等[8]对单个菌株或同一品种不同菌株的碳源、氮源利用情况进行研究,但因研究种类不同、菌株不同、栽培地域不同等差异,导致研究结果不尽相同;这说明不同地区、不同种类甚至同一物种的不同菌株之间的生物学特性均存在较大差异。因此,通过选择3个主栽品种的不同菌株进行对比试验,结果显示不同菌株对碳源、氮源的利用、无机盐的敏感程度以及菌核形成类型等均存在差异。通过比较分析,筛选出3个菌株通用的较优碳源为可溶性淀粉、糊精、几丁质、蔗糖和麦芽糖,较优氮源为玉米粉、豆饼粉、硝酸钾、硝酸钠等。3个菌株菌丝生长最差碳源均为木糖、半乳糖和乙醇,菌丝生长最差氮源均为酒石酸氨;羊肚菌菌丝对硝态氮的利用优于铵态氮。同时通过对初筛时菌丝生长速度最快的六妹羊肚菌JSJ-M1菌株进行育种试验,发现该菌株不适宜在以半乳糖、乙醇和木糖为碳源和以酒石酸铵为氮源的培养基上生长,其菌丝生长的最适温度为18℃~24℃,最适pH为5.5~7.0。在培养基中添加KH2PO4可以促进羊肚菌菌核的形成,且当质量浓度为0.5 g·L-1~2.0 g·L-1时较好,但对菌丝的生长没有显著的促进作用;在培养基中添加MgSO4对羊肚菌菌丝的生长有显著促进作用,且当质量浓度为0.5 g·L-1~2.0 g·L-1时较好,但对菌核的形成没有促进作用。这一结论为羊肚菌菌种生产、液体培养条件优化等提供参考依据。
Buscot等[9]认为,羊肚菌在人工栽培条件下能够形成2种菌核:一种形成时间早并簇集分布在培养皿边缘,称为簇集菌核,簇集菌核可能与形成子实体有关;另一种形成晚且分散分布,称为分散菌核,分散菌核主要起储藏营养和抵御低温的作用。此次供试的3个羊肚菌菌株在同一培养基上的菌丝生长情况、菌核形成能力以及菌核形成类型也不同,六妹羊肚菌和七妹羊肚菌2个品种形成的菌核多为试管Ⅱ型和平板Ⅱ型,梯棱羊肚菌品种形成的菌核多为试管Ⅰ型和平板I型。Volk[10]认为羊肚菌形成菌核的条件是低温培养或养分枯竭。试验结果表明,较低温有利于菌核的形成,4℃~21℃易形成菌核而且数量较多,高于24℃不能形成菌核,而且菌丝变黄,老化,分泌大量色素。
羊肚菌的菌核在菌种生产、栽培时常有发生,菌核的形成与培养基种类、培养基厚度、培养基pH、培养温度、氧气、光照、无机盐等许多因素密切相关[11-14]。在进行单因素试验,特别是以菌核为指标时,必须控制其他因素一致,否则结果可能差异比较大。这也可能是造成不同研究者的结果之间差异较大的原因之一。目前,虽然对羊肚菌的生物学特性研究较多,但碳氮比、温度、pH、氧气等影响菌丝生长、菌核形成的因素之间的相互作用关系,以及菌丝吸收营养的内在机制,诱发菌丝向菌核转变的机制等还有待进一步深入研究。
