胆绿素治疗作用的研究进展
2022-07-04白文娅霍思颖邵建林
白文娅,杨 渊,霍思颖,杨 鑫,邵建林
(昆明医科大学第一附属医院麻醉科,云南 昆明 650032)
衰老红细胞的代谢在维持机体正常生理功能方面必不可少,红细胞被巨噬细胞破坏后,释放出血红素(血红蛋白),血红素在脾脏的网状内皮细胞内被血红素氧合酶(HO)催化成胆绿素(Biliverdin)、一氧化碳(CO)和铁离子(Fe2+),胆绿素又被胆绿素还原酶(biliverdin reductase,BVR)还原成胆红素(Bilirudin)。研究发现在正常生理范围内的胆绿素、胆红素具有多种生理作用[1]。此外有研究发现,在胆绿素和胆红素相互转化的过程,可以形成一个抗氧化的循环系统,并将其称为胆绿素-胆红素氧化还原系统,胆绿素、胆红素发挥生理作用与此系统息息相关。因此通过对胆绿素、胆红素、胆绿素还原酶结构与代谢以及生理特性的研究,对目前许多疾病的预防和治疗具有重要意义。本文系统阐述了胆绿素、胆红素的结构与代谢、胆绿素-胆红素氧化还原系统、以及胆绿素的作用及机制,以期为未来胆绿素在临床当中的应用提供理论依据。
1 胆绿素的结构与代谢
胆绿素是一种无毒、水溶性、带有2 条丙氨酸侧链的线性四吡咯分子。研究发现,在爬行动物、两栖动物、鸟类和鱼类当中,胆绿素是血红素代谢的终产物[2]。做为蛋壳的主要成分之一,胆绿素可通过清除氧自由基、减少突变、抑制病毒复制等作用,保护胚胎免受外界刺激的损伤[3-4]。但在哺乳动物体内,胆绿素在数分钟内即可被胆绿素还原酶还原成胆红素[5]。
胆绿素有α、β、γ、δ 4 个亚基,由于血红素α 位碳原子具有高度选择性,所以哺乳动物体内95%~97%的胆绿素异构体是胆绿素-Ⅸα,其余3%~5%为胆绿素-IXβ/δ,前者由胆绿素还原酶A 催化,后者由胆绿素还原酶B 催化[6]。在胆绿素转化成胆红素的过程中,两个胆绿素分子与胆绿素还原酶结合,其中一个胆绿素分子接受还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide A denosine phosphare hydrogen,NADPH)提供的氢原子,另一个胆绿素分子通过邻近的精氨酸残基向第一个胆绿素分子提供一个质子,接着胆绿素还原酶水解胆绿素分子中的γ-甲基桥,最终生成胆红素[7]。此外有研究发现,经十二指肠给药后,在肠道菌群的作用下,胆绿素可转化为更稳定的胆红素磺酸盐[8],但具体的化学反应过程还需要进一步探索。
2 胆红素的结构与代谢
胆红素是一种亲脂性的线性四吡咯分子,通常笔者所指的胆红素是胆红素-IXα,它是由胆红素还原酶A 催化胆绿素-IXα 而来。胆红素在人体的正常范围为1.71~17.1 µmol/L,如若超过34.2 µmol/L 将会对机体产生毒性作用。20 世纪40 年代,由德国科学家Hans Fisher 首次提出胆红素的化学结构[9],研究认为胆红素分子内的氢键是保持其稳定构象及生理功能的关键,也正是这些氢键使胆红素具有明显的亲脂性,从而影响其本身的代谢[10]。此外胆红素分子还能够通过结合氧自由基,使C10 位上的氢原子由无活性转化为有活性,从而发挥抗氧化作用[11]。
在哺乳动物体内,80%~85%的胆红素由血红素代谢而来,15%~20%来源于骨髓中破坏的红细胞前体等物质。由细胞色素P450提供氧气分子和电子,血红素氧合酶打开血红素环,接着胆红素还原酶利用NADPH 提供的质子和电子,将胆绿素还原成间接胆红素(未结合胆红素)[12]。未结合胆红素释放入血后,迅速被血液中的白蛋白识别结合,使胆红素不能发挥细胞毒性作用。然后胆红素随血液循环进入到肝脏,在尿苷二磷酸葡糖醛酸基转移酶(UGTs)的作用下,发生葡萄糖醛酸化反应,形成直接胆红素,直接胆红素在细胞表面的多药耐药相关蛋白(multidrug resistancerelated protein,MRP)的作用下以浓度梯度的方式排泄入胆汁[13],最后通过肠道及肾脏排出或者经过肠肝循环再次利用。
3 胆绿素-胆红素氧化还原系统
如前所述,在胆绿素与胆红素相互转化的过程中,构成了一个可以不断的消耗氧自由基的循环系统,将其称为胆绿素-胆红素氧化还原系统[14](图1)。根据胆红素与胆绿素的结构与代谢特点,很多人就提出疑问,为什么要再次经过复杂的还原步骤,将无毒的胆绿素转化成有毒的胆红素?后来的研究发现这一转化过程可能与以下原因有关:(1)胆红素能与kelch 样ECH 关联蛋1(Keap1)蛋白结合,激活核因子E2 相关因子2(Nrf2),上调血红素氧合酶的表达[15];(2)在此系统中可以激活胆绿素还原酶,胆绿素还原酶不仅在机体的生理代谢过程中也同样发挥着不可替代的作用[16-17],且可放大胆绿素/胆红素的生理作用[18];(3)也有研究认为正是此氧化还原系统的存在,使胆绿素和胆红素的抗氧化能力明显强于其他抗氧化剂[19]。
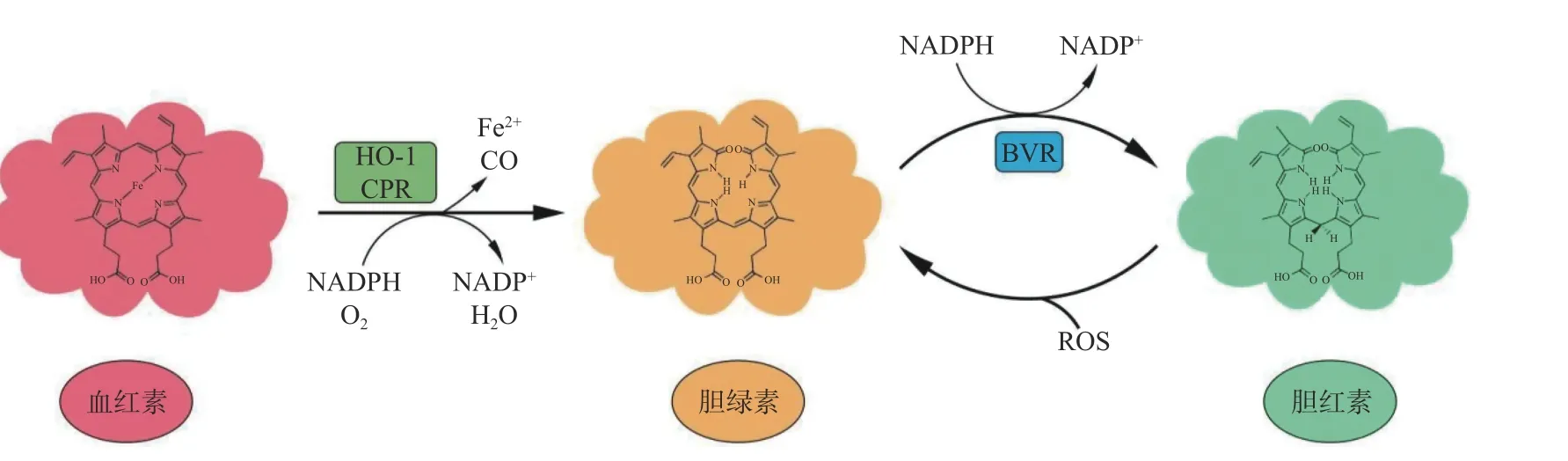
图1 胆绿素、胆红素氧化还原系统Fig.1 The biliverdin-bilirubin redox recycling system
4 胆绿素的作用及机制
4.1 胆绿素的抗氧化作用及机制
氧化损伤是指在外界各种不利因素的刺激下,导致机体的氧化和抗氧化作用失衡,引起活性氧的生成过多和/或清除障碍,最终通过多种机制引起组织器官的损伤。由于胆绿素和胆红素在相互转化的过程种,可以不断的消耗氧自由基,所以胆绿素的抗氧化作用一直是近年来研究的热点之一。研究发现,一分子的胆绿素可消耗4.7 分子的氧自由基,从而在许多疾病中发挥重要作用[20]。Manish 等[21]研究表明,胆绿素可以通过清除氧自由基,抑制NADPH 氧化酶的活性,增加糖尿病患者的血糖耐受。还有研究发现,胆绿素可通过不断的消耗氧自由基,减轻脑死亡致大鼠肺损伤[22]。此外在神经系统的神经递质传递过程中,胆绿素/胆红素通过消耗超氧阴离子,减少神经元死亡,起到神经保活作用[23]。Maria J 等[24]研究发现,在由胆汁酸堆积引起的氧化应激反应中,胆绿素可以不依赖于胆红素还原酶或者血红素氧合酶系统,减轻肝细胞损伤。在由中波紫外线引起的角膜以及皮肤损伤过程中,胆绿素可通过抑制MAPK 信号通路抑制脂质过氧化,从而减轻氧化损伤[25-26]。
4.2 胆绿素的抗炎作用及机制
炎性反应是导致许多疾病发生发展的主要原因之一。其中NF-κB 信号通路,JAK-STAT 信号通路以及MAPK 信号通路是细胞内3 条主要的炎症信号通路。活性氧是主要的炎性介质,因此我们有理由相信胆绿素在发挥抗氧化作用的同时,也具有一定的抗炎作用。龚睿等[27]研究证实,胆绿素可以通过影响NF-κB 信号通路,进而抑制NLRP3 炎性体的形成。在胆红素还原酶的协同作用下,胆绿素可通过eNOS/NO/TLR4 信号轴抑制炎症反应[28]。在肝缺血再灌注损伤中,胆绿素可通过NF-κB 或者PI3K/Akt 信号通路,降低细胞粘附分子的表达,抑制单核细胞浸润改善肝功能[29]。胆绿素还可通过MAPK 等信号通路减轻肺缺血再灌注损伤[30]。本课题组利用大鼠MACO/R模型也研究发现,与未经胆绿素处理组(单纯脑缺血-再灌注组,C 组)相比,SD 大鼠于再灌注前15 min,再灌注后4 h,第2 天开始每天2 次经腹腔注注射35 mg/kg 的胆绿素后(脑缺血-再灌注损伤+胆绿素处理组,BV 组),SD 大鼠再灌注后1 d,2 d,3 d,4 d,5 d 的神经功能损伤程度减轻;再灌注48 h 后的脑梗死体积减小;再灌注3 h,6 h,12 h 后脑缺血-再灌注侧TNF-α、IL-6、IL-1β表达下调;此外胆绿素还可降低缺血侧脑组织中小胶质细胞的表达和Iba-1/CD68 蛋白的表达,通过抑制小胶质细胞活化而减轻大鼠脑缺血再灌注损伤[31-32],且通过全转录组基因分析发现,差异表达的基因主要富集与NF-κB 信号通路[33]。由于胆绿素的抗炎作用,胆绿素也与脓毒症性休克、下颌关节炎等疾病的发生发展密切相关[34-35]。
4.3 胆绿素抑制免疫反应的作用及机制
免疫反应是一种机体清除异己成分或者突变自体成分的防御机制,但过度的免疫反应会毒机体造成许多不可避免的损伤。尤其是在器官移植过程中,需要采取有效的措施抑制过度免疫反应。免疫反应总是与炎症反应密不可分,胆绿素在发挥抗氧化、抗炎的同时,也具有一定的免疫抑制作用。胆绿素可通过抑制T 细胞增殖,提高受体对同种异体心脏移植物的耐受性,其机制可能是胆绿素可降低活化T 细胞核因子(nuclear factor of activated T cell,NFAT)的表达及抑制NF-κB 信号通路的活化有关[36]。Ferenc Zsila 等[37]利用光谱等技术发现,内源性胆绿素可能为α1-酸糖蛋白(α1-acid glycoprotein,AAG)的配体,AAG 是人类血清的急性期成分,能够调节免疫反应,而胆绿素则可通过与AAG 结合抑制免疫反应。胆绿素还可用来治疗一些免疫炎症性疾病,如痛风性关节炎[38],胶原蛋白诱导的关节炎[39]。Melissa P.Homsher 等[40-41]研究发现,当发生免疫反应时,白鹌鹑脾脏中的胆绿素浓度会降低,进一步表明胆绿素可能与免疫反应有关,但具体的机制仍待一进步阐明。
4.4 胆绿素抑制血管平滑肌细胞增殖的作用及机制
血管平滑肌细胞在应对炎性刺激以及氧化应激损伤的过程中,常常会发生异常过度增殖,进而引起内皮功能障碍及动脉硬化性疾病。同时在器官移植等手术过程中,由于需要对血管进行操作,不可避免的会引起血管平滑肌细胞的增殖和损伤,最终导致器官缺血、血管狭窄、心肌梗死等严重并发症[42]。因此抑制血管平滑肌细胞的过度增殖的研究具有重要意义。胆绿素可通过影响MAPK 信号通路,抑制细胞周期蛋白D1、A 和细胞周期数依赖性蛋白激酶(Cyclin-dependent kinase,CDK)的表达,抑制细胞增殖,减轻动静脉移植或者球囊成形术过程中的血管损伤[43],影响动脉硬化性疾病的结局[44]。Moraes 等[45]研究发现,血管平滑肌细胞异常增殖的过程中,可引起胆绿素异常增多,这些物质又可以反馈的抑制血管平滑肌细胞的增殖,减轻炎症因子以及氧自由基对血管平滑肌的损伤。此外还有研究表明,胆绿素可以通过影响表皮生长因子受体的表达,以及PI3K/Akt 信号通路,抑制头颈癌细胞的增殖[46]。
4.5 胆绿素调控细胞凋亡的作用及机制
细胞凋亡是由一系列分子和信号通路参与调控的细胞自主有序的死亡方式。在氧化应激损伤、炎症反应的过程中,必然伴有细胞凋亡的发生。胆绿素调控细胞凋亡的机制可能与其清除氧自由基,影响线粒体功能,抑制凋亡相关蛋白的表达有关[47]。吕倩等[48]研究发现,胆绿素可通过抑制氧化损伤,减少顺铂诱导的细胞凋亡。此外,孙洁芸等研究证实,胆绿素可通过抑制人Ⅱ型肺泡上皮细胞凋亡,从而减轻肺缺血-再灌注损伤[49]。也有研究发现,在脑缺血-再灌注损伤中,胆绿素可通过抑制凋亡相关蛋白的表达,从而减轻脑缺血-再灌注损伤[50]。纵然有很多研究证实,胆绿素可以抑制细胞凋亡的发生,但是细胞凋亡是由多个分子,多条信号通路参与的,因此未来笔者需要更多的研究来证实胆绿素抑制细胞凋亡的分子机制。
4.6 胆绿素的最新应用研究进展
虽然在哺乳动物体内,胆绿素易被还原成胆红素,使其不能像胆红素那样可以做为临床许多疾病的诊断参考指标。但是随着科学技术的进步,目前仍然可以利用一些新的技术来测定胆绿素浓度,例如低通量、高效液相色谱或涉及测定吸光度变化率的酶测定方法,或者利用胆绿素与红外荧光蛋白选择性结合的特性,利用荧光免疫方法测定胆绿素浓度[51-52],而且目前已有研究证实可以将胆绿素和一些化合物或者蛋白结合,形成稳定不易降解的化合物[53],这就为未来胆绿素做为一种临床诊断和检测指标,甚至于临床治疗提供了依据。作为一种线性四吡咯分子,胆绿素不仅具有优越的生物相容性,还具有明确的代谢途径,最近越来越多的研究利用胆绿素制成稳定的胆绿素纳米剂,进而在临床当中进行诊断和治疗[54-55]。相信随着新技术的发展,胆绿素未来在临床的应用将会取得突破性的进展。
5 小结
综上所述,胆绿素做为血红素主要的代谢产物之一,依靠胆绿素-胆红素氧化还原系统,发挥抗氧化、抗炎、抑制免疫反应、稳定血管内皮细胞、调控细胞凋亡等作用,进而使其在许多疾病发生发展的过程中具有潜在的治疗作用(图2)。而且随着对其探索的不断深入,以及目前医学技术的飞速发展,胆绿素未来在临床的应用将会取得突破性的进展。
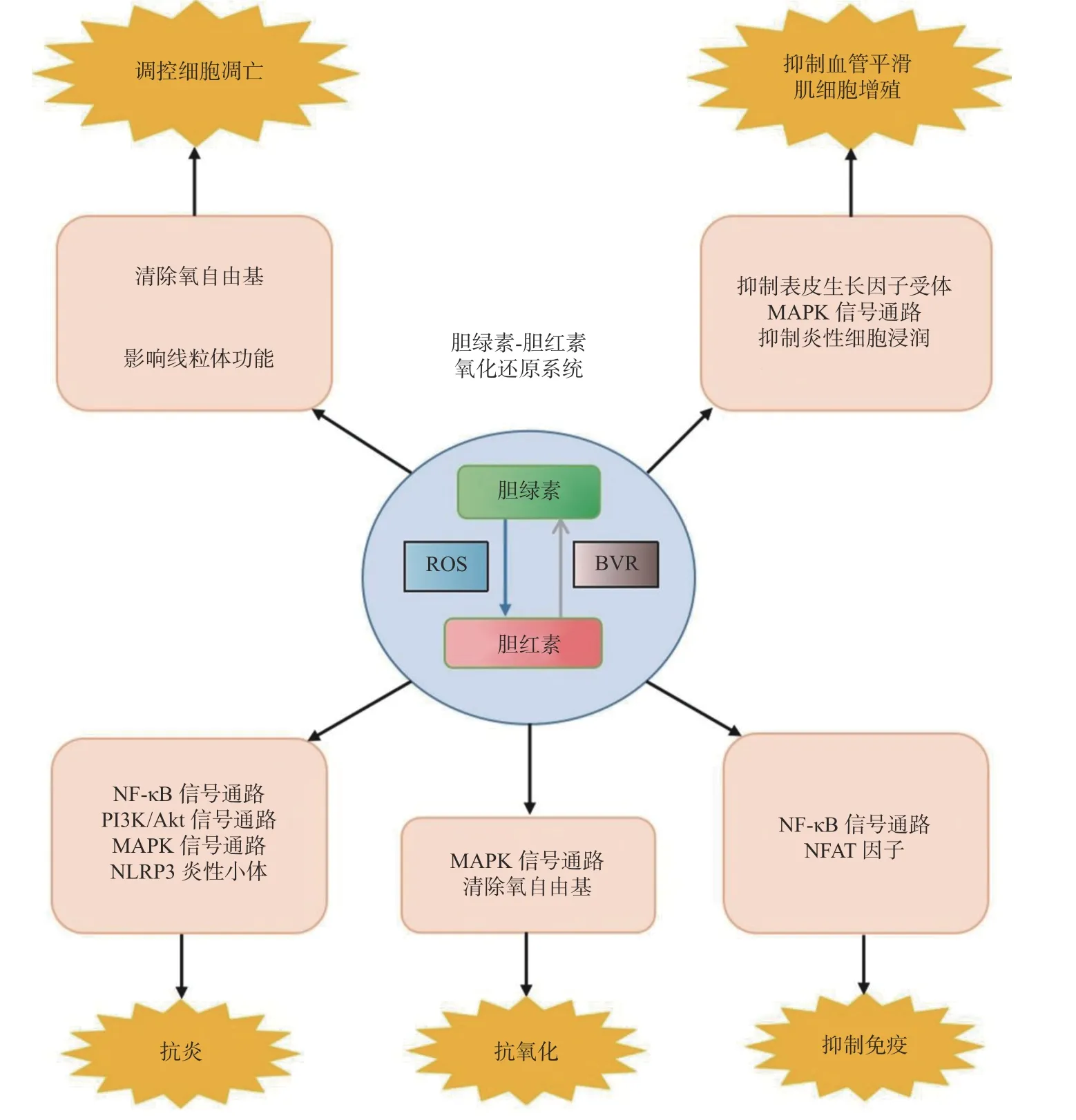
图2 胆绿素作用及机制图Fig.2 Role of biliverdin in different pathophysiological processes
